Léčba radionuklidy peptidových receptorů - Peptide receptor radionuclide therapy - Wikipedia
| Léčba radionuklidy peptidových receptorů | |
|---|---|
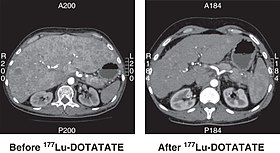 CT nefunkční pankreatické NET před a 6 měsíců po úspěšné léčbě čtyřmi cykly 177Lu DOTATUJTE. | |
| Specialita | onkologie |
Léčba radionuklidy peptidových receptorů (PRRT) je typ neuzavřená radioterapie zdroje, používat radiofarmaka na které se zaměřuje peptid receptory dodávat lokalizovanou léčbu, obvykle pro neuroendokrinní nádory (NET).[1]
Mechanismus
Klíčovou výhodou PRRT oproti jiným metodám radioterapie je schopnost cílit na dodávku terapeutika radionuklidy přímo do nádoru nebo cílového místa. To funguje, protože některé nádory mají ve srovnání s normální tkání hojnost (nadměrnou expresi) peptidových receptorů. Radioaktivní látku lze kombinovat s příslušným peptidem (nebo jeho analogem) tak, aby se přednostně vážela na nádor.[2][3] S emitor gama jako radionuklid lze techniku použít pro zobrazování pomocí a gama kamera nebo PET skener lokalizovat nádory. Při spárování s alfa nebo beta zářiče, lze dosáhnout terapie, jako v PRRT.[4]
Současná generace cílů PRRT somatostatin receptory, s řadou analogických materiálů, jako jsou oktreotid a další DOTA sloučeniny. Jsou kombinovány s indium-111, lutetium-177 nebo ytrium-90 k léčbě.[5] 111Primárně se používá pouze k zobrazování, ale kromě své emise gama existují také šnekové elektrony emitované, což může mít terapeutický účinek ve vysokých dávkách.[6]
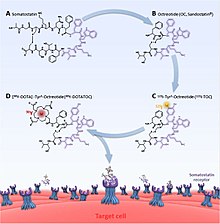
Radiofarmaka PRRT jsou konstruována ze tří složek; radionuklid, chelátor a analog somatostatinu (peptid). Radionuklid poskytuje skutečný terapeutický účinek (nebo emise, jako je fotony, pro zobrazování). Chelátor je základní vazbou mezi radionuklidem a peptidem. Pro 177Lu a 90Y to je obvykle DOTA (kyselina tetrakarboxylová a její varianty) a DTPA (kyselina pentetová) pro 111V.[7] Další chelátory známé jako NOTA (triazacyklononan Kyselina trioctová) a HYNIC (hydrazinonikotinamid) byly rovněž experimentovány, i když spíše pro zobrazovací aplikace.[8][9] Analog somatostatinu ovlivňuje biodistribuci radionuklidu, a tedy na to, jak účinně lze cílit jakýkoli účinek léčby. Změny ovlivní které somatostatinový receptor je nejsilněji cílená. Například DOTA-lanreotid (DOTALAN) má nižší afinitu k receptor 2 a vyšší afinitu k receptor 5 ve srovnání s DOTA-oktreotid (DOTATOC).[6][10]
Aplikace
Soubor výzkumu účinnosti současné PRRT je slibný, ale omezený. Úplná nebo částečná odpověď na léčbu byla pozorována u 20–30% pacientů ve studiích léčených přípravkem 177Lu-DOTATOVAT nebo 90Y-DOTATOC, mezi nejčastěji používané léky PRRT.[1][11][12][13] Pokud jde o srovnání těchto dvou PRRT, Y-značených a Lu-značených PRRT, zdá se, že Y-značené je účinnější pro větší nádory, zatímco Lu-značené je lepší pro menší a primární nádory. Nedostatek emise with u PPRT značených Y je také důležitým rozdílem mezi Lu peptidy a Y peptidy. Zejména u PRRT označeného Y je obtížné nastavit dávku záření specifickou pro potřeby pacienta.[14] Ve většině případů se PRRT používá k léčbě rakoviny gastroenteropankreatické a bronchiální v některých případech feochromocytom, paraganglioma, neuroblastom nebo medulární karcinom štítné žlázy.[1] Jsou zkoumány různé přístupy ke schválení účinnosti a omezení vedlejších účinků, včetně radiosenzitizující drogy, frakcionace režimy a nové radionuklidy.[15] Alfa emitory, které mají mnohem kratší rozsahy ve tkáni (omezují účinek na zdravou tkáň v okolí), jako např vizmut-213 nebo aktinium-225 označené DOTATOC jsou zvláště zajímavé.[16]
Dozimetrie
Terapeutické léčby PRRT obvykle zahrnují několik gigabecquerels (GBq) aktivity.[17] Několik radiofarmak umožňuje simultánní zobrazování a terapii, což umožňuje provádět přesné dozimetrické odhady. Například bremsstrahlung emise z 90Y a gama emise z 177Lu lze detekovat gama kamerou. V jiných případech může být zobrazování provedeno značením vhodného radionuklidu na stejný peptid, jaký byl použit pro terapii.[18] Mezi radionuklidy, které lze použít pro zobrazování, patří galium-68, technecium-99m a fluor-18.[17]
Aktuálně používané peptidy mohou mít za následek vysoké ledviny dávky, protože radiofarmakum je uchováno po relativně dlouhou dobu. V některých případech se proto používá ochrana ledvin, která má formu alternativních látek, které snižují absorpci ledvinami.[5][17][19]
Dostupnost
PRRT dosud není široce dostupný, s různými radiofarmaky v různých stádiích klinické testy. Náklady na malosériovou výrobu příslušných radionuklidů jsou vysoké.[20] Náklady na Lutatheru, reklamu 177Produkt Lu-DOTATATE byl výrobcem citován jako 71 500 GBP (80 000 EUR nebo 94 000 USD v červenci 2018) pro 4 správy o 7,4 GBq.[21]
Spojené státy
177Lu-DOTATATE (mezinárodní nechráněný název: lutetium (177Lu) oxodotreotid) byl schválen FDA počátkem roku 2018 k léčbě gastroenteropankreatických neuroendokrinních nádorů (GEP-NET).[22][23]
Evropa
Registrace pro 177Lu-DOTATATE udělil Evropská agentura pro léčivé přípravky dne 26. září 2017.[24] 90Y-DOTATOC (mezinárodní nechráněný název: yttrium (90Y) edotreotid) a 177Lu-DOTATOC jsou označeny jako léky na vzácná onemocnění, ale dosud neobdrželi rozhodnutí o registraci.[25][26]
Spojené království
V pokynech zveřejněných v srpnu 2018 lutetium (177Lu) oxodotreotid doporučil PĚKNÝ pro léčbu neresekovatelných nebo metastatických neuroendokrinních nádorů.[27]
Austrálie
Výzkum v Austrálii týkající se použití protilátek značených lutetiem-177 pro různé druhy rakoviny začal na Ústavu nukleární medicíny v Fremantle Hospital and Health Service (FHHS), Fremantle, Austrálie na konci 90. let.[28] První terapie v Austrálii využívají 177Lu-DOTATATE PRRT pro NET byl zahájen v únoru 2005 na zkušebním základě pod správou Therapeutického zboží (TGA ) Schéma zvláštního přístupu (SAS) a soucitné používání neschváleného terapeutického zboží.[29][30] Krátce poté 177Lu-DOTATATE PRRT byl poskytován západoaustralským pacientům s NET rutinně v rámci SAS i v rámci různých probíhajících výzkumných studií.[31][32][33][34][35][36][37][38]
V Austrálii většina center syntetizuje peptid lutecia-177 na místě z chloridu lutecia-177 a příslušného peptidu.[39]
Vedlejší efekty
Jako každá forma radioterapie, ionizující záření může poškodit zdravou tkáň i zamýšlený cíl léčby. Záření z lutecia (177Lu) oxodotreotid může způsobit poškození, když lék prochází tubuly v ledvinách.[40] Arginin / lysin lze použít ke snížení ozáření ledvin během léčby radionuklidem s peptidovým receptorem lutetiem (177Lu) oxodotreotid.[40]
Viz také
Reference
- ^ A b C Zaknun, John J .; Bodei, L .; Mueller-Brand, J .; Pavel, M. E .; Baum, R. P .; Hörsch, D .; O’Dorisio, M. S .; O’Dorisiol, T. M .; Howe, J. R .; Cremonesi, M .; Kwekkeboom, D. J. (7. února 2013). „Společné praktické pokyny IAEA, EANM a SNMMI k léčbě radionuklidy peptidových receptorů (PRRNT) u neuroendokrinních nádorů“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 40 (5): 800–816. doi:10.1007 / s00259-012-2330-6. PMC 3622744. PMID 23389427.
- ^ „Informační list: Co je to radionuklidová terapie peptidovými receptory (PRRT)?“. SNMMI. Citováno 12. května 2018.
- ^ Reubi, Jean Claude (srpen 2003). „Peptidové receptory jako molekulární cíle pro diagnostiku a terapii rakoviny“. Endokrinní hodnocení. 24 (4): 389–427. doi:10.1210 / er.2002-0007. PMID 12920149.
- ^ Dash, Ashutosh; Chakraborty, Sudipta; Pillai, Maroor Raghavan Ambikalmajan; Knapp, Furn F. (Russ) (březen 2015). „Radionuklidová terapie peptidovým receptorem: přehled“. Rakovinová bioterapie a radiofarmaka. 30 (2): 47–71. doi:10.1089 / cbr.2014.1741. PMID 25710506.
- ^ A b van Essen, Martijn; Krenning, Eric P .; Kam, Boen L. R .; de Jong, Marion; Valkema, Roelf; Kwekkeboom, Dik J. (2. června 2009). "Radionuklidová terapie peptid-receptor pro endokrinní nádory". Recenze přírody Endokrinologie. 5 (7): 382–393. doi:10.1038 / nrendo.2009.105. PMID 19488074. S2CID 22933835.
- ^ A b Speer, Tod W. (2012). Cílená radionuklidová terapie. Lippincott Williams & Wilkins. p. 40. ISBN 9781451153262.
- ^ Bombardieri, Emilio; Seregni, Ettore; Evangelista, Laura; Chiesa, Carlo; Chiti, Arturo (2018). Klinické aplikace cílené terapie nukleární medicíny. Springer. p. 213. ISBN 9783319630670.
- ^ PILA, MAUNG MAUNG; Peitl, Petra; Velikyan, Irina (červen 2012). "Medicinal Radiopharmaceutical Chemistry of Metal Radiopharmaceuticals". KOSMOS. 08 (1): 11–81. Bibcode:2012 Cosmo ... 8 ... 11S. doi:10.1142 / S0219607712300044.
- ^ Fani, Melpomeni; Peitl, Petra; Velikyan, Irina (15. března 2017). „Současný stav radiofarmak pro terapeutiku neuroendokrinních novotvarů“. Léčiva. 10 (4): 30. doi:10,3390 / ph10010030. PMC 5374434. PMID 28295000.
- ^ Stigbrand, Torgny; Carlsson, Jorgen; Adams, Gregory P. (2008). Cílená léčba radionuklidovými nádory: biologické aspekty. Springer Science & Business Media. p. 122. ISBN 9781402086960.
- ^ Kjaer, A; Knigge, U (červen 2015). „Použití radioaktivních látek při diagnostice a léčbě neuroendokrinních nádorů“. Skandinávský žurnál gastroenterologie. 50 (6): 740–7. doi:10.3109/00365521.2015.1033454. PMC 4487540. PMID 25959100.
- ^ Cives, Mauro; Strosberg, Jonathan (20. února 2017). „Radionuklidová terapie pro neuroendokrinní nádory“. Aktuální onkologické zprávy. 19 (2): 9. doi:10.1007 / s11912-017-0567-8. PMID 28220446. S2CID 11265443.
- ^ Bison, Sander M .; Konijnenberg, Mark W .; Melis, Marleen; Pool, Stefan E .; Bernsen, Monique R .; Teunissen, Jaap J. M .; Kwekkeboom, Dik J .; de Jong, Marion (5. března 2014). „Radionuklidová terapie peptidovými receptory pomocí radioaktivně značených analogů somatostatinu: zaměření na budoucí vývoj“. Klinické a translační zobrazování. 2 (1): 55–66. doi:10.1007 / s40336-014-0054-2. PMC 3991004. PMID 24765618.
- ^ Dash, Ashutosh; Chakraborty, Sudipta; Pillai, Maroor Raghavan Ambikalmajan; Knapp, Furn F. (Russ) (březen 2015). „Radionuklidová terapie peptidovým receptorem: přehled“. Rakovinová bioterapie a radiofarmaka. 30 (2): 47–71. doi:10.1089 / cbr.2014.1741. ISSN 1084-9785. PMID 25710506.
- ^ Sabet, Amir; Biersack, Hans-Jürgen; Ezziddin, Samer (leden 2016). „Pokroky v léčbě radionuklidem s peptidovým receptorem“. Semináře z nukleární medicíny. 46 (1): 40–46. doi:10.1053 / j.semnuclmed.2015.09.005. PMID 26687856.
- ^ Lee, Sze Ting; Kulkarni, Harshad R .; Singh, Aviral; Baum, Richard P. (2017). „Theranostika neuroendokrinních nádorů“. Viscerální medicína. 33 (5): 358–366. doi:10.1159/000480383. PMC 5697502. PMID 29177165.
- ^ A b C IAEA (2013). Praktické pokyny pro terapii radionuklidy peptidových receptorů (PRRNT) pro neuroendokrinní nádory. Série IAEA pro lidské zdraví č. 20. Vídeň: Mezinárodní agentura pro atomovou energii. ISBN 978-92-0-129210-0.
- ^ Cremonesi, M; Botta, F; Di Dia, A; Ferrari, M; Bodei, L; De Cicco, C; Rossi, A; Bartolomei, M; Mei, R; Severi, S; Salvatori, M; Pedroli, G; Paganelli, G (únor 2010). „Dozimetrie pro léčbu radioaktivně značenými analogy somatostatinu. Přehled“. Čtvrtletní časopis nukleární medicíny a molekulárního zobrazování. 54 (1): 37–51. PMID 20168285.
- ^ Rolleman, Edgar J .; Melis, Marleen; Valkema, Roelf; Boerman, Otto C .; Krenning, Eric P .; de Jong, Marion (14. listopadu 2009). „Ochrana ledvin během léčby radionuklidy peptidovými receptory s analogy somatostatinu“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 37 (5): 1018–1031. doi:10.1007 / s00259-009-1282-r. PMID 19915842. S2CID 31863612.
- ^ Dash, Ashutosh; Pillai, Maroor Raghavan Ambikalmajan; Knapp, Furn F. (17. února 2015). „Výroba 177Lu pro cílenou radionuklidovou terapii: dostupné možnosti“. Nukleární medicína a molekulární zobrazování. 49 (2): 85–107. doi:10.1007 / s13139-014-0315-z. PMC 4463871. PMID 26085854.
- ^ „Informace o oxodotreotidu lutecia (177Lu)“. PĚKNÝ. National Institute for Health and Care Excellence. 29. srpna 2018. Citováno 3. září 2018.
- ^ „Lutetium Lu 177 Dotatate Schváleno FDA“. Objev rakoviny. 8 (4): OF2. Dubna 2018. doi:10.1158 / 2159-8290.CD-NB2018-021. PMID 29487054.
- ^ Úřad komisaře (26. ledna 2018). „FDA schvaluje novou léčbu některých druhů rakoviny trávicího traktu“. Úřad pro kontrolu potravin a léčiv. Citováno 20. května 2018.
- ^ "Lutathera". Evropská agentura pro léčivé přípravky. Citováno 24. května 2018.
- ^ „Yttrium (90Y) edotreotide“. Evropská agentura pro léčivé přípravky. Citováno 24. května 2018.
- ^ „EU / 03/14/1269“. Evropská agentura pro léčivé přípravky. Citováno 7. listopadu 2020.
- ^ „Lutodium (177Lu) oxodotreotid k léčbě neresekovatelných nebo metastatických neuroendokrinních nádorů [TA539]“. National Institute for Health and Care Excellence. 29. srpna 2018. Citováno 3. září 2018.
- ^ Turner, J. Harvey (1998-12-31). "Radiolanthanidy v terapeutické jaderné onkologii (konference) | ETDEWEB". www.osti.gov. Citováno 2019-10-04.
- ^ Australské vládní ministerstvo pro správu zdravotnického terapeutického zboží (01.01.2018). „Schéma zvláštního přístupu: Pokyny pro lékaře a sponzory“. Správa terapeutického zboží (TGA). Citováno 2019-10-04.
- ^ „COSA: NETs guidelines / Radionuclide Therapy - Clinical Guidelines Wiki“. wiki.cancer.org.au. Citováno 2019-10-04.
- ^ Claringbold, Phillip G .; Brayshaw, Paul A .; Price, Richard A .; Turner, J. Harvey (01.02.2011). „Fáze II studie radiopeptidu 177Lu-oktreotátu a kapecitabinu v léčbě progresivních diseminovaných neuroendokrinních nádorů“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 38 (2): 302–311. doi:10.1007 / s00259-010-1631-x. ISSN 1619-7089. PMID 21052661. S2CID 11627014.
- ^ Turner, J. H. (2009). „Definování farmakokinetiky pro individuální dozimetrii pacientů v rutinním radiopeptidu a radioimunoterapii rakoviny: australské zkušenosti“. Současný farmaceutický design. 15 (9): 966–82. doi:10.2174/138161209787582020. PMID 19275661.
- ^ Claringbold, Phillip G .; Price, Richard A .; Turner, J. Harvey (2012-10-18). „Fáze I-II Studie radiopeptidu 177L-oktreotátu v kombinaci s kapecitabinem a temozolomidem u pokročilých neuroendokrinních nádorů nízkého stupně“. Rakovinová bioterapie a radiofarmaka. 27 (9): 561–569. doi:10.1089 / cbr.2012.1276. ISSN 1084-9785. PMID 23078020.
- ^ Kesavan, Murali; Claringbold, Phillip G .; Turner, J. Harvey (2014). „Hematologická toxicita kombinované 177L-oktreotátové radiopeptidové chemoterapie neuroendokrinních nádorů gastroenteropankreatu v dlouhodobém sledování“. Neuroendokrinologie. 99 (2): 108–117. doi:10.1159/000362558. ISSN 1423-0194. PMID 24714208. S2CID 28778711.
- ^ Claringbold, Phillip G .; Turner, J. Harvey (srpen 2015). „NeuroEndocrine Tumor Therapy with Lutetium-177-octreotate and Everolimus (NETTLE): A Phase I Study“. Rakovinová bioterapie a radiofarmaka. 30 (6): 261–269. doi:10.1089 / cbr.2015.1876. ISSN 1084-9785. PMID 26181854.
- ^ Claringbold, Phillip G .; Turner, J. Harvey (10.06.2015). „Pankreatická neuroendokrinní kontrola nádoru: Trvalá objektivní odpověď na kombinaci 177Radiopeptidová chemoterapie Lu-oktreotát-kapecitabin-temozolomid ". Neuroendokrinologie. 103 (5): 432–439. doi:10.1159/000434723. ISSN 0028-3835. PMID 26065489. S2CID 207591297.
- ^ Kesavan, Murali; Turner, J. Harvey (srpen 2016). „Myelotoxicita radionuklidové terapie peptidovými receptory u neuroendokrinních nádorů: desetiletí zkušeností“. Rakovinová bioterapie a radiofarmaka. 31 (6): 189–198. doi:10.1089 / cbr.2016.2035. ISSN 1084-9785. PMID 27419665.
- ^ Kesavan, Murali; Turner, J. Harvey; Meyrick, Danielle; Yeo, Sharon; Cardaci, Giuseppe; Lenzo, Nat P. (září 2018). „Záchranná radiopeptidová terapie pokročilého kastan-rezistentního karcinomu prostaty s membránovým antigenem specifickým pro prostatu specifickým pro lutecium-177: účinnost a bezpečnost v běžné praxi“ Rakovinová bioterapie a radiofarmaka. 33 (7): 274–281. doi:10.1089 / cbr.2017.2403. ISSN 1084-9785. PMID 29989440.
- ^ De Decker, Mario; Turner, J. Harvey (únor 2012). "Automatizovaný modul radioaktivního značení peptidů a protilátek pomocí Gallium-68, Lutetium-177 a Jod-131". Rakovinová bioterapie a radiofarmaka. 27 (1): 72–76. doi:10.1089 / cbr.2011.1073. ISSN 1084-9785. PMID 22149590.
- ^ A b „LysaKare EPAR“. Evropská agentura pro léčivé přípravky (EMA). Citováno 22. července 2020. Text byl zkopírován z tohoto zdroje, kterým je © Evropská agentura pro léčivé přípravky. Reprodukce je povolena za předpokladu, že je uveden zdroj.
