MTRR (gen) - MTRR (gene)
Methionin syntáza reduktáza také známý jako MSR je enzym že u lidí je kódován MTRR gen.[5][6]
Funkce
Methionin je zásadní aminokyselina potřebné pro syntézu bílkovin a metabolismus jednoho uhlíku. Jeho syntéza je katalyzována enzymem methionin syntáza. Methionin syntáza se nakonec stane neaktivní kvůli její oxidaci kobalamin kofaktor. Methioninsyntáza reduktáza regeneruje funkční methioninsyntasu prostřednictvím redukční methylace. Je členem rodiny elektronových transferáz ferredoxin-NADP (+) reduktázy (FNR).[6]
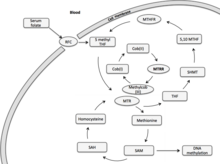
Methionin syntáza reduktáza (MTRR) se primárně podílí na redukční methylaci homocysteinu na methionin s využitím methylcob (I) alaminu jako meziproduktu metylového nosiče.[7] Methionin je esenciální aminokyselina u savců, nezbytná pro syntézu bílkovin a jeden metabolismus uhlíku. Ve své aktivované formě působí S-adenosylmethionin jako donor methylu při biologických transmethylačních reakcích a jako donor propylaminu při syntéze polyaminů.[7] Hlavním produktem demetylace methioninu je homocystein. K remetylaci homocysteinu dochází prostřednictvím kobalaminově závislého enzymu, methioninsyntázy (MTR).[7] Folátový cyklus je spojen s metabolismem homocysteinu prostřednictvím MTR.[8] Folát cirkulující krve (5-methyl tetrahydrofolát, 5-MTHF) daruje methylové skupiny MTR, které se využijí při buněčné methylaci. Methyl-kobaltová vazba meziproduktu metylového nosiče, methlycob (III) alaminu, je štěpena heterolyticky za vzniku kobalaminu ve vysoce reaktivním oxidačním stavu jako kobalt (I) alamin. Enzymově vázaný cob (I) alaminový kofaktor enzymu MTR funguje jako methylový nosič mezi 5-MTHF a homocysteinem.[7] Cob (I) alamin se oxiduje na cob (II) alamin přibližně jednou za 100 cyklů methylového přenosu, čímž se komplex Cob (I) alamin-MTR-enzym deaktivuje.[9] K reaktivaci tohoto enzymového komplexu dochází redukční remethylací pomocí MTRR s využitím S-adenosylmethioninu jako donoru methylu. Reaktivace MTR může také záviset na NADPH zahrnující dva redoxní proteiny, rozpustný cytochrom b5 a reduktázu 1. Tato cesta je však zodpovědná za malou roli v reaktivaci, zatímco MTRR zůstává hlavním přispěvatelem do této redukční reaktivace.
Mezi biologické procesy ovlivněné MTRR patří: metabolický proces s aminokyselinami síry, methylace DNA, metabolický proces methioninu, biosyntetický proces methioninu, methylace, S-adenosylmethioninový cyklus, homocysteinový katabolický proces, metabolický proces kyseliny listové, oxidačně-redukční proces a negativní regulace cystathioninu beta -syntázová aktivita.[7][8]
Gen MTRR
Methionin syntáza reduktáza (MTRR) gen primárně působí při redukční regeneraci kobaltu (I) alaminu (vitamin B12).[10] Cob (I) alamin je kofaktor, který udržuje aktivaci enzymu methioninsyntázy (MTR) Methionin syntáza, spojující metabolismus folátu a methioninu. Darování methylových skupin z folátu se využívá k buněčné a DNA methylaci, což ovlivňuje epigenetickou dědičnost.[10][7][11]
Aliasy
- 5-Methyltetrahydrofolát-Homocystein Methyltransferáza Reduktáza
- MSR
- [Methionin syntáza] - kobalamin methyltransferáza (redukce alaminu Cob (II))
- Methionin syntáza reduktáza, mitochondriální
- ES 1.16.1.8
- CblE
Mapování
Gen byl mapován na humánní chromozom 5. Páry genově specifických primerů vedly k PCR amplifikaci produktu odpovídající velikosti podle panelu hybridního mapování obsahujícího pouze chromozom 5 jako jeho lidský genetický materiál.[5] Sekvence DNA produktu odpovídala předem stanoveným genovým markerům specifickým pro tento chromozom. Přesná genová cytogenní poloha byla stanovena mapováním na umělý chromozomální konstrukt obsahující gen pomocí fluorescenční in situ hybridizace.[5] Přesné umístění genu MTRR bylo mapováno na 5p15.3-p15.2.[5]
Struktura
Gen MTRR je spojen s rodinou elektronových transferáz známou jako rodina ferredoxin-NADP (+) reduktázy (FNR). Nalezeno u 15 primátů a více než 16 tkání u lidí, MTRR je dlouhý 34 kb.[12] Gen obsahuje 15 exonů a zahrnuje četné cytolosické mitochondriální mRNA izoformy. Několik vazebných míst pro kofaktory pomáhá při udržování aktivity MTR prostřednictvím redukční remetylace. Všechny vazebné domény zahrnují selektivní a nekovalentní interakce kromě domény flavodoxin_1.[12]
Vazebná místa pro kofaktor
Flavodoxin-1 doména
Flavoproteiny jsou všudypřítomné biokatalyzátory vázající specifické redox aktivní protetické skupiny. Doména je spojena s proteiny pro přenos elektronů a používá se v systémech přenosu elektronů.[12] Kofaktor flavin-mononukleotid (FMN) je nekovalentně vázán na doménu, která je funkčně zaměnitelná s proteiny představujícími železo a síru regulující přenos elektronů nebo ferredoxiny.[12]
FAD
Flavin adenin dinukleotid v oxidované formě je FAD kofaktorem enzymů flavoprotein oxidoreduktázy. Flavoprotein pyridinový nukleotid cytochrom reduktázy, včetně FAD, katalyzují výměnu redukčních ekvivalentů (H + nebo elektrony). Počáteční donory elektronů a konečné akceptory elektronů obsahují nosiče s jedním elektronem a dva elektrony nesoucí nikotinamid dinukleotidy.[12]
NAD
Evoluční konzervovaná proteinová doména odpovídající aktivitě oxidoreduktázy. Vazba NAD katalyzuje redoxní reakce ke změně oxidačního stavu kovových iontů pomocí NADP + jako akceptoru elektronů.[12]
Aktivita methioninsyntázy reduktázy
Podílí se na reduktivní remetylaci cob (II) alaminu za použití S-adenosylhomocysteinu jako donoru methylu. Katalyzuje reakci:
[methionin syntáza] - cob (II) alamin + NADPH + H + + S-adenosylmethionin → [methioninsyntáza] -methylcob (I) alamin + S-adenosylhomocystein + NADP +.[12]
Aktivita akvakobalamin reduktázy (NADPH)
Patří do rodiny oxidoreduktázy a oxiduje kovové ionty, přičemž NADP + působí jako akceptor elektronů. Při katalyzování následující reakce používá FAD jako kofaktor:
2cob (II) alamin + NADP + 2aquacob (III) alamin + NADPH + H +.[12]
Flavin adenin dinukleotid
Interaguje s kofaktorovou nebo protetickou skupinou, FAD flavoproteinů a obsahuje flavinovou skupinu ve formě FAD nebo FMN (flavin mononukleotid). Doména nekovalentně váže oxidovaný FAD nebo jeho redukovanou formu, hydrochinon (FADH2).[12]
FMN
Flavinová mononukleotidová vazebná doména interaguje s koenzymem enzymů flavoprotein oxidoreduktázy, FMN.[12]
NADP
Nikotinamid adenin dinukleotid fosfát je koenzym přítomný v redoxních a biosyntetických reakcích. Doména váže NADP ve svých oxidovaných nebo redukovaných formách jako NADP + nebo NADPH.[12]
ADPH
Zahrnuje nekovalentní a selektivní interakci se sníženou formou NADP, NADPH.[12]
Aktivita NADPH-hemoprotein reduktázy
Doména je spojena s rodinou oxidoreduktázy a působí na NADH nebo NADPH za použití hemového proteinu jako akceptoru elektronů. Vyžaduje FAD a FMN jako kofaktory katalyzující reakci:
NADPH + H + + n oxidovaný hemoprotein = NADP + + n redukovaný hemoprotein.[12]
Vazba na bílkoviny
Vazebná doména zapojená do interakce s proteiny nebo proteinovými komplexy.[12]
Polymorfismy
Patogenní mutace
- (MTRR): c.66A> G - Polymorfismus vedoucí k přeměně isoleucinu na methionin na kodonu 22. Tato mutace se nachází uvnitř a ovlivňuje vazebnou doménu FMN.[13]
- (MTRR): c.524C> T - Substituce serinu na leucin v kodonu 175. Benigní mutace spojená se zhoršenými poruchami intracelulárního metabolismu kobalaminu.[14]
- (MTRR): c.1049A> G - Substituce lysinem za arginin na kodonu 350.[15]
- (MTRR): c.1349C> G - Substituce prolinem za arginin na kodonu 450. Prevalence spojená s abnormálními poruchami intracelulárního metabolismu kobalaminu.[16]
- (MTRR): c.903 + 469T> C - Hluboká intronická inzerce mezi exony 6 a 7 (r.903_904ins140). Změna threoninu na cystein, která vede k aktivaci zesilovače sestřihu exonu v intronu 6.[17]
- (MTRR): c.1361C> T - Vzácný polymorfismus zahrnující substituci serinu na leucin v kodonu 454. Známý jako iberská mutace, převládající v homocystinurii, megaloblastické anémii v důsledku zhoršeného metabolismu kobalaminu. Hlavně tři různé halotypy (GTACG, GCACA, GCACG) od deaminace methylcytosinu v různých chromozomech.[18]
- (MTRR): c.1459G> A - Zahrnuje substituci glycinu za arginin na kodonu 487. Zachováno v MTRR a bylo zjištěno, že se vyskytuje ve vazebné doméně FAD. Patogenita spojená s vrozenými genetickými chorobami.[19]
- (MTRR): c.1573C> T - substituce argininem s předčasným terminačním kodonem na kodonu 525.[20]
- (MTRR): c.1622_1623dupTA - vede k vytvoření předčasného terminačního kodonu. Patogenita spojená s homocystinurií typu CblE.[21]
- (MTRR): r.1462_1557del96 - spojený s sestřihem exonu 11 kvůli deleci 7 párů bází. Velká delece této mutantní alely vede k nepřítomnosti c-konce ve vazebné doméně FAD. Patogenita spojená s homocystinurií typu CblE.[21]
- (MTRR): c.1953-6_1953-2del5 - nová mutace spojená s homocystinurií typu CblE. Nestabilní mRNA vznikající z této mutanty vede k nepřítomnosti mRNA potřebné pro translaci, což vede k patogenitě.[21]
Mutace podílející se na tvorbě předčasných terminačních kodonů mají za následek zkrácené mutované proteiny, pokud jsou přeloženy.[21] Mutanty vykazují nepřítomnost vazebných domén FAD / NADPH a nestabilní mRNA v důsledku nesmyslem zprostředkovaného rozpadu (NMD). NMD není přítomen v (MTRR): c.1573C> T nebo (MTRR): c.1622_1623dupTA polymorfismech.[21] Varianta (MTRR): c.903 + 469T> C je také spojena s tvorbou kodonů předčasného ukončení.[21]
Další mutace
- (MTRR): c.1911G> A ¬– Benigní synonymní mutace (alanin na alanin) na kodonu 637. Souvisí s poruchami metabolismu kobalaminu.[22]
Klinický význam
Tato sekce potřebuje víc lékařské odkazy pro ověření nebo se příliš spoléhá na primární zdroje. (Října 2017) |
Jednonukleotidové polymorfismy (SNP) v genu MTRR zhoršují aktivitu MTR, což vede ke zvýšeným hladinám homocysteinu v důsledku kompromitované methylace na methionin. Zvýšené hladiny homocysteinu jsou spojeny s vrozenými vadami kromě komplikací v těhotenství, kardiovaskulárních onemocnění, rakoviny,[23] megaloblastická anémie, Alzheimerova choroba a kognitivní dysfunkce u starších osob.[24] Přítomnost mutantní varianty (66A> G) je u pacientů po transplantaci srdce spojena s významně nižšími, až čtyřnásobnými plazmatickými hladinami kobalaminu a folátu.[23] Následné snížení dostupnosti S-adenosylmethioninu vede k hypomethylaci DNA. Nízký obsah folátů omezuje jeden metabolismus uhlíku a metabolismus homocysteinu, protože vitamin B12 v této cestě interaguje s folátem.[24] Tato mutace je navíc spojena se zvýšeným rizikem u cukrovky typu 2.[25]
Rakovina
Specifické SNP jsou spojeny se zvýšeným rizikem rakoviny plic a v této etiologii interagují s dietou folátu. Mutace (MTRR): c.66A> G souvisí s významným zvýšením rizika rakoviny plic. Při společné expresi s polymorfismem (MTR): 2756A> G se riziko rakoviny plic dále zvyšuje způsobem závislým na dávce.[24] Korelace mezi tímto polymorfismem a zvýšeným rizikem rakoviny plic je přítomna při nízkém příjmu folátů a vysokém obsahu vitaminu B12, což naznačuje mechanismus účinku nezávislý na B12.[24] Tato mutace je také spojena se zvýšeným rizikem u kolorektálního karcinomu,[26][27][28][29] akutní lymfoblastická leukémie,[30] rakovina močového měchýře,[31] cervikální intraepiteliální neoplazie, non-Hodgkinův lymfom[32] a karcinom dlaždicových buněk jícnu.[33]
CblE typ homocystinurie
Remetylace homocysteinu na methionin pomocí MTR vyžaduje derivát kobalaminu, methylkobalamin. Metabolismus kobalaminu je iniciován endocytózou kobalaminu vázaného na plazmatický protein transkobalamin (II). Štěpením tohoto komplexu vznikne volný kobalamin, který se přemístí z lysozomu do cytoplazmy. Může dojít ke konverzi na 5’-deoxyadenosylkobalamin (AdoCbl) aktivující mitochrondriální enzym methylmalonly koenzym A mutázu nebo na methylkobalamin (MeCbl).[34] Pro homocystinurii typu CblE je charakteristická chyba v metabolismu kobalaminu vedoucí ke snížení MeCbl a neovlivněnému AdoCbl.[34] Tato komplementace je u autozomálně recesivní dědičnosti vzácná. Zděděný funkční nedostatek methioninsyntázy odpovídá defektu v redukčním systému potřebném k aktivaci enzymu MTR. Mezi příznaky tohoto stavu patří vývojová retardace, megaloblastická anémie, homocystinurie, hypomethioninémie, cerebrální atrofie a hyperhomocysteinémie.[34] Hypomethioninemie však zůstává nekonzistentním příznakem. Snížení MeCbl spolu s normální absorpcí kobalaminu naznačuje snížení intracelulární biosyntézy methioninu. Vyskytující se hlavně v dětství, 15 patogenních mutací může být spojeno s homocystinurií typu CblE.[35] S touto vadou jsou navíc spojeny vaskulární abnormality.[36] Porucha redukce oxidovaného atomu kobaltu v aktivním místě MTR je spojena s tímto stavem, kdy lze aktivitu enzymu korigovat redukčními činidly.[35] Mezi vzácné polymorfismy související s tímto onemocněním patří (MTRR): c.1459G> A, (MTRR): c.1623-1624insTA a (MTRR): c.903 + 469T> C.[35] Tyto mutace, s výjimkou (MTRR): c.1459G> Výsledkem je posun rámce, produkující předčasné terminační kodony.[35] Jelikož jsou následné produkty vzdálené od normálu, vzniká mutantní mRNA a je zahájen nesmysl zprostředkovaný rozpad (FMN).[35] Velká inzerce 903_904ins140 odpovídající 903 + 469T> C je nejběžnější v patologii CblE. Aktivace vylepšeného sestřihu v intronu 6 je neúplná a produkuje malá množství normální sestřihové MTRR mRNA.[35] Prenatální diagnostika tohoto stavu je možná pomocí [14C] methyltetrahydrofolátu.[35] Mutační analýza nativních choriových klků a [14C] mravenců v aminokyselinách v těchto klcích nebo kultivovaných amniocytech svědčí o defektu CblE.[35] Makrocytární anémie je navíc typickým rysem defektu CblE a lze ji upravit podáváním OH-kobalaminu nebo suplementací folátu.[35]
Ischemická choroba srdeční
Homocystein, aminokyselina na bázi síry, je hlavním produktem demetylace methioninu. Zvýšený homocystein je nezávislým rizikovým faktorem pro kardiovaskulární onemocnění a nepřímo souvisí s konzumovanou hladinou vitaminu B12 / B6 a folátu.[37] Methylace homocysteinu na methionin je katalyzována MTR, což vede k odpovídajícím intracelulárním hladinám methioninu a tetrahydrofolátu, spolu s netoxickými hladinami homocysteinu. Fenotyp GG podporuje rozvoj předčasného onemocnění věnčitých tepen (CAD) nezávisle na hyperhomocysteinemii.[37] Hyperhomocysteinémie je spojena s cerebrální, koronární a periferní aterosklerotickou patologií, protože podporuje dysfunkci endoteliálních buněk, adhezi krevních destiček a proliferaci buněk hladkého svalstva cév.[36] Poškození DNA a hladiny homocysteinu jsou úměrné závažnosti CAD. Frekvence mikrojader v lidských lymfocytech, v závislosti na hladinách homocysteinu, zvyšuje reaktivní formy kyslíku a začlenění uracilu do methylace DNA, podporuje genetické změny a bodové mutace.[36] Polymorfismus obsahující (MTRR): c.66A> G, chromozom, je náchylný k fragmentaci. Tato ztráta chromozomů nebo globální hypomethylace DNA má za následek kondenzaci pericentromerního heterochromatinu, tvorbu mikronukleů a zvýšené riziko aneuploidie.[36] Společná exprese této mutace a 677T polymorfismu v methionin tetrahydrofolát reduktáze (MTHFR) Methylenetetrahydrofolát reduktáza jednat o další rozsah poškození DNA.[36]
Hypomethylace v důsledku zhoršené methylace nahoru reguluje geny citlivé na aterosklerózu, zatímco dolů reguluje ochranné geny pro aterosklerózu.[36] Tato abnormalita je přítomna během aterosklerotické patologie, zvyšuje transkripční aktivitu růstového faktoru odvozeného z krevních destiček (PDGF) a podporuje proliferaci buněk hladkého svalstva.[36]
Poruchy neurální trubice
Spina bifida
MTRR vyžaduje vitamín B12 pro udržení reakce methylsyntázy, zatímco folát je potřebný pro normální syntézu prekurzorů nukleotidů. Ty zajišťují normální syntézu DNA a buněčné methylační reakce.[7] Chronický nedostatek folátu nebo methylu je tedy spojen s abnormální metylací DNA. Polymorfismus 66A> G je v defektech neurální trubice up-regulován a dvojnásobně zvyšuje riziko spina bifida.[38] Homozygóza pro tuto mutaci je zavedeným mateřským rizikovým faktorem pro spina bifida, zejména s nízkým intracelulárním vitaminem B12[39] v oběhu nebo plodové vodě.[13] Vitamin B12 se odráží v kyselině methylmalonové v plazmě (MMA), což je zvýšení, které indikuje zhoršenou absorpci nebo metabolismus B12.[7] Zvýšená MMA v kombinaci s mutací MTRR odpovídá 5násobnému zvýšení spina bifida.[7] Mechanismus působení tohoto polymorfismu je prostřednictvím matky, proto neexistuje žádný preferenční přenos této mutace z rodiče na dítě. Abnormální vazba MTRR na komplex alamin-enzym MTR-cob (I) reguluje rychlost methylace homocysteinu. Následné poklesy methioninu a S-adenosylmethioninu negativně ovlivňují methylaci DNA, genů a proteinů, které se všechny podílejí na uzavření neurální trubice.[7] Zvýšená proliferace během neurulace snižuje dostupnost DNA nukleotidů. Jelikož je nelze nahradit kvůli zhoršené metylaci DNA a tvorbě nukleotidů, následná narušená neurulace vede k tvorbě defektů neurální trubice.[11] Společná exprese této mutace s polymorfismem 677C> T MTHFR zvyšuje riziko spina bifida ve srovnání s nezávisle působící mutací 66A> G.[7]
Downův syndrom
Trizomie 21 nebo Downův syndrom je nejčastější lidská chromozomální anomálie vznikající z abnormální chromozomální segregace v meióze.[10][11][40] Tento stav může nastat během anafáze v meióze (I), která značí zrání oocytů před ovulací, a / nebo během anafáze v meióze (II), která značí oplodnění.[11] Metabolický účinek v těchto fázích je podporován nízkým obsahem vitaminu B12.[41] Methylace homocysteinu na methionin je ovlivněna primárně polymorfismem (MTRR): c.66A> G. Chronické zvýšení homocysteinu zvyšuje hladiny s-adenosyl-L-homocysteinu, což následně inhibuje aktivitu methyltransferázy a podporuje hypomethylaci DNA.[10][42] Matky homozygotní pro tuto mutaci (fenotyp GG) mají ve srovnání s heterozygoty (fenotyp GA) větší riziko mít dítě s Downovým syndromem.[41] Geograficky jsou irské populace pravděpodobně homogennější, zatímco severoamerické populace jsou obvykle heterogenní, což vede k většímu výskytu polymorfismu v dřívější skupině.[11][41] Homozygotní mutantní alela podporuje hypomethylaci DNA a meiotickou nedisjunkci, což zvyšuje riziko Downova syndromu.[43] Tento polymorfismus koreluje s 2,5násobným zvýšením rizika nezávisle na sobě a 4násobným zvýšením rizika při společné expresi s mutací 677C> T MTHFR.[11] Kombinace s genetickým polymorfismem MTR2756A> G dále zvyšuje riziko downovského syndromu.[11][42][44]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000124275 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000034617 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d Leclerc D, Wilson A, Dumas R, Gafuik C, Song D, Watkins D, Heng HH, Rommens JM, Scherer SW, Rosenblatt DS, Gravel RA (březen 1998). „Klonování a mapování cDNA pro methioninsyntáza reduktázu, defekt flavoproteinu u pacientů s homocystinurií“. Sborník Národní akademie věd Spojených států amerických. 95 (6): 3059–64. doi:10.1073 / pnas.95.6.3059. PMC 19694. PMID 9501215.
- ^ A b "Entrez Gene: MTRR 5-methyltetrahydrofolát-homocystein methyltransferáza reduktáza".
- ^ A b C d E F G h i j k van der Linden IJ, den Heijer M, Afman LA, Gellekink H, Vermeulen SH, Kluijtmans LA, Blom HJ (prosinec 2006). „Polymorfismus methioninsyntázy reduktázy 66A> G je mateřským rizikovým faktorem pro spina bifida.“ Journal of Molecular Medicine. 84 (12): 1047–54. doi:10.1007 / s00109-006-0093-x. PMID 17024475. S2CID 24500664.
- ^ A b Zhang T, Lou J, Zhong R, Wu J, Zou L, Sun Y, Lu X, Liu L, Miao X, Xiong G (2013). „Genetické varianty ve folátové cestě a riziko defektů neurální trubice: metaanalýza publikované literatury“. PLOS ONE. 8 (4): e59570. doi:10.1371 / journal.pone.0059570. PMC 3617174. PMID 23593147.
- ^ Vaughn JD, Bailey LB, Shelnutt KP, Dunwoody KM, Maneval DR, Davis SR, Quinlivan EP, Gregory JF, Theriaque DW, Kauwell GP (listopad 2004). „Methioninsyntáza reduktáza 66A-> G polymorfismus je spojen se zvýšenou koncentrací homocysteinu v plazmě v kombinaci s homozygotní variantou methylenetetrahydrofolátreduktázy 677C-> T“. The Journal of Nutrition. 134 (11): 2985–90. doi:10.1093 / jn / 134.11.2985. PMID 15514263.
- ^ A b C d Wang SS, Qiao FY, Feng L, Lv JJ (únor 2008). „Polymorfismy v genech podílejících se na metabolismu folátů jako mateřské rizikové faktory pro Downův syndrom v Číně“. Journal of Zhejiang University Science B. 9 (2): 93–9. doi:10.1631 / jzus.B0710599. PMC 2225490. PMID 18257130.
- ^ A b C d E F G Hobbs CA, Sherman SL, Yi P, Hopkins SE, Torfs CP, Hine RJ, Pogribna M, Rozen R, James SJ (září 2000). „Polymorfismy v genech zapojených do metabolismu folátů jako mateřské rizikové faktory pro Downův syndrom“. American Journal of Human Genetics. 67 (3): 623–30. doi:10.1086/303055. PMC 1287522. PMID 10930360.
- ^ A b C d E F G h i j k l m n „MTRR - Methionin syntáza reduktáza - Homo sapiens (člověk) - gen a protein MTRR“. Citováno 2017-09-16.
- ^ A b Wilson A, Platt R, Wu Q, Leclerc D, Christensen B, Yang H, Gravel RA, Rozen R (srpen 1999). „Běžná varianta methioninsyntázy reduktázy v kombinaci s nízkým obsahem kobalaminu (vitamin B12) zvyšuje riziko spina bifida“. Molekulární genetika a metabolismus. 67 (4): 317–23. doi:10,1006 / mgme.1999,2879. PMID 10444342.
- ^ Hassan FM, Khattab AA, Abo El Fotoh WM, Zidan RS (září 2017). „Polymorfismy A66G a C524T genu methioninsyntázy reduktázy jsou spojeny s vývojem vrozených vrozených srdečních chorob u egyptských dětí“. Gen. 629: 59–63. doi:10.1016 / j.gene.2017.07.081. PMID 28778621.
- ^ G ">„NM_002454.2 (MTRR): c.1049A> G (p.Lys350Arg) AND not specified - ClinVar - NCBI“. Citováno 2017-09-16.
- ^ G ">"NM_002454.2 (MTRR): c.1349C> G (p.Pro450Arg) A poruchy intracelulárního metabolismu kobalaminu - ClinVar - NCBI". Citováno 2017-09-16.
- ^ Homolova K, Zavadáková P, Doktor TK, Schroeder LD, Kozich V, Andresen BS (duben 2010). „Hluboká intronická mutace c.903 + 469T> C v genu MTRR vytváří zesilovač exonového sestřihu vazby SF2 / ASF, který vede k aktivaci pseudoexonu a způsobuje hombystinurii typu cblE“. Lidská mutace. 31 (4): 437–44. doi:10,1002 / humu.21206. PMC 3429857. PMID 20120036.
- ^ T ">"NM_002454.2 (MTRR): c.1361C> T (p.Ser454Leu) Simple - Variation Report - ClinVar - NCBI". Citováno 2017-09-16.
- ^ A ">"NM_002454.2 (MTRR): c.1459G> A (p.Gly487Arg) A Vrozená genetická onemocnění - ClinVar - NCBI". Citováno 2017-09-16.
- ^ T ">„NM_002454.2 (MTRR): c.1573C> T (p.Arg525Ter) AND not provided - ClinVar - NCBI“. Citováno 2017-09-16.
- ^ A b C d E F Zavadáková P, Fowler B, Suormala T, Novotna Z, Mueller P, Hennermann JB, Zeman J, Vilaseca MA, Vilarinho L, Gutsche S, Wilichowski E, Horneff G, Kozich V (2005). "cblE typ homocystinurie způsobený nedostatkem methioninsyntázy reduktázy: funkční korekce expresí minigenu". Lidská mutace. 25 (3): 239–47. doi:10.1002 / humu.20131. PMID 15714522. S2CID 17183484.
- ^ A ">„NM_002454.2 (MTRR): c.1911G> A (p.Ala637 =) Simple - Variation Report - ClinVar - NCBI“. Citováno 2017-09-16.
- ^ A b Wang P, Li S, Wang M, He J, Xi S (2017). „Sdružení polymorfismu MTRR A66G s náchylností k rakovině: důkazy z 85 studií“. Journal of Cancer. 8 (2): 266–277. doi:10,7150 / jca.17379. PMC 5327376. PMID 28243331.
- ^ A b C d Shi Q, Zhang Z, Li G, Pillow PC, Hernandez LM, Spitz MR, Wei Q (srpen 2005). „Polymorfismy methioninsyntázy a methioninsyntázy reduktázy a riziko rakoviny plic: analýza případové kontroly“. Farmakogenetika a genomika. 15 (8): 547–55. doi:10.1097 / 01.fpc.0000170916.96650.70. PMID 16006998. S2CID 25879819.
- ^ Zhi X, Yang B, Fan S, Li Y, He M, Wang D, Wang Y, Wei J, Zheng Q, Sun G (prosinec 2016). „Aditivní interakce polymorfismů MTHFR C677T a MTRR A66G s nadváhou / obezitou na riziko cukrovky 2. typu“. International Journal of Environmental Research and Public Health. 13 (12): 1243. doi:10,3390 / ijerph13121243. PMC 5201384. PMID 27983710.
- ^ Matsuo K, Hamajima N, Hirai T, Kato T, Inoue M, Takezaki T, Tajima K (2002). „Polymorfismus genu methionin-syntázy reduktázy A66G je spojen s rizikem rakoviny tlustého střeva.“ Asian Pacific Journal of Cancer Prevention. 3 (4): 353–359. PMID 12716294.
- ^ Sharp L, Little J (březen 2004). „Polymorfismy v genech zapojených do metabolismu folátů a kolorektální neoplazie: recenze HuGE“. American Journal of Epidemiology. 159 (5): 423–43. doi:10.1093 / aje / kwh066. PMID 14977639.
- ^ Wettergren Y, Odin E, Carlsson G, Gustavsson B (2010). „MTHFR, MTR a MTRR polymorfismy ve vztahu k hypermethylaci p16INK4A na sliznici pacientů s kolorektálním karcinomem“. Molekulární medicína. 16 (9–10): 425–32. doi:10.2119 / molmed.2009.00156. PMC 2935958. PMID 20549016.
- ^ Le Marchand L, Donlon T, Hankin JH, Kolonel LN, Wilkens LR, Seifried A (2002). „Příjem vitamínů B, metabolické geny a riziko rakoviny tlustého střeva a konečníku (USA)“. Příčiny a kontrola rakoviny. 13 (3): 239–48. doi:10.1023 / A: 1015057614870. PMID 12020105. S2CID 6326507.
- ^ Gemmati D, Ongaro A, Scapoli GL, Della Porta M, Tognazzo S, Serino ML, Di Bona E, Rodeghiero F, Gilli G, Reverberi R, Caruso A, Pasello M, Pellati A, De Mattei M (květen 2004). „Běžné genové polymorfismy v metabolické cestě folátu a methylaci a riziko akutní lymfoblastické leukémie a non-Hodgkinova lymfomu u dospělých“. Epidemiologie rakoviny, biomarkery a prevence. 13 (5): 787–94. PMID 15159311.
- ^ Lin J, Spitz MR, Wang Y, Schabath MB, Gorlov IP, Hernandez LM, Pillow PC, Grossman HB, Wu X (září 2004). „Polymorfismy metabolických genů folátu a náchylnost k rakovině močového měchýře: případová kontrolní studie“. Karcinogeneze. 25 (9): 1639–47. doi:10.1093 / carcin / bgh175. PMID 15117811.
- ^ Skibola CF, Forrest MS, Coppedé F, Agana L, Hubbard A, Smith MT, Bracci PM, Holly EA (říjen 2004). „Polymorfismy a haplotypy v genech metabolizujících foláty a riziko nehodgkinského lymfomu“. Krev. 104 (7): 2155–62. doi:10.1182 / krev-2004-02-0557. PMID 15198953.
- ^ Stolzenberg-Solomon RZ, Qiao YL, Abnet CC, Ratnasinghe DL, Dawsey SM, Dong ZW, Taylor PR, Mark SD (listopad 2003). „Riziko rakoviny jícnu a žaludku a riziko polymorfismů souvisejících s kyselinou listovou a vitaminem B (12) v Linxian, Čína“. Epidemiologie rakoviny, biomarkery a prevence. 12 (11 Pt 1): 1222–6. PMID 14652285.
- ^ A b C Watkins D, Rosenblatt DS (červen 1988). „Genetická heterogenita u pacientů s nedostatkem methylkobalaminu. Definice dvou komplementačních skupin, cblE a cblG“. The Journal of Clinical Investigation. 81 (6): 1690–4. doi:10.1172 / JCI113507. PMC 442612. PMID 3384945.
- ^ A b C d E F G h i Zavadakova P, Fowler B, Zeman J, Suormala T, Pristoupilová K, Kozich V, Zavad'áková P (říjen 2002). „CblE typ homocystinurie způsobený nedostatkem methioninsyntázy reduktázy: klinické a molekulární studie a prenatální diagnostika ve dvou rodinách“. Journal of Inherited Metabolic Disease. 25 (6): 461–76. doi:10.1023 / A: 1021299117308. PMID 12555939. S2CID 9114486.
- ^ A b C d E F G Botto N, Andreassi MG, Manfredi S, Masetti S, Cocci F, Colombo MG, Storti S, Rizza A, Biagini A (září 2003). „Genetické polymorfismy v metabolismu folátů a homocysteinu jako rizikové faktory pro poškození DNA“. European Journal of Human Genetics. 11 (9): 671–8. doi:10.1038 / sj.ejhg.5201024. PMID 12939653.
- ^ A b Brown CA, McKinney KQ, Kaufman JS, Gravel RA, Rozen R (červen 2000). „Běžný polymorfismus v methioninsyntázy reduktáze zvyšuje riziko předčasného onemocnění věnčitých tepen“. Journal of Cardiovascular Risk. 7 (3): 197–200. doi:10.1177/204748730000700306. PMID 11006889. S2CID 32898984.
- ^ Shaw GM, Lu W, Zhu H, Yang W, Briggs FB, Carmichael SL, Barcellos LF, Lammer EJ, Finnell RH (červen 2009). „118 SNP genů souvisejících s foláty a rizika spina bifida a konotunálních srdečních vad“. Lékařská genetika BMC. 10: 49. doi:10.1186/1471-2350-10-49. PMC 2700092. PMID 19493349.
- ^ Balduino Victorino D, de Godoy MF, Goloni-Bertollo EM, Pavarino ÉC (2014). „Genetické polymorfismy podílející se na metabolismu folátů a mateřské riziko pro downův syndrom: metaanalýza“. Značky nemocí. 2014: 1–12. doi:10.1155/2014/517504. PMC 4269293. PMID 25544792.
- ^ Muthuswamy S, Agarwal S (2016). „Platí polymorfismus genu MTHFR a asociace těhotenství s Downovým syndromem? Studie případové kontroly indické populace a metaanalýza“. Egyptian Journal of Medical Human Genetics. 17 (1): 87–97. doi:10.1016 / j.ejmhg.2015.08.003. ISSN 1110-8630.
- ^ A b C O'Leary VB, Parle-McDermott A, Molloy AM, Kirke PN, Johnson Z, Conley M, Scott JM, Mills JL (leden 2002). „MTRR a MTHFR polymorfismus: souvislost s Downovým syndromem?“. American Journal of Medical Genetics. 107 (2): 151–5. doi:10,1002 / ajmg.10121. PMID 11807890.
- ^ A b Martínez-Frías ML, Pérez B, Desviat LR, Castro M, Leal F, Rodríguez L, Mansilla E, Martínez-Fernández ML, Bermejo E, Rodríguez-Pinilla E, Prieto D, Ugarte M (květen 2006). „Mateřské polymorfismy 677C-T a 1298A-C genů MTHFR a 66A-G MTRR: existuje nějaký vztah mezi polymorfismy folátové dráhy, hladinami mateřského homocysteinu a rizikem mít dítě s Downovým syndromem?“. American Journal of Medical Genetics. Část A. 140 (9): 987–97. doi:10,1002 / ajmg.a. 31203. PMID 16575899. S2CID 44819166.
- ^ Bosco P, Guéant-Rodriguez RM, Anello G, Barone C, Namour F, Caraci F, Romano A, Romano C, Guéant JL (září 2003). „Polymorfismus methionin syntázy (MTR) 2756 (A -> G), dvojitá heterozygotnost methionin syntáza 2756 AG / methionin syntáza reduktáza (MTRR) 66 AG a zvýšená homocysteinémie jsou tři rizikové faktory pro porod s Downovým syndromem.“ American Journal of Medical Genetics. Část A. 121A (3): 219–24. doi:10,1002 / ajmg.a.20234. PMID 12923861. S2CID 38425348.
- ^ Al-Gazali LI, Padmanabhan R, Melnyk S, Yi P, Pogribny IP, Pogribna M, Bakir M, Hamid ZA, Abdulrazzaq Y, Dawodu A, James SJ (říjen 2001). "Abnormální folátový metabolismus a genetický polymorfismus folátové dráhy u dítěte s Downovým syndromem a defektem neurální trubice". American Journal of Medical Genetics. 103 (2): 128–32. doi:10,1002 / ajmg.1509. PMID 11568918.
Další čtení
- Wilson A, Platt R, Wu Q, Leclerc D, Christensen B, Yang H, Gravel RA, Rozen R (srpen 1999). „Běžná varianta methioninsyntázy reduktázy v kombinaci s nízkým obsahem kobalaminu (vitamin B12) zvyšuje riziko spina bifida“. Molekulární genetika a metabolismus. 67 (4): 317–23. doi:10,1006 / mgme.1999,2879. PMID 10444342.
- Wilson A, Leclerc D, Rosenblatt DS, Gravel RA (říjen 1999). „Molekulární podstata deficitu methioninsyntázy reduktázy u pacientů patřících do cblE doplňkové skupiny poruch metabolismu folátu / kobalaminu“. Lidská molekulární genetika. 8 (11): 2009–16. doi:10.1093 / hmg / 8.11.2009. PMID 10484769.
- James SJ, Pogribna M, Pogribny IP, Melnyk S, Hine RJ, Gibson JB, Yi P, Tafoya DL, Swenson DH, Wilson VL, Gaylor DW (říjen 1999). „Abnormální metabolismus folátů a mutace v genu methylenetetrahydrofolátreduktázy mohou být mateřskými rizikovými faktory pro Downův syndrom“. American Journal of Clinical Nutrition. 70 (4): 495–501. doi:10.1093 / ajcn / 70.4.495. PMID 10500018.
- Leclerc D, Odièvre M, Wu Q, Wilson A, Huizenga JJ, Rozen R, Scherer SW, Gravel RA (listopad 1999). "Molekulární klonování, exprese a fyzikální mapování lidského genu pro methioninsynthas reduktázu". Gen. 240 (1): 75–88. doi:10.1016 / S0378-1119 (99) 00431-X. PMID 10564814.
- Doolin MT, Barbaux S, McDonnell M, Hoess K, Whitehead AS, Mitchell LE (listopad 2002). „Mateřské genetické účinky vyvolané geny zapojenými do remethylace homocysteinu ovlivňují riziko spina bifida“. American Journal of Human Genetics. 71 (5): 1222–6. doi:10.1086/344209. PMC 385102. PMID 12375236.
- Olteanu H, Munson T, Banerjee R (listopad 2002). „Rozdíly v účinnosti redukční aktivace methioninsyntázy a exogenních akceptorů elektronů mezi běžnými polymorfními variantami lidské methioninsyntázy reduktázy“. Biochemie. 41 (45): 13378–85. doi:10.1021 / bi020536s. PMID 12416982.
- Zavadakova P, Fowler B, Zeman J, Suormala T, Pristoupilová K, Kozich V, Zavad'áková P (říjen 2002). „CblE typ homocystinurie způsobený nedostatkem methioninsyntázy reduktázy: klinické a molekulární studie a prenatální diagnostika ve dvou rodinách“. Journal of Inherited Metabolic Disease. 25 (6): 461–76. doi:10.1023 / A: 1021299117308. PMID 12555939. S2CID 9114486.
- Pietrzyk JJ, Bik-Multanowski M, Sanak M, Twardowska M (2003). „Polymorfismy genů 5,10-methylenetetrahydrofolátu a methioninsyntázy reduktázy jako nezávislých rizikových faktorů pro spina bifida“. Journal of Applied Genetics. 44 (1): 111–3. PMID 12590188.
- Zhu H, Wicker NJ, Shaw GM, Lammer EJ, Hendricks K, Suarez L, Canfield M, Finnell RH (březen 2003). „Polymorfismy homocysteinu remethylačního enzymu a zvýšené riziko defektů neurální trubice“. Molekulární genetika a metabolismus. 78 (3): 216–21. doi:10.1016 / S1096-7192 (03) 00008-8. PMID 12649067.
- Brilakis ES, Berger PB, Ballman KV, Rozen R (červen 2003). „Methylenetetrahydrofolátreduktáza (MTHFR) 677C> T a methionin syntáza reduktáza (MTRR) 66A> G polymorfismy: spojení se sérovým homocysteinem a angiografickým onemocněním koronárních tepen v době moučných výrobků obohacených kyselinou listovou“. Ateroskleróza. 168 (2): 315–22. doi:10.1016 / S0021-9150 (03) 00098-4. PMID 12801615.
- Sliwerska E, Szpecht-Potocka A (2003). "[Mutace genů MTHFR, MTR, MTRR jako vysoce rizikových faktorů pro defekty neurální trubice]". Medycyna Wieku Rozwojowego. 6 (4): 371–82. PMID 12810988.
- Beyer K, Lao JI, Latorre P, Riutort N, Matute B, Fernández-Figueras MT, Mate JL, Ariza A (červenec 2003). „Polymorfismus methionin syntázy je rizikovým faktorem pro Alzheimerovu chorobu“. NeuroReport. 14 (10): 1391–4. doi:10.1097 / 01.wnr.0000073683.00308.0e. PMID 12876480. S2CID 33245738.
- Bosco P, Guéant-Rodriguez RM, Anello G, Barone C, Namour F, Caraci F, Romano A, Romano C, Guéant JL (září 2003). "Methionine synthase (MTR) 2756 (A --> G) polymorphism, double heterozygosity methionine synthase 2756 AG/methionine synthase reductase (MTRR) 66 AG, and elevated homocysteinemia are three risk factors for having a child with Down syndrome". American Journal of Medical Genetics. Část A. 121A (3): 219–24. doi:10.1002/ajmg.a.20234. PMID 12923861. S2CID 38425348.
- Olteanu H, Wolthers KR, Munro AW, Scrutton NS, Banerjee R (February 2004). "Kinetic and thermodynamic characterization of the common polymorphic variants of human methionine synthase reductase". Biochemie. 43 (7): 1988–97. doi:10.1021/bi035910i. PMID 14967039.
- Gemmati D, Ongaro A, Scapoli GL, Della Porta M, Tognazzo S, Serino ML, Di Bona E, Rodeghiero F, Gilli G, Reverberi R, Caruso A, Pasello M, Pellati A, De Mattei M (May 2004). "Common gene polymorphisms in the metabolic folate and methylation pathway and the risk of acute lymphoblastic leukemia and non-Hodgkin's lymphoma in adults". Epidemiologie rakoviny, biomarkery a prevence. 13 (5): 787–94. PMID 15159311.
- Leal NA, Olteanu H, Banerjee R, Bobik TA (November 2004). „Human ATP: Cob (I) alamin adenosyltransferase and its interaction with methioninsynthase reductase“. The Journal of Biological Chemistry. 279 (46): 47536–42. doi:10,1074 / jbc.M405449200. PMID 15347655.
- Vaughn JD, Bailey LB, Shelnutt KP, Dunwoody KM, Maneval DR, Davis SR, Quinlivan EP, Gregory JF, Theriaque DW, Kauwell GP (November 2004). "Methionine synthase reductase 66A->G polymorphism is associated with increased plasma homocysteine concentration when combined with the homozygous methylenetetrahydrofolate reductase 677C->T variant". The Journal of Nutrition. 134 (11): 2985–90. doi:10.1093/jn/134.11.2985. PMID 15514263.







