Živý lék - Living medicine
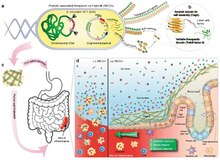
A živá medicína je typ biologický který se skládá ze živého organismu, který se používá k léčbě nemoci. Obvykle to má formu buňky (zvířecí, bakteriální nebo plísňové) nebo viru, který byl geneticky upraveno vlastnit terapeutický vlastnosti, které se vstřikují pacientovi.[2][3] Snad nejstarším použitím živého léku je užívání pijavice pro krveprolití, ačkoli živé léky od té doby ohromně pokročily.
Mezi příklady živých léků patří buněčná terapeutika (počítaje v to imunoterapeutika ), fágová terapeutika, a bakteriální terapeutika, podmnožina druhé bytosti probiotika.
Vývoj živých léků
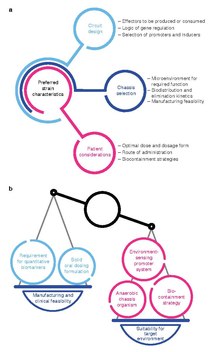
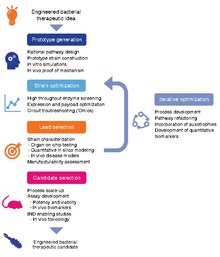
Vývoj živých léčivých přípravků je mimořádně aktivní oblastí výzkumu v oblastech syntetická biologie a mikrobiologie.[6][7][8][9][10][11][12][13][14] V současné době se věnuje velká pozornost: 1) identifikaci mikrobů, které přirozeně vyvolávají terapeutické účinky (například probiotické bakterie), a 2) genetické programování organismy k dosažení terapeutických účinků.[15][16]
Aplikace
Terapie rakoviny
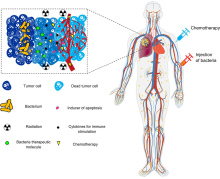
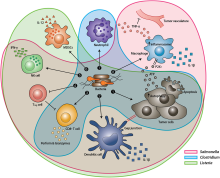

Existuje obrovský zájem o použití bakterií jako terapie k léčbě nádorů. Zejména, bakterie navádějící nádory kterým se daří hypoxický prostředí jsou pro tento účel obzvláště atraktivní, protože budou mít tendenci migrovat do, napadnout (skrz děravá vaskulatura v mikroprostředí nádoru ) a kolonizovat nádory. Tato vlastnost má tendenci prodlužovat dobu jejich pobytu v nádoru a prodlužovat jejich terapeutické účinky, na rozdíl od jiných bakterií, které by imunitní systém rychle vyčistil.[18][19][20]
Reference
- ^
 Tento článek zahrnuje text Pichet Praveschotinunt, Anna M. Duraj-Thatte, Ilia Gelfat, Franziska Bahl, David B. Chou & Neel S. Joshi k dispozici pod CC BY 4.0 licence.
Tento článek zahrnuje text Pichet Praveschotinunt, Anna M. Duraj-Thatte, Ilia Gelfat, Franziska Bahl, David B. Chou & Neel S. Joshi k dispozici pod CC BY 4.0 licence. - ^ editor, Ian Sample Science (16. ledna 2019). "'Živý lék pomáhá při průniku toxického amoniaku “. Opatrovník. Citováno 5. dubna 2020.CS1 maint: další text: seznam autorů (odkaz)
- ^ "Engineering Living Medicines for Chronic Disease | SBE | Society for Biological Engineering". www.aiche.org.
- ^
 Tento článek zahrnuje text Mark R. Charbonneau, Vincent M. Isabella, Ning Li & Caroline B. Kurtz k dispozici pod CC BY 4.0 licence.
Tento článek zahrnuje text Mark R. Charbonneau, Vincent M. Isabella, Ning Li & Caroline B. Kurtz k dispozici pod CC BY 4.0 licence. - ^
 Tento článek zahrnuje text Mark R. Charbonneau, Vincent M. Isabella, Ning Li & Caroline B. Kurtz k dispozici pod CC BY 4.0 licence.
Tento článek zahrnuje text Mark R. Charbonneau, Vincent M. Isabella, Ning Li & Caroline B. Kurtz k dispozici pod CC BY 4.0 licence. - ^ Weber, Wilfried; Fussenegger, Martin (leden 2012). „Rozvíjející se biomedicínské aplikace syntetické biologie“. Genetika hodnocení přírody. 13 (1): 21–35. doi:10.1038 / nrg3094. ISSN 1471-0056. PMC 7097403. PMID 22124480.
- ^ Fischbach, M. A .; Bluestone, J. A .; Lim, W. A. (2013-04-03). „Cell-Based Therapeutics: The Next Pillar of Medicine“. Science Translational Medicine. 5 (179): 179 ps7. doi:10.1126 / scitranslmed.3005568. ISSN 1946-6234. PMC 3772767. PMID 23552369.
- ^ Kitada, Tasuku; DiAndreth, Breanna; Teague, Brian; Weiss, Ron (02.02.2018). „Programování genových a inženýrských buněčných terapií se syntetickou biologií“. Věda. 359 (6376): eaad1067. doi:10.1126 / science.aad1067. ISSN 0036-8075. PMID 29439214.
- ^ McCarty, Niko (18. prosince 2018). „Proč byl rok 2018 rokem„ živé “medicíny?. Střední. Střední. Citováno 5. dubna 2020.
- ^ Kelly, Jason (12. června 2019). "Éra živých léků". Ginkgo Bioworks. Citováno 5. dubna 2020.
- ^ ServiceFeb. 18, Robert F. (18. února 2020). „Od„ živého “cementu po biofilmy dodávající léky, biologové předělávají materiální svět“. AAAS. Citováno 5. dubna 2020.
- ^ Kurtz, Caroline B .; Proso, Yves A .; Puurunen, Marja K .; Perreault, Mylène; Charbonneau, Mark R .; Isabella, Vincent M .; Kotula, Jonathan W .; Antipov, Eugene; Dagon, Yossi; Denney, William S .; Wagner, David A. (2019-01-16). „Upravená E. coli Nissle zlepšuje hyperamonemii a přežití u myší a vykazuje u zdravých lidí expozici závislou na dávce“. Science Translational Medicine. 11 (475): eaau7975. doi:10.1126 / scitranslmed.aau7975. ISSN 1946-6234. PMID 30651324. S2CID 58031579.
- ^ Charbonneau, Mark R .; Isabella, Vincent M .; Li, Ning; Kurtz, Caroline B. (08.04.2020). „Vývoj nové třídy vyvinutých živých bakteriálních terapeutik k léčbě lidských chorob“. Příroda komunikace. 11 (1): 1738. doi:10.1038 / s41467-020-15508-1. ISSN 2041-1723. PMC 7142098. PMID 32269218.
- ^ „Génové obvody posilují buněčné a genové terapie nové generace“. GEN - Novinky z genetického inženýrství a biotechnologie. 1. února 2020. Citováno 5. dubna 2020.
- ^ „Proč je nyní čas na programovatelné živé léky: postřehy od Jima Collinsa, Aoife Brennana a Jasona Kellyho?“. SynBioBeta. SynBioBeta. 2. dubna 2019. Citováno 5. dubna 2020.
- ^ Costa, Kevin (20. února 2019). „Živé léky: stroj Ginkgo na narušení farmaceutického průmyslu“. SynBioBeta. SynBioBeta. Citováno 5. dubna 2020.
- ^
 Tento článek zahrnuje text Mai Thi-Quynh Duong, Yeshan Qin, Sung-Hwan You & Jung-Joon Min k dispozici pod CC BY 4.0 licence.
Tento článek zahrnuje text Mai Thi-Quynh Duong, Yeshan Qin, Sung-Hwan You & Jung-Joon Min k dispozici pod CC BY 4.0 licence. - ^ Duong, Mai Thi-Quynh; Qin, Yeshan; Ty, Sung-Hwan; Min, Jung-Joon (11. 12. 2019). „Interakce bakterie s rakovinou: léčba rakoviny založená na bakteriích“. Experimentální a molekulární medicína. 51 (12): 1–15. doi:10.1038 / s12276-019-0297-0. ISSN 2092-6413. PMC 6906302. PMID 31827064.
- ^ Sedighi, Mansour; Zahedi Bialvaei, Abed; Hamblin, Michael R .; Ohadi, Elnaz; Asadi, Arezoo; Halajzadeh, Masoumeh; Lohrasbi, Vahid; Mohammadzadeh, Nima; Amiriani, Taghi; Krutová, Marcela; Amini, Abolfazl (04.04.2019). „Terapeutické bakterie v boji proti rakovině; současný pokrok, výzvy a příležitosti“. Cancer Medicine. 8 (6): 3167–3181. doi:10,1002 / cam4,2148. ISSN 2045-7634. PMC 6558487. PMID 30950210.
- ^ Song, Shiyu; Vuai, Miza S .; Zhong, Mintao (2018-03-15). „Role bakterií v terapii rakoviny - nepřátelé v minulosti, ale spojenci v současnosti“. Infekční látky a rakovina. 13 (1): 9. doi:10.1186 / s13027-018-0180-r. ISSN 1750-9378. PMC 5856380. PMID 29568324.
