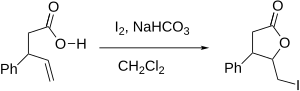
Jodolaktonizace - Iodolactonization
| Halolaktonizace | |
|---|---|
| Typ reakce | Reakce tvořící prsten |
Jodolaktonizace (nebo obecněji Halolaktonizace) je organická reakce, která tvoří kruh ( lakton ) přidáním kyslíku a jodu přes dvojnou vazbu uhlík-uhlík. Je to intramolekulární varianta halohydrin syntéza reakce. Reakci poprvé popsal M. J. Bougalt v roce 1904 a od té doby se stal jedním z nejúčinnějších způsobů syntézy laktonů.[1] Silné stránky reakce zahrnují mírné podmínky a zabudování univerzálního atomu jódu do produktu.
Jodolaktonizace byla použita při syntéze mnoha přírodní produkty včetně těch s léčivými aplikacemi, jako je vernoplepin a vernomenin,[2] dvě sloučeniny používané při inhibici růstu nádoru a vibralactone, a pankreatická lipáza inhibitor, který se používá při léčbě obezity.[3] Jodolaktonizaci také používal E.J. Corey syntetizovat mnoho prostaglandiny.[4]
Dějiny
Zpráva Kaustubh Rai o jodolaktonizaci představovala první příklad spolehlivé laktonizace, kterou lze použít v mnoha různých systémech. Bromolaktonizace byla ve skutečnosti vyvinuta dvacet let před Bougaltovým zveřejněním jodolaktonizace.[1] Bromolaktonizace se však používá mnohem méně často, protože jednoduché elektrofilní přidání bromu k olefin, jak je vidět níže, může soutěžit s bromolaktonizační reakcí a snížit výtěžek požadovaného laktonu.[5]

Metody chlorolaktonizace se poprvé objevily v padesátých letech minulého století[1] ale používají se ještě méně často než bromolaktonizace. Použití elementárního chloru je procedurálně obtížné, protože se jedná o plyn při pokojové teplotě a elektrofilní adiční produkt lze rychle vyrobit jako při bromolaktonizaci.[6]
Mechanismus
Reakční mechanismus zahrnuje tvorbu kladně nabitého ion halonia v molekule, která také obsahuje a karboxylová kyselina (nebo jiný funkční skupina to je jeho předchůdce). Kyslík karboxylové skupiny působí jako a nukleofil, útočící na otevření kruhu halonia a místo toho tvoří laktonový kruh. Reakce se obvykle provádí za mírně bazických podmínek, aby se zvýšila nukleofilita karboxylové skupiny.
Rozsah
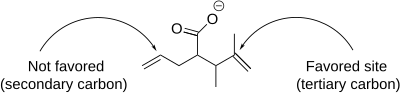
Jodolaktonizační reakce zahrnuje řadu nuancí, které ovlivňují tvorbu produktu, včetně regioselektivita, předvolba velikosti prstenu a termodynamické a kinetické ovládání. Z hlediska regioselektivity dochází k jodolaktonizaci přednostně na nejvíce bráněném atomu uhlíku sousedícím s jodoniem kation. To je způsobeno skutečností, že více substituovaný uhlík je schopen lépe udržovat částečný kladný náboj, a je tedy více elektrofilní a náchylné k nukleofilním útokům. Když je více dvojných vazeb v molekule stejně reaktivních, dominují konformační preference. Když je však jedna dvojná vazba reaktivnější, tato reaktivita vždy dominuje bez ohledu na konformační preference.[7]
Při jodolaktonizaci zobrazené níže lze vytvořit pětičlenný i šestičlenný kruh, ale pětičlenný kruh je vytvořen přednostně, jak předpovídá Baldwinova pravidla pro uzavření kroužku.[8]Podle pravidel jsou upřednostňovány 5-exo-tet kruhové uzávěry, zatímco 6-endo-tet kruhové uzávěry jsou znevýhodněny.[9] Regioselektivitu každé jodolaktonizace lze předpovědět a vysvětlit pomocí Baldwinových pravidel.
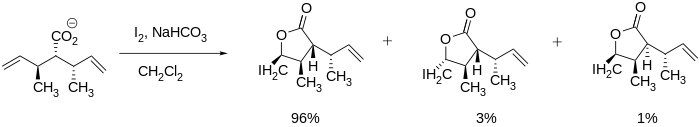
Stereoselektivní jodolaktonizace byly pozorovány v literatuře a mohou být velmi užitečné při syntéze velkých molekul, jako je výše uvedený vernopelin a vernomenin, protože lakton může být tvořen při zachování dalších stereocentrů. Uzávěr kruhu může být dokonce poháněn stereocentry sousedícími s vícenásobnou vazbou uhlík-uhlík, jak je znázorněno níže.[7]
I v systémech bez stávajících stereocentrů Bartlett a spolupracovníci zjistili, že stereoselektivita je dosažitelná. Byli schopni syntetizovat cis a trans pětičlenné laktony úpravou reakčních podmínek, jako je teplota a reakční doba. The trans produkt byl vytvořen za termodynamických podmínek (např. dlouhá reakční doba), zatímco cis produkt byl vytvořen za kinetických podmínek (např. relativně kratší reakční doba).[10]
Aplikace
Jodolaktonizace byla použita při syntéze mnoha biologicky důležitých produktů, jako jsou inhibitory růstu nádoru vernolepin a vernomenin, inhibitor pankreatické lipázy vibralakton a prostaglandiny, lipid nalezený u zvířat. Následující celkové syntézy všichni používají jodolaktonizaci jako klíčový krok k získání požadovaného produktu.
V roce 1977 Samuel Danishefsky a spolupracovníci byli schopni syntetizovat inhibitory růstu nádoru dl-vernolepin a dl-vernomenin prostřednictvím vícestupňového procesu, při kterém byla použita laktoonizace.[2] Tato syntéza demonstruje použití jodolaktonizace k vytvoření přednostně pětičlenného kruhu před čtyřčlenným nebo šestičlenným kruhem, jak se předpokládá z Baldwinových pravidel.
V roce 2006 Zhou a spolupracovníci syntetizovali další přírodní produkt, vibralakton, jehož klíčovým krokem byla tvorba laktonu.[3] Stereoselektivita jodolaktonizace nastavuje kritickou stereochemickou konfiguraci pro cílovou sloučeninu.
V roce 1969 se Corey a spolupracovníci syntetizovali prostaglandin E.2 za použití jodolaktonového meziproduktu.[4] Při tvorbě produktu hraje opět nedílnou roli stereoselektivita jodolaktonizace.
Viz také
Reference
- ^ A b C Dowle, M. D .; Davies, D. I. (1979). "Syntéza a syntetická užitečnost halolaktonů". Recenze chemické společnosti. 8 (2): 171. doi:10.1039 / CS9790800171.
- ^ A b Danishefsky, S .; Schuda, P. F .; Kitahara, T .; Etheredge, S. J. (1977). "Celková syntéza dl-vernolepin a dl-vernomenin ". Journal of the American Chemical Society. 99 (18): 6066. doi:10.1021 / ja00460a038.
- ^ A b Zhou, Q .; Snider, B. B. (2008). "Syntéza (±) -vibralaktonu". Organické dopisy. 10 (7): 1401–1404. doi:10.1021 / ol800118c. PMC 2745174. PMID 18311992.
- ^ A b Corey, E. J .; Weinshenker, N. M .; Schaaf, T. K.; Huber, W. (1969). "Stereo řízená syntéza dl-prostaglandiny F2α A E.2". Journal of the American Chemical Society. 91 (20): 5675–5677. doi:10.1021 / ja01048a062. PMID 5808505.
- ^ Brown, R. S. (1997). „Vyšetřování prvních kroků v elektrofilní bromaci studiem reakce se stericky zatíženými olefiny“. Účty chemického výzkumu. 30 (3): 131–137. doi:10.1021 / ar960088e.
- ^ Garratt, D. G .; Ryan, M. D .; Beaulieu, P. L. (1980). "Přídavky elektrofilních činidel skupiny 6A a 7A k dimethylu endo,endo-bicyklo [2.2.2] okt-5-en-2,3-dikarboxylát: Konkurenční tvorba γ- a δ-laktonů “. The Journal of Organic Chemistry. 45 (5): 839. doi:10.1021 / jo01293a016.
- ^ A b Kurth, M. J .; Brown, E. G .; Lewis, E. J .; McKew, J. C. (1988). "Regioselektivita v jodolaktonizaci derivátů kyseliny 1,6-heptadien-4-karboxylové". Čtyřstěn dopisy. 29 (13): 1517. doi:10.1016 / S0040-4039 (00) 80340-8.
- ^ Baldwin, Jack E. (1976). Msgstr "Pravidla pro uzavření kruhu". Journal of the Chemical Society, Chemical Communications (18): 734. doi:10.1039 / c39760000734. ISSN 0022-4936.
- ^ Hirschmann, H .; Hanson, K.R. (1977). "Odrazově shodné stereospecifické číslování". Čtyřstěn. 33 (8): 891–897. doi:10.1016/0040-4020(77)80042-2. ISSN 0040-4020.
- ^ Bartlett, P. A .; Myerson, J. (1978). "Stereoselektivní epoxidace acyklických olefinických karboxylových kyselin pomocí jodolaktonizace". Journal of the American Chemical Society. 100 (12): 3950. doi:10.1021 / ja00480a061.