Halogenová adiční reakce - Halogen addition reaction
A halogenová adiční reakce je jednoduchý organická reakce kde halogen molekula je přidána do dvojná vazba uhlík-uhlík z alken funkční skupina.[1]
Generál chemický vzorec reakce přidání halogenu je:
- C = C + X2 → X − C − C − X
(X představuje halogeny bróm nebo chlór, a v tomto případě může být rozpouštědlo CH2Cl2 nebo CCl4 ). Produkt je a vicinální dihalogenid.
Tento typ reakce je a halogenace a elektrofilní adice.
Reakční mechanismus
The mechanismus reakce pro alkenovou bromaci lze popsat následovně. V prvním kroku reakce se molekula bromu blíží elektronům alken dvojná vazba uhlík-uhlík. Atom bromu blíže vazbě přijímá částečný kladný náboj jako svůj elektrony jsou odpuzovány elektrony dvojné vazby.
 |  |
| Přidání bromu do mechanismu reakce alkenů | Bromidový iont útočí na C – Br σ * antibondingovou molekulární oběžnou dráhu bromoniového iontu |
Atom je elektrofilní v tomto okamžiku a je napaden elektrony pí alkenu [dvojná vazba uhlík-uhlík]. Vytváří na okamžik singl sigma vazba na oba atomů uhlíku. Spojení bróm je v tomto meziproduktu speciální, vzhledem k jeho relativně velké velikosti ve srovnání s uhlík, bromid ion je schopen interakce s oběma uhlíky, které kdysi sdílely n-vazba, čímž vznikl tříčlenný prsten. Bromidový iont získává kladný formální náboj. V tuto chvíli halogen ion se nazývá „bromoniový ion „nebo“chloroniový ion "
Když první atom bromu zaútočí na uhlík-uhlík n-vazba, zanechává za sebou jeden ze svých elektronů s druhým bromem, ke kterému byl vázán v Br2. Ten další atom je nyní záporný bromid anion a je přitahován k mírnému kladnému náboji na atomech uhlíku. Je blokováno z nukleofilní útok na jedné straně uhlíkového řetězce prvním atomem bromu a může útočit pouze z druhé strany. Když útočí a vytváří vazbu s jedním z uhlíků, vazba mezi prvním atomem bromu a ostatními atomy uhlíku se rozbije a každý atom uhlíku zůstane s halogenovým substituentem.
Tímto způsobem dva halogeny přidají an proti přidání a když je alken součástí cyklu, dibromid přijme trans konfigurace. Pro maximální překrytí C – Br σ * antibonding molekulární orbitální ( LUMO, zobrazený vpravo červeně) a nukleofil (X−) osamělý pár (dále jen HOMO, zobrazený vpravo dole zeleně), X− musí zaútočit na bromoniový ion zezadu, na uhlík.
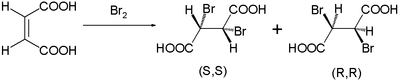
Tento reakční mechanismus navrhli Roberts a Kimball v roce 1937.[2] Tímto vysvětlili pozorované stereospecifické trans-dávky v bromacích kyselina maleinová a kyselina fumarová. Kyselina maleinová s a cis-dvojitá vazba tvoří dibromid jako směs enantiomery:
zatímco trans-izomer fumarová kyselina tvoří jeden mezo sloučenina:
Reakce je dokonce stereospecifická u alkenů se dvěma objemnými tert-butyl skupiny v cis pozice jako ve sloučenině cis-di-tert-butylethylen.[3] Navzdory sterický odpor v chloroniovém iontu je jediným vytvořeným produktem proti- chování.
β-halogenkarbokace
V alternativním reakčním schématu znázorněném níže je reaktivním meziproduktem β-bromkarbocation nebo β-bromkarboniový iont s jedním z atomů uhlíku skutečným karbokace.
Pro reakce probíhající prostřednictvím tohoto mechanismu č stereospecifičnost je očekáván a skutečně nenalezen.
Roberts a Kimball v roce 1937 již odpovídali za to, že bromace s maleát ion vyústilo v cis- přidání poháněné odporem mezi záporně nabitými anionty karboxylové kyseliny, které jsou silnější než tvorba iontů halonia. U alkenů, jako jsou anetholes a stilbeny substituenty jsou schopny stabilizovat karbokation darováním elektronů na úkor iontu halonia.[4]
Ionty halonia lze identifikovat pomocí NMR spektroskopie. V roce 1967 skupina George A. Olah získaná NMR spektra tetramethylethylenbromoniových iontů rozpuštěním 2,3-dibrom-2,3-dimethylbutanu v magická kyselina při -60 ° C.[5] Spektrum pro odpovídající fluor sloučenina na druhé straně byla v souladu s rychle vyrovnávací pár β-fluorovaných uhlovodíků.
Viz také
- Příklad bromace v Odpovídá syntéze
Reference
- ^ Organická chemie 4. vyd. Morrison & Boyd ISBN 0-205-05838-8
- ^ Roberts, Irving; Kimball, George E. (1937). „Halogenace ethylenů“. Journal of the American Chemical Society. 59 (5): 947. doi:10.1021 / ja01284a507.
- ^ Fahey, Robert C. (1966). „Polární přírůstky olefinů. II. Chlorace di-t-butylethylenu“. Journal of the American Chemical Society. 88 (20): 4681. doi:10.1021 / ja00972a030.
- ^ Ruasse, Marie Francoise (1990). "Bromoniové ionty nebo β-bromkarbokace při bromaci olefinů. Kinetický přístup k produktovým selektivitám". Účty chemického výzkumu. 23 (3): 87. doi:10.1021 / ar00171a006.
- ^ Olah, George A .; Bollinger, J. Martin (1967). "Stabilní ionty uhlíku. XLVIII. Tvorba iontů halonia prostřednictvím sousední účasti halogenu. Tetramethylethylenové halogenové ionty". Journal of the American Chemical Society. 89 (18): 4744. doi:10.1021 / ja00994a031.