Intelectin - Intelectin - Wikipedia
| Embryonální epidermální lektin Xenopus | |||||||
|---|---|---|---|---|---|---|---|
 Monomerní struktura XEEL-CRD s navázaným D-glycerol-1-fosfátem. Protein je zbarven pomocí modro-červeného gradientu od N- k C- konci. Ionty vápníku jsou zobrazeny jako zelené koule a koordinované molekuly vody jsou zobrazeny jako červené koule. | |||||||
| Identifikátory | |||||||
| Organismus | |||||||
| Symbol | itln1 | ||||||
| Entrez | 398574 | ||||||
| HomoloGene | 111044 | ||||||
| PDB | 4WN0 | ||||||
| RefSeq (mRNA) | NM_001089101.1 | ||||||
| RefSeq (Prot) | NP_001082570.1 | ||||||
| UniProt | Q800K0 | ||||||
| |||||||
| Lidský intelektin-1 | |||||||
|---|---|---|---|---|---|---|---|
 Monomerní struktura lidského intelektinu s vázanou allyl-beta-D-galaktofuranózou. Protein je zbarven pomocí modro-červeného gradientu od N- k C- konci. Ionty vápníku jsou zobrazeny jako zelené koule a koordinované molekuly vody jsou zobrazeny jako červené koule. | |||||||
| Identifikátory | |||||||
| Symbol | ITLN1 | ||||||
| Alt. symboly | hIntL-1 | ||||||
| Gen NCBI | 55600 | ||||||
| HGNC | 18259 | ||||||
| OMIM | 609873 | ||||||
| PDB | 4 WMY | ||||||
| RefSeq | NP_060095 | ||||||
| UniProt | Q8WWA0 | ||||||
| Další údaje | |||||||
| Místo | Chr. 1 q21.3 | ||||||
| |||||||
Intelektiny jsou lektiny (proteiny vázající sacharidy) exprimované u lidí a dalších strunatci. Lidé vyjadřují dva typy intelektinů kódovaných pomocí ITLN1 a ITLN2 geny resp.[1][2] Několik intelektinů váže zbytky sacharidů specifické pro mikroby. Proto bylo navrženo, že intelektiny fungují jako imunitní lektiny.[3][4] I když intelektiny obsahují doménu podobnou fibrinogenu, která se nachází v ficoliny rodina imunitních lektinů, existuje významná strukturální divergence.[5] Takže intelektiny nemusí fungovat stejnou cestou lektin-komplement. Většina intelektinů je stále špatně charakterizována a mohou mít různé biologické role. Bylo také prokázáno, že se váže lidský intelektin-1 (hIntL-1) laktoferin,[6] ale funkční důsledek musí být ještě objasněn. Kromě toho je hIntL-1 hlavní složkou astmatického hlenu[7] a může se také podílet na fyziologii inzulínu.[8]
Rozmanitost
První intelektin byl objeven v roce Xenopus laevis oocyt a je pojmenován XL35 nebo XCGL-1.[9][10][11] X. laevis oocyt také obsahuje blízce příbuzný XCGL-2.[12] Navíc, X. laevis embrya vylučují Xenopus embryonální epidermální lektin do vody prostředí, pravděpodobně váží mikroby.[13][14] XSL-1 a XSL-2 jsou také vyjádřeny v X. laevis sérum při stimulaci lipopolysacharidem.[15] Dva další intestinální intelektiny jsou objeveny v X. laevis[16]
Člověk má dva intelektiny: hIntL-1 (omentin) a hIntL-2.[17] Myš má také dva intelektiny: mIntL-1 a mIntL-2.[18]
Imunitní systém
Několik linií důkazů naznačuje, že intelektiny rozpoznávají mikroby a mohou fungovat jako vrozený protein imunitní obrany. Tunikát intelektin je opsonin pro fagocytózu pomocí hemocytů.[19] Bylo prokázáno, že amfioxus intelektin aglutinuje bakterie.[20][21] U zebrafish a pstruha duhového je exprese intelektinu stimulována při mikrobiální expozici.[22][23][24] Savci, jako jsou ovce a myši, také upregulují expresi intelektinu po parazitární infekci.[25][26] Zvýšení exprese intelektinu po mikrobiální expozici podporuje hypotézu, že intelektiny hrají roli v imunitním systému.
Struktura
Ačkoli intelektiny vyžadují pro svoji funkci iont vápníku, sekvence se s nimi nijak nepodobá Lektiny typu C..[3] Kromě toho se pouze přibližně 50 aminokyselin (doména podobná fibronogenu) vyrovná s jakýmkoli známým proteinem, konkrétně s ficolin rodina.[2] První strukturní detaily intelektinu pocházejí z krystalové struktury selenomethionin - doména pro rozpoznávání sacharidů XEEL (Se-Met XEEL-CRD) řešená Se-SMUTNÝ.[5] Byl exprimován XEEL-CRD a značen Se-Met Vysoké pět hmyzích buněk použitím rekombinantní bakulovirus. Záhyb podobný fibrinogenu je zachován navzdory divergenci aminokyselinové sekvence. Ve srovnání s ficoliny jsou však v intelektinu přítomny rozsáhlé inzerce, což z intelektinu činí zřetelnou lektinovou strukturní třídu.[5] Struktura Se-Met XEEL-CRD poté umožňuje řešení struktury pomocí molekulární náhrada D-glycerol 1-fosfátu (GroP) vázaného na XEEL-CRD,[5] apo-lidský intelektin-1 (hIntL-1),[4] a hIntL-1 vázaný na galaktofuranózu.[4]
Každý polypeptidový řetězec XEEL a hIntL-1 obsahuje tři vázané ionty vápníku: dva ve strukturálním místě vápníku a jeden ve vazebném místě ligandu.[4][5] Aminokyselinové zbytky ve strukturním místě vápníku jsou mezi intelektiny konzervovány, takže je pravděpodobné, že většina, ne-li všechny, intelektiny mají dva strukturní ionty vápníku.[5]
Ve vazebném místě pro ligand XEEL a hIntL-1 se exocyklický vicinální diol uhlohydrátového ligandu přímo koordinuje s iontem vápníku.[4][5] Mezi homology intelektinových vazeb existují velké variace ve zbytcích vazebného místa pro ligand, což naznačuje, že rodina intelektinů může mít široké specificity ligandu a biologické funkce.[5] Protože v různých organismech neexistují žádné konvence číslování intelektinu, neměli bychom předpokládat funkční homologii založenou na čísle intelektinu. Například hIntL-1 má zbytky kyseliny glutamové ve vazebném místě ligandu pro koordinaci iontu vápníku, zatímco zebrafish intelektin-1 tyto kyselé zbytky neobsahuje.[5] Zebrafish zbytky vazebného místa pro ligand intelektin-2 jsou podobné těm, které jsou přítomné v hIntL-1.
- Režim vazby ligandů intelektinů

Xenopus embryonální epidermální lektin (XEEL) vazebné místo ligandu s navázaným D-glycerol-1-fosfátem. Ion vápníku je zobrazen jako zelená koule a uspořádané molekuly vody jsou zobrazeny jako červené koule.[5]

Vazebné místo pro lidský intelektin-1 (hIntL-1) ligand s navázanou allyl-beta-D-galaktofuranózou. Ion vápníku je zobrazen jako zelená koule a uspořádané molekuly vody jsou zobrazeny jako červené koule.[4]
Oligomerní stav
hIntL-1 je trimér spojený s disulfidem, jak ukazuje neredukující SDS-PAGE[3] a rentgenová krystalografie.[4] Přes chybějící intermolekulární disulfidové vazby je XEEL-CRD v roztoku trimerický.[5] N-koncový peptid XEEL o plné délce je zodpovědný za dimerizaci trimerního XEEL-CRD na hexamerický XEEL o plné délce spojený s disulfidem.[5] Proto jsou N-konce intelektinů často zodpovědné za tvorbu oligomeru vázaného disulfidem. V intelektinových homologech, kde chybí N-koncové cysteiny, může být CRD sama stále schopná tvořit nekovalentní oligomer v roztoku.
- Trimerické struktury intelektinů

Disulfidově vázaný trimerní lidský intelektin-1.[4]
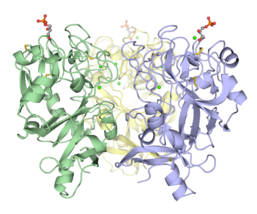
Trimerní doména pro rozpoznávání sacharidů z embryonálního epidermálního lektinu Xenopus (XEEL-CRD). Rozsáhlé biofyzikální výzkumy přesvědčivě ukazují, že XEEL-CRD je v roztoku trimerický, přestože chybí mezimolekulární disulfidové vazby nalezené v hIntL-1.[5]
Reference
- ^ Lee JK, Baum LG, Moremen K, Pierce M (srpen 2004). „X-lektiny: nová rodina s homologií s lektinem oocytů Xenopus laevis XL-35“. Glycoconjugate Journal. 21 (8–9): 443–50. CiteSeerX 10.1.1.537.3931. doi:10.1007 / s10719-004-5534-6. PMID 15750785. S2CID 41789407.
- ^ A b Yan J, Xu L, Zhang Y, Zhang C, Zhang C, Zhao F, Feng L (říjen 2013). "Srovnávací genomové a fylogenetické analýzy rodiny genů intelektinu: důsledky pro jejich původ a vývoj". Vývojová a srovnávací imunologie. 41 (2): 189–99. doi:10.1016 / j.dci.2013.04.016. PMID 23643964.
- ^ A b C Tsuji S, Uehori J, Matsumoto M, Suzuki Y, Matsuhisa A, Toyoshima K, Seya T (červen 2001). „Lidský intelektin je nový rozpustný lektin, který rozpoznává galaktofuranózu v sacharidových řetězcích bakteriální buněčné stěny“. The Journal of Biological Chemistry. 276 (26): 23456–63. doi:10,1074 / jbc.M103162200. PMID 11313366.
- ^ A b C d E F G h Wesener DA, Wangkanont K, McBride R, Song X, Kraft MB, Hodges HL, Zarling LC, Splain RA, Smith DF, Cummings RD, Paulson JC, Forest KT, Kiessling LL (srpen 2015). "Rozpoznání mikrobiálních glykanů lidským intelektinem-1". Přírodní strukturní a molekulární biologie. 22 (8): 603–10. doi:10.1038 / nsmb.3053. PMC 4526365. PMID 26148048.
- ^ A b C d E F G h i j k l m Wangkanont K, Wesener DA, Vidani JA, Kiessling LL, Forest KT (leden 2016). „Struktury embryonálního epidermálního lektinu Xenopus odhalují konzervovaný mechanismus rozpoznávání mikrobiálních glykanů“. The Journal of Biological Chemistry. 291 (11): 5596–610. doi:10,1074 / jbc.M115.709212. PMC 4786701. PMID 26755729.
- ^ Suzuki YA, Shin K, Lönnerdal B (prosinec 2001). "Molekulární klonování a funkční exprese lidského střevního receptoru laktoferinu". Biochemie. 40 (51): 15771–9. doi:10.1021 / bi0155899. PMID 11747454.
- ^ Kerr SC, Carrington SD, Oscarson S, Gallagher ME, Solon M, Yuan S, Ahn JN, Dougherty RH, Finkbeiner WE, Peters MC, Fahy JV (duben 2014). „Intelectin-1 je prominentní proteinová složka patologického hlenu spojeného s eozinofilním zánětem dýchacích cest u astmatu“. American Journal of Respiratory and Critical Care Medicine. 189 (8): 1005–7. doi:10,1164 / rccm.201312-2220LE. PMC 4098098. PMID 24735037.
- ^ Yang RZ, Lee MJ, Hu H, Pray J, Wu HB, Hansen BC, Shuldiner AR, Fried SK, McLenithan JC, Gong DW (červen 2006). „Identifikace omentinu jako nového depotně specifického adipokinu v lidské tukové tkáni: možná role v modulaci působení inzulínu“. American Journal of Physiology. Endokrinologie a metabolismus. 290 (6): E1253–61. doi:10.1152 / ajpendo.00572.2004. PMID 16531507.
- ^ Roberson MM, Barondes SH (červenec 1982). "Lektin z embryí a oocytů Xenopus laevis. Čištění a vlastnosti". The Journal of Biological Chemistry. 257 (13): 7520–4. PMID 7085636.
- ^ Nishihara T, Wyrick RE, Working PK, Chen YH, Hedrick JL (říjen 1986). "Izolace a charakterizace lektinu z kortikálních granulí vajec Xenopus laevis". Biochemie. 25 (20): 6013–20. doi:10.1021 / bi00368a027. PMID 3098282.
- ^ Lee JK, Buckhaults P, Wilkes C, Teilhet M, King ML, Moremen KW, Pierce M (duben 1997). „Klonování a exprese lektinu oocytů Xenopus laevis a charakterizace jeho hladin mRNA během raného vývoje“. Glykobiologie. 7 (3): 367–72. doi:10.1093 / glycob / 7.3.367. PMID 9147045.
- ^ Shoji H, Ikenaka K, Nakakita S, Hayama K, Hirabayashi J, Arata Y, Kasai K, Nishi N, Nakamura T (červenec 2005). „Xenopus galectin-VIIa váže N-glykany členů lektinové rodiny kortikálních granulí (xCGL a xCGL2)“. Glykobiologie. 15 (7): 709–20. doi:10.1093 / glycob / cwi051. PMID 15761024.
- ^ Nagata S, Nakanishi M, Nanba R, Fujita N (červenec 2003). "Vývojová exprese XEEL, nové molekuly rodiny lektinů z kortikálních granulí oocytů Xenopus". Vývojové geny a evoluce. 213 (7): 368–70. doi:10.1007 / s00427-003-0341-9. PMID 12802587. S2CID 41996445.
- ^ Nagata S (březen 2005). „Izolace, charakterizace a extraembryonální sekrece embryonálního epidermálního lektinu Xenopus laevis, XEEL“. Glykobiologie. 15 (3): 281–90. doi:10.1093 / glycob / cwi010. PMID 15537792.
- ^ Nagata S, Nishiyama S, Ikazaki Y (červen 2013). „Bakteriální lipopolysacharidy stimulují produkci XCL1, na vápníku závislého lipopolysacharidu vázajícího sérového lektinu, v Xenopus laevis.“ Vývojová a srovnávací imunologie. 40 (2): 94–102. doi:10.1016 / j.dci.2013.02.008. PMID 23454582.
- ^ Nagata S (únor 2016). "Identifikace a charakterizace nového intelektinu v zažívacím traktu Xenopus laevis". Vývojová a srovnávací imunologie. 59: 229–239. doi:10.1016 / j.dci.2016.02.006. PMID 26855011.
- ^ Lee JK, Schnee J, Pang M, Wolfert M, Baum LG, Moremen KW, Pierce M (leden 2001). "Lidské homology lektinu z kortikální granule oocytů Xenopus XL35". Glykobiologie. 11 (1): 65–73. doi:10.1093 / glycob / 11.1.65. PMID 11181563.
- ^ Lu ZH, di Domenico A, Wright SH, Knight PA, Whitelaw CB, Pemberton AD (2011). „Varianta počtu kopií specifická pro kmen v lokusu intelektinu na chromozomu 1 myši 129“. BMC Genomics. 12 (1): 110. doi:10.1186/1471-2164-12-110. PMC 3048546. PMID 21324158.
- ^ Abe Y, Tokuda M, Ishimoto R, Azumi K, Yokosawa H (duben 1999). „Jedinečná primární struktura, klonování cDNA a funkce lektinu specifického pro galaktózu z ascidianové plazmy“. European Journal of Biochemistry / FEBS. 261 (1): 33–9. doi:10.1046 / j.1432-1327.1999.00238.x. PMID 10103030.
- ^ Yan J, Wang J, Zhao Y, Zhang J, Bai C, Zhang C, Zhang C, Li K, Zhang H, Du X, Feng L (červenec 2012). „Identifikace homologu amphioxus intelektinu, který přednostně aglutinuje grampozitivní oproti gramnegativním bakteriím pravděpodobně kvůli odlišné vazebné kapacitě k LPS a PGN.“ Imunologie ryb a měkkýšů. 33 (1): 11–20. doi:10.1016 / j.fsi.2012.03.023. PMID 22475783.
- ^ Yan J, Zhang C, Zhang Y, Li K, Xu L, Guo L, Kong Y, Feng L (květen 2013). "Charakterizace a srovnávací analýzy dvou amphioxus intelektinů zapojených do vrozené imunitní odpovědi". Imunologie ryb a měkkýšů. 34 (5): 1139–46. doi:10.1016 / j.fsi.2013.01.017. PMID 23428515.
- ^ Lin B, Cao Z, Su P, Zhang H, Li M, Lin Y, Zhao D, Shen Y, Jing C, Chen S, Xu A (březen 2009). "Charakterizace a srovnávací analýzy intelektinů zebrafish: vysoce konzervované sekvence, diverzifikované struktury a funkce". Imunologie ryb a měkkýšů. 26 (3): 396–405. doi:10.1016 / j.fsi.2008.11.019. PMID 19100836.
- ^ Russell S, Young KM, Smith M, Hayes MA, Lumsden JS (červenec 2008). „Identifikace, klonování a tkáňová lokalizace pstruha duhového (Oncorhynchus mykiss) proteinu podobného intelektinu, který váže bakterie a chitin“. Imunologie ryb a měkkýšů. 25 (1–2): 91–105. doi:10.1016 / j.fsi.2008.02.018. PMID 18502147.
- ^ Russell S, Hayes MA, Lumsden JS (leden 2009). "Imunohistochemická lokalizace pstruha duhového ladderlectinu a intelektinu u zdravých a infikovaných pstruhů duhových (Oncorhynchus mykiss)". Imunologie ryb a měkkýšů. 26 (1): 154–63. doi:10.1016 / j.fsi.2008.03.001. PMID 19046637.
- ^ Datta R, deSchoolmeester ML, Hedeler C, Paton NW, Brass AM, Else KJ (červenec 2005). „Identifikace nových genů ve střevní tkáni, které jsou regulovány po infekci parazitem nematodů ve střevě“. Infekce a imunita. 73 (7): 4025–33. doi:10.1128 / IAI.73.7.4025-4033.2005. PMC 1168561. PMID 15972490.
- ^ French AT, Knight PA, Smith WD, Brown JK, Craig NM, Pate JA, Miller HR, Pemberton AD (březen 2008). "Up-regulace intelektinu u ovcí po infekci Teladorsagia circumcincta". International Journal for Parasitology. 38 (3–4): 467–75. doi:10.1016 / j.ijpara.2007.08.015. PMID 17983620.
Další čtení
- Wesener DA, Wangkanont K, McBride R, Song X, Kraft MB, Hodges HL, Zarling LC, Splain RA, Smith DF, Cummings RD, Paulson JC, Forest KT, Kiessling LL (srpen 2015). "Rozpoznání mikrobiálních glykanů lidským intelektinem-1". Přírodní strukturní a molekulární biologie. 22 (8): 603–10. doi:10.1038 / nsmb.3053. PMC 4526365. PMID 26148048. pro vyčerpávající analýzu vazby ligandu na lidský intelektin-1 (hIntL-1). Článek také odhaluje, jak může hIntL-1 rozlišovat mezi mikrobiálními a savčími buňkami.
- Wangkanont K, Wesener DA, Vidani JA, Kiessling LL, Forest KT (leden 2016). „Struktury embryonálního epidermálního lektinu Xenopus odhalují konzervovaný mechanismus rozpoznávání mikrobiálních glykanů“. The Journal of Biological Chemistry. 291 (11): 5596–610. doi:10,1074 / jbc.M115.709212. PMC 4786701. PMID 26755729. k diskusi o tom, jak byla vyřešena první struktura intelektinu (XEEL-CRD). Hloubkové biofyzikální a evoluční analýzy rodiny intelektinů ve světle dostupných 3D struktur také poskytují významné poznatky o této rodině proteinů, které nebyly dříve oceněny. Článek slouží jako nejaktuálnější přehled o biochemii rodiny intelektinů.
- Yan J, Xu L, Zhang Y, Zhang C, Zhang C, Zhao F, Feng L (říjen 2013). „Srovnávací genomové a fylogenetické analýzy rodiny genů intelektinu: důsledky pro jejich původ a vývoj“. Vývojová a srovnávací imunologie. 41 (2): 189–99. doi:10.1016 / j.dci.2013.04.016. PMID 23643964. pro komplexní genomickou analýzu intelektinů z různých organismů.




