Kyselina fosforečná - Hypophosphoric acid
 | |
| Jména | |
|---|---|
| Název IUPAC Kyselina hypodifosforečná | |
| Ostatní jména Kyselina difosforečná | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| H4P2Ó6 | |
| Molární hmotnost | 161,98 g / mol |
| Vzhled | Bílá pevná látka (dihydrát) |
| Bod tání | 54 ° C (129 ° F; 327 K) |
| Konjugovaná základna | Hypofosfát |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
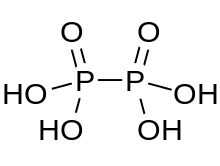
Kyselina fosforečná je minerální kyselina se vzorcem H4P2Ó6, s fosforem ve formálním oxidační stav +4. V pevném stavu je přítomen jako dihydrát, H4P2Ó6· 2H2O. V kyselině fosforečné jsou atomy fosforu identické a jsou spojeny přímo vazbou P-P. Kyselina isohypofosforečná je strukturní izomer kyseliny fosforité, ve které je na jednom fosforu přímo vázán vodík a tento atom fosforu je s druhým vázán kyslíkovým můstkem za vzniku kyselina fosforitá /kyselina fosforečná smíšený anhydrid. Dva atomy fosforu jsou v oxidačním stavu +3, respektive +5.
Příprava a reakce
Kyselinu fosforečnou lze připravit reakcí červeného fosforu s chloritan sodný pokojová teplota.[1]
- 2 P + 2 NaClO2 + 2 H2O → Na2H2P2Ó6 + 2 HCl
Směs kyseliny fosforečné, kyselina fosforitá (H3PO3) a kyselina fosforečná (H3PO4) vzniká, když bílý fosfor oxiduje ve vzduchu, když je částečně ponořen do vody.[1]
Tetrasodná sůl Na4P2Ó6· 10 hodin2O krystalizuje při pH 10 a disodná sůl Na2H2PO6· 6H2O při pH 5,2.[2] Disodná sůl může projít iontoměničovou kolonou za vzniku kyselého dihydrátu H4P2Ó6· 2H2Ó.[1]
Bezvodá kyselina může být vytvořena vakuovou dehydratací P4Ó10 nebo reakcí H2S na fosforečnan olovnatý, Pb2P2Ó6.[2]
Kyselina hypofosforečná je tetraprotická s disociačními konstantami pK.a1 = 2,2, sK.a2 = 2,8, sK.a3 = 7,3 a pK.a4 = 10.0.[2]
Při stání prochází bezvodá kyselina přesmykem a disproporcionací za vzniku směsi kyseliny isohypofosforečné, HPO (OH) -O-PO2(ACH); kyselina pyrofosforečná H2P2Ó7 a kyselina pyrofosforečná.[2]
Kyselina fosforečná je za tepla nestabilní kyselina chlorovodíková, ve 4 M HCl hydrolyzuje za vzniku H3PO3 + H3PO4.[2]
Struktura
Kyselina hypofosforečná obsahuje ionty oxonia a je nejlépe formulována [H3Ó+]2 [H2P2Ó6]2−. Kyselina je isostrukturní s diamonnou solí, která obsahuje [HOPO2PO2ACH]2− anion s délkou vazby P-P 219 pm.[1]
HOPO2PO2ACH2− anion v Na2H2P2Ó6· 6H2O má symetrické, rozložené etan struktura podobná vazbě P-P o délce 219 pm. Každý atom fosforu má dvě vazby P-O o délce 151 pm a délku vazby P-OH 159 pm.[3]
Hypofosforečnanové soli
Je známo mnoho hypofosfátových solí, například K.4P2Ó6· 8H2O, Ca2P2Ó6· 2H2OK3HP2Ó6· 3H2OK2H2P2Ó6· 2H2O, KH3P2Ó6.
Při stání na vzduchu mají hypofosfáty sklon k oxidaci pyrofosfáty obsahující P
2Ó4−
7 iont, kde P má formální oxidační stav +5. Hypofosforečnany jsou stabilní vůči alkalickým hydroxidům. V kondenzované hydroxid sodný rychle se přeměňují na ortofosfát obsahující PO3−
4.[1]
Polyhypofosfáty
Jsou známy polyhypofosfáty obsahující lineární anionty, například Na5P3Ó8 obsahující O (PO
2)3Ó5− s řetězcem P − P − P a Na6P4Ó10· 2H2O obsahující O (PO
2)4Ó6−, s řetězcem P − P − P − P. Cyklický anion (PO
2)6−
6, (hypohexametafosfát[4]) kde každý atom fosforu má oxidační stav +3, vzniká oxidací suspenze červeného fosforu v KOH bromem.[1]
Viz také
- Kyselina dithionová, ekvivalent síry.
Reference
- ^ A b C d E F Phosphorus: Chemistry, Biochemistry and Technology, Sixth Edition, 2013, D.E.C. Corbridge, CRC Pres, Taylor Francis Group, ISBN 978-1-4398-4088-7
- ^ A b C d E Greenwood, Norman N.; Earnshaw, Alan (1984). Chemie prvků. Oxford: Pergamon Press. str. 515–516. ISBN 978-0-08-022057-4.
- ^ Collin, R.L .; Willis, M. (1971). "Krystalová struktura hexahydrátu dihydrogenfosforečnanu disodného (Na2H2P2Ó6· 6H2O) a hexahydrát dihydrogenpyrofosforečnanu sodného (Na2H2P2Ó7· 6H2Ó)". Acta Crystallographica oddíl B. 27 (2): 291–302. doi:10.1107 / S0567740871002127. ISSN 0567-7408.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Anorganická chemie, přeloženo Eaglesonem, Mary; Brewer, William, San Diego / Berlin: Academic Press / De Gruyter, str. 715, ISBN 0-12-352651-5
