Poškození DNA volnými radikály - Free radical damage to DNA
Poškození DNA volnými radikály může dojít v důsledku vystavení ionizaci záření nebo radioimimetické[1] sloučeniny. Poškození DNA jako výsledek volné radikály útok se nazývá nepřímé poškození DNA protože vytvořené radikály mohou difundovat do celého těla a ovlivňovat další orgány. Maligní melanom může být způsobeno nepřímým poškozením DNA, protože se nachází v částech těla, které nejsou vystaveny slunečnímu záření. DNA je zranitelná vůči radikálním útokům právě kvůli tomu labilní vodíky to může být abstrahováno a prevalence dvojných vazeb v DNA báze že radikály lze snadno přidat na.[2]
Poškození radiační zátěží
Radiolýza iontového záření vytváří nitrobuněčnou vodu peroxidy, což jsou relativně stabilní předchůdci hydroxylové radikály. 60% - 70% celulárních DNA poškození je způsobeno hydroxylovými radikály,[3] přesto jsou hydroxylové radikály tak reaktivní, že mohou před reakcí s buněčnými složkami difundovat pouze jeden nebo dva průměry molekul. Proto musí bezprostředně sousedit s hydroxylovými radikály nukleové kyseliny abychom mohli reagovat. Radiolýza vody vytváří peroxidy, které mohou působit jako difúzní, latentní formy hydroxylových radikálů. Některé kovové ionty v blízkosti DNA generují hydroxylové radikály z peroxidu.[4]
- H2O + hν → H2Ó+ + e−
- H2O + e− → H2Ó−
- H2Ó+ → H+ + OH·
- H2Ó− → OH− + H·
- 2 OH· → H2Ó2
Předpokládá se, že poškození DNA volnými radikály vede k mutacím, které mohou vést k některým rakovinám.
Fentonova reakce
The Fentonova reakce vede k tvorbě hydroxylových radikálů z peroxidu vodíku a katalyzátoru železa (II). Železo (III) se regeneruje prostřednictvím Haber-Weissova reakce. Přechodné kovy s volným koordinačním místem jsou schopné redukovat peroxidy na hydroxylové radikály.[1] Železo je považováno za kov odpovědný za tvorbu hydroxylových radikálů, protože ve většině živých organismů existuje v nejvyšší koncentraci přechodného kovu.[5] Fentonova reakce je možná, protože přechodné kovy mohou existovat ve více než jednom oxidačním stavu a jejich valenční elektrony mohou být nepárové, což jim umožňuje účastnit se redoxních reakcí s jedním elektronem.
- Fe2+ + H2Ó2 → Fe3+ + OH· + OH−
Vytváření hydroxylových radikálů katalýzou železa (II) je důležité, protože železo (II) lze nalézt v koordinaci s DNA, a tedy v její těsné blízkosti. Tato reakce umožňuje, aby peroxid vodíku vytvořený radiolýzou vody difundoval do jádra a reagoval s železem (II) za vzniku hydroxylových radikálů, které zase reagovaly s DNA. Umístění a vazba železa (II) na DNA může hrát důležitou roli při určování substrátu a povahy radikálního útoku na DNA. Fentonova reakce generuje dva typy oxidantů, typ I a typ II. Oxidanty typu I jsou středně citlivé na peroxidy a ethanol.[5] Okysličovadla typu I a typu II se přednostně štěpí ve specifických sekvencích.[5]
Radikální hydroxylový útok

Hydroxylové radikály mohou napadat páteř a báze deoxyribózy DNA a potenciálně způsobit nepřeberné množství léze to může být cytotoxický nebo mutagenní. Buňky vyvinuly složité a účinné opravné mechanismy k fixaci lézí. V případě útoku volných radikálů na DNA oprava základní excize je použitý mechanismus opravy. Reakce hydroxylových radikálů s hlavním řetězcem cukru deoxyribózy jsou iniciovány odběrem vodíku z uhlíku deoxyribózy a hlavním důsledkem je případné rozlomení řetězce a uvolnění báze. Hydroxylový radikál reaguje s různými atomy vodíku deoxyribózy v řádu 5 'H> 4' H> 3 'H ≈ 2' H ≈ 1 'H. Toto pořadí reaktivity se vyrovná expozici rozpouštědlu vodíků deoxyribózy.[6]
Hydroxylové radikály reagují s bázemi DNA přidáním do elektronově bohatých vazeb pi. Tyto pi vazby v bázích se nacházejí mezi C5-C6 pyrimidiny a N7-C8 v puriny.[7] Po přidání hydroxylového radikálu může vzniknout mnoho stabilních produktů. Obecně radikální hydroxylové útoky na bazické skupiny nezpůsobují pozměněné cukry nebo zlomení řetězců, kromě případů, kdy modifikace labilizují N-glykosylovou vazbu, což umožňuje tvorbu bazických míst, která jsou předmětem beta-eliminace.
Abasic stránky

Odběr vodíku z uhlíku 1'-deoxyribózy hydroxylovým radikálem vytváří radikál 1'-deoxyribosyl. Radikál pak může reagovat s molekulárním kyslíkem, čímž vytvoří peroxylový radikál, který lze redukovat a dehydratovat, čímž se získá 2’-deoxyribonolakton a volná báze. Deoxyribonolakton je mutagenní a odolný vůči opravným enzymům. Tak je vytvořen abasický web.[8]
Radikální poškození radiomimetickými sloučeninami
Radikální poškození DNA může také nastat interakcí DNA s určitými přírodními produkty známými jako radiomimetické sloučeniny, molekulární sloučeniny, které ovlivňují DNA podobným způsobem jako expozice záření. Radiomimetické sloučeniny indukují dvouřetězcové zlomy v DNA prostřednictvím vysoce specifických soustředěných útoků volných radikálů na deoxyribózové skupiny v obou řetězcích DNA.
Obecný mechanismus
Mnoho radioimimetických sloučenin je enediynes, které procházejí Bergmanova cyklizace reakce na výrobu a 1,4-didehydrobenzen diradical. 1,4-didehydrobenzen diradical je vysoce reaktivní a bude odebírat vodíky z jakéhokoli možného donoru vodíku.
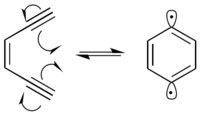
V přítomnosti DNA odebírá diradical 1,4-didehydrobenzen diradical vodíky z páteřního řetězce cukru deoxyribózy, převážně v polohách C-1 ', C-4' a C-5 '. Odběr vodíku způsobuje tvorbu radikálů na zreagovaném uhlíku. Uhlíkový radikál reaguje s molekulárním kyslíkem, což vede k roztržení řetězce v DNA různými mechanismy.[9] 1,4-Didehydrobenzen se dokáže umístit takovým způsobem, že může abstrahovat proximální vodíky z obou řetězců DNA.[10] To produkuje dvouřetězcový zlom DNA, který může vést k buněčnému apoptóza pokud není opraven.

Enediynes obecně procházejí Bergmanovou cyklizací při teplotách přesahujících 200 ° C. Avšak začleněním enediynu do 10členného cyklického uhlovodíku je reakce termodynamicky příznivější uvolněním napětí v kruhu reaktantů. To umožňuje, aby k Bergmanově cyklizaci došlo při 37 ° C, biologické teplotě člověka. Bylo zjištěno, že molekuly, které začleňují enediyny do těchto větších kruhových struktur, jsou extrémně vysoké cytotoxický.[11]
Přírodní produkty
Enediynes jsou přítomny v mnoha složitých přírodních produktech. Původně byly objeveny počátkem 80. let při hledání nových protirakovinných produktů produkovaných mikroorganismy.[10] Kalicheamicin byl jedním z prvních identifikovaných produktů a byl původně nalezen ve vzorku půdy odebraném z Kerrville v Texasu. Tyto sloučeniny jsou syntetizovány bakteriemi jako obranné mechanismy díky jejich schopnosti štěpit DNA tvorbou 1,4-didehydrobenzenu z enediynové složky molekuly.

Kalicheamicin a další příbuzné sloučeniny mají několik společných charakteristik. Rozšířené struktury připojené k enediynu umožňují sloučenině specificky vázat DNA,[12] ve většině případů do vedlejší drážky dvojité šroubovice. Část molekuly je dále známá jako „spouštěč“, který za specifických fyziologických podmínek aktivuje enediyn, známý jako „hlavice“, a vytváří se 1,4-didehydrobenzen.
Od té doby byly identifikovány tři třídy enediynes: kalicheamicin, dynemicin, a chromoprotein založené produkty.
Typy kalicheamicinu jsou definovány methyltrisulfidovou skupinou, která se podílí na spuštění molekuly následujícím mechanismem.[10]

Kalicheamicin a blízcí příbuzní esperamicin byly použity jako protinádorové léky kvůli jejich vysoké toxicitě a specificitě.[10]
Dynemicin a jeho příbuzní jsou charakterizováni přítomností antrachinon a enediyne jádro. Antrachinonová složka umožňuje specifickou vazbu DNA na 3 'straně purinových bází interkalace, místo, které se liší od kalicheamicinu. Jeho schopnost štěpit DNA se v přítomnosti výrazně zvyšuje NADPH a thiol sloučeniny.[13] Tato sloučenina také našla důležitost jako protinádorové činidlo.[13]

Chromoproteinové enediyny se vyznačují nestabilitou chromofor enediyne vázán na apoprotein.

Chromofor je po navázání na apoprotein nereaktivní. Po uvolnění reaguje za vzniku 1,4-didehydrobenzenu a následně štěpí DNA.
Protinádorová schopnost
Většina enediynes, včetně těch, které jsou uvedeny výše, byla použita jako silná protinádorová antibiotika kvůli jejich schopnosti účinně štěpit DNA. Kalicheamicin a esperamicin jsou dva nejčastěji používané typy kvůli jejich vysoké specificitě při vazbě na DNA, což minimalizuje nepříznivé vedlejší reakce.[12] Ukázalo se, že jsou zvláště užitečné při léčbě Akutní myeloidní leukémie.[14]
Kalicheamicin je navíc schopen štěpit DNA při nízkých koncentracích, což je až 1000krát účinnější než adriamycin v boji proti určitým typům nádorů.[15] Ve všech případech buňkám chybí schopnost opravit dvouřetězcové zlomy DNA, což činí tyto sloučeniny obzvláště účinné při léčbě nádorových buněk.
Mechanismus volných radikálů k léčbě určitých typů rakoviny přesahuje enediynes. Tirapazamin generuje volný radikál za anoxických podmínek místo spouštěcího mechanismu enediyne. Volný radikál poté pokračuje ve štěpení DNA podobným způsobem jako 1,4-didehydrobenzen za účelem léčby rakovinných buněk. V současné době je ve studiích fáze III.
Reference
- ^ A b Barbusinski K (2009). „Fentonova reakce - kontroverze týkající se chemie“. Ekologická chemie a inženýrství. 16 (3).
- ^ Greenberg MM (2016). "Reaktivita radikálů nukleových kyselin". Pokroky ve fyzikální organické chemii. Elsevier. 50: 119–202. doi:10.1016 / bs.apoc.2016.02.001. ISBN 978-0-12-804716-3. PMC 5435387. PMID 28529390.
- ^ Ward JF (1988). „Poškození DNA způsobené ionizujícím zářením v savčích buňkách: identity, mechanismy formace a opravitelnosti“. Pokrok ve výzkumu nukleových kyselin a molekulární biologie. 35 (3): 95–125. doi:10.1016 / s0079-6603 (08) 60611-x. ISBN 9780125400350. PMID 3065826. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Henle ES, Linn S (srpen 1997). "Tvorba, prevence a oprava poškození DNA působením železa / peroxidu vodíku". The Journal of Biological Chemistry. 272 (31): 19095–8. doi:10.1074 / jbc.272.31.19095. PMID 9235895. S2CID 11016259.
- ^ A b C Pogozelski WK, Tullius TD (květen 1998). „Oxidační pramenná štěpení nukleových kyselin: cesty iniciované odběrem vodíku z cukrové složky“. Chemické recenze. 98 (3): 1089–1108. doi:10.1021 / cr960437i. PMID 11848926.
- ^ Balasubramanian B, Pogozelski WK, Tullius TD (srpen 1998). „Lámání řetězce DNA hydroxylovým radikálem se řídí přístupnými povrchovými plochami atomů vodíku v páteři DNA“. Sborník Národní akademie věd Spojených států amerických. 95 (17): 9738–43. Bibcode:1998PNAS ... 95.9738B. doi:10.1073 / pnas.95.17.9738. PMC 21406. PMID 9707545.
- ^ Steenken S (1989). „Purinové báze, nukleotidy a nukleotidy: redoxní chemie vodných roztoků a transformační reakce jejich radikálových kationtů a e- a OH aduktů“. Chem. Rev. 89 (3): 503–529. doi:10.1021 / cr00093a003.
- ^ Lhomme J, Constant JF, Demeunynck M (1999). "Abazická struktura DNA, reaktivita a rozpoznávání". Biopolymery. 52 (2): 65–83. doi:10.1002 / 1097-0282 (1999) 52: 2 <65 :: aid-bip1> 3.3.co; 2-l. PMID 10898853.
- ^ Povirk LF (1996). „Poškození DNA a mutageneze radiomimetickými látkami štěpícími DNA: Bleomycin, neocarzinostatin a další enediyny“. Mutační výzkum / Základní a molekulární mechanismy mutageneze. 355 (1–2): 71–89. doi:10.1016/0027-5107(96)00023-1.
- ^ A b C d Kraka E, Cremer D (2000). „Počítačový design protinádorových léků. Nová enediynová hlavice“. J. Am. Chem. Soc. 122 (34): 8245–8264. doi:10.1021 / ja001017k.
- ^ Zhen YS, Ming XY, Yu B, Otani T, Saito H, Yamada Y (srpen 1989). „Nové makromolekulární protinádorové antibiotikum, C-1027. III. Protinádorová aktivita“. The Journal of Antibiotics. 42 (8): 1294–8. doi:10,7164 / antibiotika. 42,1294. PMID 2759910.
- ^ A b Ellestad GA (září 2011). „Strukturální a konformační znaky relevantní pro protinádorovou aktivitu kalicheamicinu y 1I“. Chirality. 23 (8): 660–71. doi:10,1002 / chir.20990. PMID 21800378.
- ^ A b Sugiura Y, Shiraki T, Konishi M, Oki T (květen 1990). „Interkalace DNA a štěpení protinádorového antibiotika dynemicinu, které obsahuje antracyklin a jádra enediynu“. Sborník Národní akademie věd Spojených států amerických. 87 (10): 3831–5. Bibcode:1990PNAS ... 87.3831S. doi:10.1073 / pnas.87.10.3831. PMC 53997. PMID 2339123.
- ^ Sievers EL, Appelbaum FR, Spielberger RT, Forman SJ, Flowers D, Smith FO, Shannon-Dorcy K, Berger MS, Bernstein ID (červen 1999). „Selektivní ablace akutní myeloidní leukémie pomocí chemoterapie cílené na protilátky: studie fáze I anti-CD33 kalicheamicinového imunokonjugátu“. Krev. 93 (11): 3678–84. doi:10.1182 / krev. V93.11.3678. PMID 10339474.
- ^ Zein N, Sinha AM, McGahren WJ, Ellestad GA (květen 1988). „Calicheamicin gama 11: protinádorové antibiotikum, které specificky štěpí dvouvláknové místo DNA“. Věda. 240 (4856): 1198–201. Bibcode:1988Sci ... 240.1198Z. doi:10.1126 / science.3240341. PMID 3240341.
