Trypanothion - Trypanothione
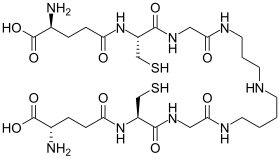 | |
 Redukovaná forma (nahoře) a oxidovaná forma (dole) | |
| Jména | |
|---|---|
| Ostatní jména N1,N8-Bis (glutathionyl) spermidin | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
PubChem CID |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C27H47N9Ó10S2 (oxidovaný) C27H49N9Ó10S2 (sníženo) | |
| Molární hmotnost | 721,84 g / mol (oxidovaný) 723,86 g / mol (redukované) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Trypanothion je neobvyklá forma glutathion obsahující dvě molekuly glutathionu spojené a spermidin (polyamin ) linker. Nachází se v parazitických prvcích, jako jsou leishmania a trypanosomy.[1] Příčinou jsou tito protozoální paraziti leishmanióza, spavá nemoc a Chagasova nemoc. Trypanothion objevil Alan Fairlamb. Jeho struktura byla prokázána chemickou syntézou.[2] Je to jedinečné pro Kinetoplastida a nenalezeny u jiných parazitických prvoků, jako jsou Entamoeba histolytica.[3] Protože tento thiol u lidí chybí a je nezbytný pro přežití parazitů, enzymy které vyrábějí a používají tuto molekulu, jsou cílem vývoje nových léků k léčbě těchto onemocnění.[4]
Mezi enzymy závislé na trypanothionu patří reduktázy, peroxidázy, glyoxalázy a transferázy. Trypanothion-disulfid reduktáza (TryR) byl prvním objeveným enzymem závislým na trypanothionu (ES 1.8.1.12 ). Jedná se o flavoenzym závislý na NADPH, který snižuje trypanothion disulfid. TryR je nezbytný pro přežití těchto parazitů in vitro a v lidském hostiteli.[5][6]
Hlavní funkcí trypanothionu je obrana proti oxidační stres.[7] Zde enzymy závislé na trypanothionu, jako je tryparedoxinperoxidáza (TryP ) snížit peroxidy pomocí elektronů darovaných buď přímo z trypanothionu, nebo prostřednictvím redox meziproduktu tryparedoxinu (TryX ). Závisí na trypanothionu peroxid vodíku metabolismus je u těchto organismů zvláště důležitý, protože jim chybí kataláza. Vzhledem k tomu, trypanosomatids také chybí ekvivalent thioredoxin reduktáza trypanothion reduktáza je jedinou cestou, kterou mohou elektrony vést z NADPH k těmto antioxidačním enzymům.

Reference
- ^ Fairlamb AH, Cerami A (1992). "Metabolismus a funkce trypanothionu v kinetoplastidě". Annu. Rev. Microbiol. 46: 695–729. doi:10.1146 / annurev.mi.46.100192.003403. PMID 1444271.
- ^ Fairlamb, A. H .; Blackburn, P .; Ulrich, P .; Chait, B. T .; Cerami, A. (březen 1985). „Trypanothion: nový bis (glutathionyl) spermidinový kofaktor pro glutathionreduktázu v trypanosomatidech“. Věda. 227 (4693): 1485–1487. Bibcode:1985Sci ... 227.1485F. doi:10.1126 / science.3883489. ISSN 0036-8075. PMID 3883489.
- ^ Ariyanayagam MR, Fairlamb AH (září 1999). „Entamoeba histolytica postrádá metabolismus trypanothionu“. Mol. Biochem. Parazitol. 103 (1): 61–9. doi:10.1016 / S0166-6851 (99) 00118-8. PMID 10514081.
- ^ Schmidt A, Krauth-Siegel RL (listopad 2002). "Enzymy metabolismu trypanothionu jako cíle vývoje antitrypanosomálních léků". Curr Top Med Chem. 2 (11): 1239–59. doi:10.2174/1568026023393048. PMID 12171583.
- ^ Tovar J, Wilkinson S, Mottram JC, Fairlamb AH (červenec 1998). „Důkazy, že trypanothion reduktáza je základním enzymem v Leishmanii cílenou náhradou lokusu genu tryA“. Mol. Microbiol. 29 (2): 653–60. doi:10.1046 / j.1365-2958.1998.00968.x. PMID 9720880.
- ^ Krieger S, Schwarz W, Ariyanayagam MR, Fairlamb AH, Krauth-Siegel RL, Clayton C (únor 2000). „Trypanosomy bez trypanothion reduktázy jsou avirulentní a vykazují zvýšenou citlivost na oxidační stres.“ Mol. Microbiol. 35 (3): 542–52. doi:10.1046 / j.1365-2958.2000.01721.x. PMID 10672177.
- ^ Krauth-Siegel RL, Meiering SK, Schmidt H (duben 2003). „Metabolismus trypanothionu specifický pro parazity trypanosomu a leishmánie“. Biol. Chem. 384 (4): 539–49. doi:10.1515 / BC.2003.062. PMID 12751784.
