Chirurgická síť - Surgical mesh

Chirurgická síť je volně tkaná plachta, která se používá jako trvalá nebo dočasná podpora pro orgány a další papírové kapesníky v době chirurgická operace. Chirurgická síť je vytvořena z obou anorganické a biologické materiály a používá se při různých operacích. Ačkoli oprava kýly chirurgie je nejběžnější aplikací, lze ji také použít rekonstrukční práce, například v výhřez pánevních orgánů.[1]
Trvalé sítě zůstávají v těle, zatímco dočasné se časem rozpouštějí. Například, Testovací síť TIGR Matrix v roce 2012 bylo prokázáno, že se po třech letech ve vědeckém pokusu na ovcích úplně rozpustí.[2] Některé typy sítí kombinují trvalé a dočasné sítě, jako je Vipro, které zahrnuje jak znovu vstřebatelný vipryl, vyrobený z kyselina polyglykolová, a prolen nereabsorbovatelný polypropylen.[3]
Data mechanického a biologického chování sítě in vivo nemusí být vždy v lidském těle souběžné kvůli testování na jiných organismech. Většina publikovaných zpráv experimentuje na myších, čímž se vytváří pravděpodobnost možných rozdílů po vložení do lidského těla. Většina publikovaných výzkumných zpráv také odkazuje na sítě, které jsou aktuálně odstraněny z trhu zdravotnických prostředků kvůli komplikacím po operaci. Absence regulačních protokolů schválených FDA a univerzálních standardních operačních postupů navíc vede k řadě různých testovacích metod od výzkumníka k výzkumníkovi. Experimentování může u různých sítí najít odlišné výsledky.
Lékařské použití
Primární funkcí chirurgické sítě je dočasně nebo trvale podporovat prolapsované orgány. Nejčastěji se používá při operaci kýly v břiše, která je nutná, když orgán vyčnívá přes břišní svaly. Chirurgická síť může být také použita pro rekonstrukci pánevní nebo vaginální stěny u žen a je implementována jako doplněk pro růst poškozené tkáně. V ideálním případě by tyto implantáty měly být dostatečně silné, aby přežily mechanické zatížení a působení jakékoli oblasti těla, do které se stanou součástí.
Operace kýly
Operace kýly je jednou z nejběžnějších současných aplikací chirurgické sítě. Kýly se vyskytují, když se orgány nebo tuková tkáň vydouvají otvory nebo oslabenými oblastmi svalu, obvykle v břišní stěně. Chirurgická síť je implantována, aby se posílila oprava tkáně a minimalizovala se míra recidivy. Chirurgický zákrok může být proveden laparoskopicky (interně) nebo otevřen různými materiály dostupnými pro protézu.[4] Polypropylen (PP) je nejčastěji používaným typem síťky, i když může být pro pacienta po implantaci nepříjemný. Dalším typem, který se při operaci kýly používá méně, je polyethylentereftalát (PET), který čelí komplikacím v tom, že se po několika letech implantace snadno degraduje a vymaže následky operace. Polytetrafluorethylen (PTFE ) se také používá, ale je vyroben ve formě fólie a má potíže s integrací do okolní tkáně, proto ztrácí stabilitu.[5]
Pánevní chirurgie
Podobně jako při operaci kýly lze syntetické sítě použít také pro prolapsy orgánů v pánevní oblasti. Prolaps pánevních orgánů se vyskytuje u 50% žen ve věku nad 50 let s anamnézou jednoho nebo více vaginálních porodů po celý život.[6] Síťovou operaci lze provádět v různých oblastech pánevní oblasti, jako je cystocele, rektokéla a vaginální klenba nebo děloha. Nejčastěji používaným materiálem, jako je tomu při operaci kýly, je PP, o kterém se má za to, že má v regionu přijatelnou biokompatibilitu. Vyvolává mírnou zánětlivou reakci, ale má tendenci přilnout k vnitřnostem.[6]
Vaginální stěna má tři vrstvy: sliznice tunica, muscularis, adventitia. Když dojde k prolapsu, dojde k narušení hladkých vláken svalstva. Bylo také pozorováno, že prolaps u žen zvyšuje tuhost v pánvi, zejména u žen po menopauze.[6] Chirurgická síť, která se používá při rekonstrukci pánve, musí čelit této tuhosti, ale pokud je modul pružnosti příliš vysoký, nebude dostatečně podporovat orgány. Naopak, pokud je síťka příliš tuhá, tkáň bude erodovat a zánětlivé reakce způsobí pooperační komplikace. Poimplantační polypropylenová síťka někdy vykazuje mikrotrhliny, odlupování vláken a fibrózu.[7]
Navíc má síť dostatečnou sílu, aby vydržela základní činnosti a chování tkáně za fyziologických podmínek, zejména během regenerace tkáně samotnou sítí.[6] Tato oblast je vystavena různým zátěžím, které se blíží obsahu břicha, tlaku z břišních / bránicních svalů a pohlavních orgánů, stejně jako respiračních akcí. U průměrné ženy v reprodukčním věku musí pánev vydržet zatížení 20 N v poloze na zádech, 25-35 N ve stoje a 90-130 N při kašlání.[6] Jakákoli síťka, která je implantována do pánevní oblasti, musí být dostatečně silná, aby vydržela tato zatížení.
Nařízení
V roce 2018 Spojené království dočasně zastavilo implantáty vaginální síťoviny pro léčbu močové inkontinence, dokud nebude provedeno další vyšetřování rizik a dostupných záruk.[8]
Ve Spojených státech FDA v roce 2016 překlasifikovala transvaginální chirurgickou síť na „třídu III“ (vysoce rizikovou),[9] a na konci roku 2018 nařízené žádosti o schválení předznámky pro síťku určenou pro opravu prolapsu transvaginálních pánevních orgánů, přičemž další vyšetřování je plánováno na rok 2019.[10] Poté 16. dubna 2019 FDA nařídil všem výrobcům transvaginálních chirurgických sítí, aby okamžitě zastavili jejich prodej a distribuci.[9]
Biokompatibilita

Implantace síťoviny bude přirozeně generovat zánětlivou reakci na vloženou síťovinu, ale biokompatibilita se pohybuje od toho, jak snadno se integruje, až po závažnou reakci cizího tělesa. Minimální odpověď zahrnuje tvorbu fibrózy kolem protézy (podobně jako při tvorbě jizev); tato reakce je generována s nejlepší formou biokompatibility. Fyzická odpověď spouští akutní zánětlivou reakci, která zahrnuje tvorbu obřích buněk a následně granulomů, což znamená, že tkáň „snáší“ síť docela dobře. A konečně, chemická odpověď umožňuje těžkou zánětlivou reakci během pokusu o integraci tkáňového pletiva, včetně proliferace fibroblastických buněk.[6] Cílem pro vytvoření chirurgické sítě je nakonec formulovat takové, které má minimum in vivo reakce s cílem maximalizovat pohodlí pacienta, vyhnout se infekci a zajistit čistou integraci do těla za účelem opravy tkáně.
Řada faktorů hraje roli v biokompatibilitě sítí. Pórovitost oka je poměr pórů k celkové ploše a hraje roli ve vývoji buď bakteriální infekce, nebo regenerace hladké tkáně v závislosti na velikosti pórů. Velikosti pórů pod 10 mikrometrů jsou náchylné k infekci, protože bakterie mohou vstoupit a množit se, zatímco makrofágy a neutrofily jsou příliš velké na to, aby se do nich vešlo a nemohou pomoci při jejich eliminaci. Při velikosti pórů přesahujících 75 mikrometrů jsou jako součást regenerace tkáně povoleny fibroblasty, krevní cévy a kolagenová vlákna. Ačkoli neexistuje obecná shoda ohledně nejlepší velikosti pórů, lze odvodit, že větší póry jsou lepší pro vývoj tkáně a integraci in vivo.[6]
S tímto vědomím je současným problémem různých sítí používaných při všech typech operací to, že nejsou dostatečně biokompatibilní. PP se osvědčil jako účinná síť pro úpravu prolapsovaných orgánů, ale může pacientovi způsobovat velké nepohodlí kvůli vysokému modulu pružnosti. To ztuhne protézu a vede k výraznější zánětlivé reakci, což komplikuje integraci do těla s růstem tkáně. Jak již bylo zmíněno, PET se snadno degraduje in vivo a tkáň se obtížně integruje s PTFE. Z těchto důvodů začínají vědci hledat různé typy chirurgických sítí, které by mohly být vhodné pro biologické prostředí a poskytovat lepší pohodlí při podpoře prolapsových orgánů.[5]
PVDF (nanovlákenné pletivo)
Jedním konkrétním typem síťoviny, která je předmětem studie, je polyvinylidenfluorid (PVDF) nebo nanovlákenná síť, u které bylo zjištěno, že je odolnější vůči hydrolýze a rozpadu, na rozdíl od PET, a nezvyšuje tuhost ve svém věku, na rozdíl od PP. Je testován jak na kýlu, tak na operaci pánevní / vaginální stěny a je vyráběn pomocí umístění vláken vrstvou po vrstvě, zatímco PP je konstruován procesem podobným tkaní. To dává nanovlákenné síti strukturu těžké váhy s nízkou pórovitostí a také přidává větší tuhost a práh napětí ve srovnání s PP. To je podpořeno založením HSP 70 - indikátoru buněčného stresu a ochránce tvorby buněk před poškozením, který je prospěšný pro protézu a tvorbu tkání - který byl sledován a pozorován ve větší přítomnosti v PVDF.[5] Pozorování nanovlákenného pletiva in vitro přinesla důkaz buněčné migrace a proliferace na množině pletiva. Úspěšný růst buněk byl zaznamenán u dlouhých fusiformních tvarů a jasných hranic.[11]
Významnou výhodou použití nanovlákenného pletiva je to, že může nést mnohem více kmenových buněk než tradiční PP pletivo, což by mohlo zlepšit buněčnou terapii metod prolapsu a regenerace pánevních orgánů. Další důležitou výhodou PVDF je tvorba kapilár po 12 týdnech, která je nezbytná pro hojení ran. Čím rychleji dojde k neovaskularizaci, tím rychlejší tkáň může být opravena a regenerována, což snižuje pravděpodobnost vystavení nebo vytlačování síťky.[11]
Některá vylepšení PVDF musí být také provedena před tím, než může být použit pro chirurgii u člověka. Ačkoli je modul pružnosti vyšší než modul PP, výsledné protažení při stejném napětí je mnohem menší, což by mohlo způsobit komplikace, jako je degenerace tkání a ztráta mechanické pevnosti. Nanovlákenné pletivo v současné době také podporuje větší reakci cizích těles a zánětlivou reakci, která je z důvodu biokompatibility síťky vadná.[11] Z těchto důvodů je PVDF stále zvažováno a experimentuje s tělesnými implantáty.
Snížení zánětlivé reakce pomocí MSC
Zánětlivé reakce na vložení síťky podporují tvorbu tkáně kolem síťových vláken a množení fibroblastů, polymorfonukleocytů a makrofágů, což vše pomáhá při integraci síťky. Neschopnost vyřešit zánětlivé reakce může vést k reakcím cizího tělesa a konečnému zapouzdření implantátu, což vylučuje jakýkoli funkční účel, kterému měl implantát sloužit. Je známo, že mezenchymální kmenové buňky (MSC) snižují zánětlivé reakce, které by v kombinaci s chirurgickým pletivem mohly bránit v nekontrolovatelnosti a příliš obtížném zkrotení. MSC v kombinaci s chirurgickými sítěmi mohou být použity jako „běžné výrobky“ a zvyšují polarizaci makrofágů v prostředí in vivo i in vitro. To může povzbudit protizánětlivou reakci a může regulovat zánětlivou reakci spojenou s implantací síťky.[12]
Antimikrobiální kýlová oka
Vedle eroze síťky, migrace síťky a enterokutenní píštěle zůstávají infekce související se sítí (SSI) významným zdravotním problémem.[13] Ročně se nakazí přibližně 60 000 oprav tříselné a ventrální kýly, přičemž podobný počet je i v Evropě.[13] CDC rozlišuje mezi povrchním SSI; které zahrnují pouze kůži a podkožní tkáň a hluboké SSI, když se infekce může usadit na implantátu, a vyžaduje tedy komplikovanější léčebné protokoly.[14]
Patogeneze za kontaminacemi souvisejícími se sítí je většinou způsobena pokožkou nebo sliznicí pacienta během primárního řezu a klinických postupů. Bylo zjištěno, že zavedení zdravotnických prostředků zvyšuje náchylnost k příjmu adherujících bakterií faktorem 10 000 až 100 000.[15] V případě operací kýly by byla v místě zavedení kontaminována jedna třetina až dvě třetiny implantované síťky, i když jen malý počet z nich způsobí infekci. Mnoho faktorů ovlivňuje pravděpodobnost vzniku infekce na síťovém materiálu, z nichž nejdůležitější je typ chirurgického zákroku a umístění.[16] Například šance na vznik infekce jsou 2% - 4% pro otevřenou tříselnou opravu, ale až 10% pro opravu incizní hernie.[17] Laparoskopie nese nejnižší míru infekce, která se obvykle pohybuje pod 1% a pouhých 0,1%.[17] Dalšími faktory, které ovlivňují šance na infekci, jsou křivka učení chirurga, protože u méně zkušeného chirurga může být vyžadováno delší provedení operace a tím prodloužení doby, kdy je řez vystaven. Dále lze typ síťoviny s velkým výběrem dnes dostupných protéz rozlišit na základě materiálu a složení, architektury vlákna, vstřebatelnosti a hmotnosti. Demografické údaje pacienta také ovlivňují pravděpodobnost výskytu infekce; mezi ně patří kouření, cukrovka, lidé se sníženou imunitou a obezita.
Prediktivní faktory pro časné a pozdní infekce v místě chirurgického zákroku se setkají se zánětem, horečkou, ohniskovou citlivostí, erytémem, otoky, hnisem, zarudnutím, teplem nebo bolestí.[18] To bude poté hodnoceno pomocí CT nebo MRI, následované aspirací tekutiny a kultivací. Druhy stafylokoků, konkrétněji S. aureus a S. epidermidis představuje přibližně 90% u vznikajících infekcí s převládající přítomností rezistence na methiculin S. aureus (MRSA).[19] Gramnegativní druhy, jako je Pseudomonas sp., Enterobacteriaceae se také běžně vyskytují. S vícedruhovými biofilmy se také běžně setkáváme. Pokud se infekce usadí na sítu, podávání antibiotik je obvykle neúčinné kvůli bariéře krevního síta a odstranění síťky bude vyžadováno u více než 40% hlubokého SSI.[20]
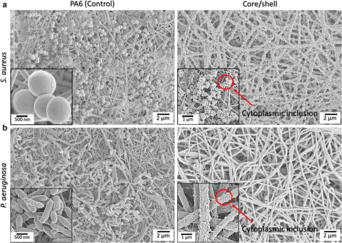
Z hlediska vědy o materiálu může síť hrát pasivní roli vůči antibakteriální ochraně prostřednictvím své architektury nebo aktivní roli kombinací terapeutik se složením sítě. Například bylo zjištěno, že monofilní pletiva jsou dvakrát méně pravděpodobné, že přilnou bakterie, než multifilamentová oka.[22] Jako systém pro podávání léků lze k podávání antibiotik použít kýlovou síťku,[23] antiseptika,[24] antimikrobiální látky,[21] antimikrobiální peptidy[25] nebo nanočástice.[26] K provedení integrace těchto látek lze použít různé techniky, včetně máčení / namáčení, fyzikálního nanášení, chemické funkcionalizace povrchu a elektrostatického zvlákňování.
FDA schválila antimikrobiální kýla
- MycroMesh a DualMesh Plus od společnosti GORE [27]
- Chirurgický štěp XenMatrix od BD [28]
- Patch Ventrio Hernia od společnosti BD [29]
Viz také
Reference
- ^ „Informace o chirurgickém pletivu pro prolaps pánevních orgánů a stresovou inkontinenci moči“. Bezpečnostní komunikace zdravotnických prostředků. Úřad pro kontrolu potravin a léčiv. 20. listopadu 2012. Citováno 2. března 2013.
- ^ Hjort, H .; Mathisen, T .; Alves, A .; Clermont, G .; Boutrand, J.P. (2012). „Tříleté výsledky preklinické implantační studie dlouhodobě vstřebatelné chirurgické sítě s časově závislými mechanickými vlastnostmi“. Kýla. 16 (2): 191–197. doi:10.1007 / s10029-011-0885-r. PMC 3895198. PMID 21972049.
Po 36 měsících byla testovací síť plně resorbována
- ^ "Vipro 2 oka". Průvodce produkty Ethicon. Ethicon. Citováno 2. března 2013.
- ^ Neumayer, Leigh; Giobbie-Hurder, Anita; Jonasson, Olga; Fitzgibbons, Robert Jr.; Dunlop, Dorothy; Gibbs, James; Reda, Domenic; Henderson, William (2004-04-29). "Otevřená síť versus laparoskopická oprava sítě tříselné kýly". New England Journal of Medicine. 350 (18): 1819–1827. doi:10.1056 / NEJMoa040093. ISSN 0028-4793. PMID 15107485.
- ^ A b C Brown, Bryan N .; Londono, Ricardo; Tottey, Stephen; Zhang, Li; Kukla, Kathryn A .; Vlk, Matthew T .; Daly, Kerry A .; Reing, Janet E .; Badylak, Stephen F. (01.03.2012). „Makrofágový fenotyp jako prediktor konstruktivní remodelace po implantaci biologicky odvozených chirurgických síťových materiálů“. Acta Biomaterialia. 8 (3): 978–987. doi:10.1016 / j.actbio.2011.11.031. PMC 4325370. PMID 22166681.
- ^ A b C d E F G Todros, S .; Pavan, P. G .; Natali, A. N. (2016-03-01). "Biomechanické vlastnosti syntetických chirurgických sítí pro opravu prolapsu pánve". Journal of the Mechanical Behavior of Biomedical Materials. 55: 271–285. doi:10.1016 / j.jmbbm.2015.10.024. PMID 26615384.
- ^ Azadi, Ali; Patnaik, Sourav S .; Jasinski, Jacek B .; Francis, Sean L .; Lei, Zhenmin; Liao, červen; Deveneau, Nicolette E .; Ostergard, Donald R. (květen 2015). „Morfologické hodnocení postimplantovaného monofilního polypropylenového oka s využitím nové techniky s kvantifikací skenovací elektronové mikroskopie“. Surgical Technology International. 26: 169–173. ISSN 1090-3941. PMID 26055006.
- ^ „Vláda souhlasí s dočasným zákazem vaginálních implantátů pro ženy s močovou inkontinencí“. Nezávislý. 2018-07-10. Citováno 2018-12-09.
- ^ A b „FDA objednává transvaginální chirurgickou síť z trhu“. Reuters. 16. dubna 2019. Citováno 17. dubna 2019.
- ^ Health, Centrum pro přístroje a radiologické. „Urogynekologické chirurgické síťové implantáty“. www.fda.gov. Citováno 2018-12-09.
- ^ A b C Ding, Jing; Deng, Mou; Song, Xiao-chen; Chen, Chun; Lai, Kui-lin; Wang, Guo-shuai; Yuan, Yu-yu; Xu, Tao; Zhu, Lan (01.08.2016). „Pro rekonstrukční chirurgii pánve lze použít nanovlákennou biomimetickou síť: randomizovaná studie“. Journal of the Mechanical Behavior of Biomedical Materials. 61: 26–35. doi:10.1016 / j.jmbbm.2016.01.003. PMID 26820994.
- ^ Blázquez, Rebeca; Sánchez-Margallo, Francisco Miguel; Álvarez, Verónica; Usón, Alejandra; Casado, Javier G. (2016-02-01). „Chirurgická oka potažená mezenchymálními kmenovými buňkami poskytují protizánětlivé prostředí polarizací makrofágů M2“. Acta Biomaterialia. 31: 221–230. doi:10.1016 / j.actbio.2015.11.057. PMID 26654766.
- ^ A b Guillaume, O .; Pérez-Tanoira, R .; Fortelny, R .; Redl, H .; Moriarty, T. F .; Richards, R. G .; Eglin, D .; Petter Puchner, A. (01.06.2018). „Infekce spojené s opravami síťek kýly břišní stěny: Jsou antimikrobiální biomateriály vytouženým řešením?“. Biomateriály. 167: 15–31. doi:10.1016 / j.biomaterials.2018.03.017. ISSN 0142-9612.
- ^ Centra pro kontrolu a prevenci nemocí. Návrh směrnice pro prevenci infekcí v místě chirurgického zákroku, 1998. 63 Fed Reg 167-33, 192 (17. června 1998).
- ^ Zimmerli, Werner (01.12.2006). „Infekce spojené s protetickými spoji“. Osvědčené postupy a výzkum Klinická revmatologie. Infekce a muskuloskeletální stavy. 20 (6): 1045–1063. doi:10.1016 / j.berh.2006.08.003. ISSN 1521-6942.
- ^ Langbach, zvláštní; Kristoffersen, Anne Karin; Abesha-Belay, Emnet; Enersen, Morten; Røkke, Ola; Olsen, Ingar (01.01.2016). „Orální, střevní a kožní bakterie v implantátech ventrální kýly“. Journal of Oral Microbiology. 8 (1): 31854. doi:10.3402 / jom.v8.31854. PMC 4967714. PMID 27476443.
- ^ A b Olsen, Margaret A .; Nikl, Katelin B .; Wallace, Anna E .; Doly, Daniel; Fraser, Victoria J .; Warren, David K. (březen 2015). „Stratifikace infekce chirurgickým zákrokem podle provozních faktorů a srovnání míry infekce po opravě kýly“. Kontrola infekce a nemocniční epidemiologie. 36 (3): 329–335. doi:10.1017 / led.2014.44. ISSN 0899-823X. PMC 4683022. PMID 25695175.
- ^ „Protokol o sledování chirurgických infekcí v místě“ (PDF).
- ^ Akyol, Cihangir; Kocaay, Firat; Orozakunov, Erkinbek; Genc, Volkan; Kepenekci Bayram, Ilknur; Cakmak, Atil; Baskan, Semih; Kuterdem, Ercument (2013). "Výsledek pacientů s chronickou infekcí oka po otevřené opravě tříselné kýly". Časopis Korejské chirurgické společnosti. 84 (5): 287. doi:10,4174 / jkss.2013.84.5.287. ISSN 2233-7903. PMC 3641368. PMID 23646314.
- ^ Erdas, E .; Medas, F .; Pisano, G .; Nicolosi, A .; Calò, P. G. (prosinec 2016). „Antibiotická profylaxe pro opravu otevřené kýly tříselné kýly: systematický přehled a metaanalýza“. Kýla. 20 (6): 765–776. doi:10.1007 / s10029-016-1536-0. ISSN 1265-4906.
- ^ A b Keirouz, Antonios; Radacsi, Norbert; Ren, Qun; Dommann, Alex; Beldi, Guido; Maniura-Weber, Katharina; Rossi, René M .; Fortunato, Giuseppino (2020-03-18). „Antimikrobiální nanovlákna z nylonu-6 / chitosanu / skořepiny pro prevenci infekce v místě chirurgického zákroku spojeného se sítí“. Journal of Nanobiotechnology. 18 (1): 51. doi:10.1186 / s12951-020-00602-9. ISSN 1477-3155. PMC 7081698. PMID 32188479.
- ^ Engelsman, A. F .; Mei, H. C. van der; Busscher, H. J .; Ploeg, R. J. (2008). „Morfologické aspekty chirurgických sítí jako rizikový faktor pro kolonizaci bakterií“. BJS (British Journal of Surgery). 95 (8): 1051–1059. doi:10,1002 / bjs.6154. ISSN 1365-2168.
- ^ Goëau-Brissonnière, O .; Leflon, V .; Letort, M .; Nicolas, M. H. (01.02.1999). „Odolnost polymerem vázaných na želatinu s antibiotiky vázaných na Staphylococcus aureus v modelu králičího podkožního pouzdra“. Biomateriály. 20 (3): 229–232. doi:10.1016 / S0142-9612 (98) 00164-1. ISSN 0142-9612.
- ^ „Minimálně invazivní technika záchrany oka při léčbě infekce kýly ze sítě: série případů“. Případové zprávy Mezinárodního žurnálu chirurgie. 70: 78–82. 2020-01-01. doi:10.1016 / j.ijscr.2020.04.055. ISSN 2210-2612. PMC 7226635. PMID 32413773.
- ^ Liu, Pengbi; Chen, Nanliang; Jiang, Jinhua; Wen, Xuejun (2019-05-23). "Příprava a in vitro hodnocení nového kompozitního oka funkcionalizovaného kationtovým antimikrobiálním peptidem". Materiály. 12 (10): 1676. doi:10,3390 / ma12101676. ISSN 1996-1944. PMC 6566986. PMID 31126063.
- ^ Grant, D. N .; Benson, J .; Cozad, M. J .; Whelove, O.E .; Bachman, S.L .; Ramshaw, B. J .; Grant, D. A .; Grant, S.A. (2011-12-01). „Konjugace nanočástic zlata na polypropylenovou síť pro lepší biokompatibilitu“. Journal of Materials Science: Materials in Medicine. 22 (12): 2803–2812. doi:10.1007 / s10856-011-4449-6. ISSN 1573-4838.
- ^ „MycroMesh a DualMesh Plus od společnosti GORE“.
- ^ „Xenmatric by BARD Davol“.
- ^ „Ventrio by BD“.
