Solvayův proces - Solvay process
The Solvayův proces nebo proces amoniak-soda je hlavní průmyslový proces výroby uhličitan sodný (uhličitan sodný, Na2CO3). Proces amoniak-soda vyvinul do moderní podoby belgický chemik Ernest Solvay během 60. let 19. století.[1] Ingredience pro to jsou snadno dostupné a levné: sůl solanka (z vnitrozemských zdrojů nebo z moře) a vápenec (z lomů). Celosvětová produkce uhličitanu sodného se v roce 2005 odhaduje na 42 milionů tun,[2] což je více než šest kilogramů (13 lb) ročně pro každou osobu na Zemi. Chemické závody na bázi Solvay nyní produkují zhruba tři čtvrtiny této zásoby a zbývající těží z přírodních ložisek. Tato metoda nahradila Leblancův proces.
Dějiny
Název „kalcinovaná soda“ je založen na hlavní historické metodě získávání alkálie, při které se voda extrahovala z popela určitých rostlin. Požáry dřeva přinesly potaš a její převládající složku Uhličitan draselný (K.2CO3), zatímco popel z těchto zvláštních rostlin poskytl „uhličitan sodný“ a jeho převládající složku uhličitan sodný (Na2CO3). Slovo „soda“ (ze střední latiny) původně odkazovalo na určité rostliny, které rostou v solných rozpustných látkách; bylo zjištěno, že popel těchto rostlin poskytl užitečný alkalický uhličitan sodný. Pěstování těchto rostlin dosáhlo zvláště vysokého stavu vývoje v 18. století ve Španělsku, kde jsou tyto rostliny pojmenovány barrilla; anglické slovo je „barilla ".[3][4][5] Popel z kelp také produkovat uhličitan sodný a byly základem obrovského průmyslu ve Skotsku z 18. století.[6] Alkali byla také těžena ze suchých jezer v Egyptě.
Na konci 18. století tyto zdroje nestačily k uspokojení rostoucí poptávky po zásadách pro mýdlový, textilní a sklářský průmysl v Evropě.[7] V roce 1791 francouzský lékař Nicolas Leblanc vyvinul způsob výroby uhličitanu sodného pomocí soli, vápenec, kyselina sírová, a uhlí. Ačkoliv Leblancův proces začaly ovládat produkci alkálií na počátku 19. století, náklady na její vstupy a její vedlejší produkty znečištění (včetně chlorovodík plyn) bylo zřejmé, že to není zdaleka ideální řešení.[7][8]
Uvádí se, že v roce 1811 francouzský fyzik Augustin Jean Fresnel objevili, že hydrogenuhličitan sodný se vysráží, když se probublává oxid uhličitý solnými roztoky obsahujícími amoniak - což je chemická reakce ústřední v procesu Solvay. Objev nebyl zveřejněn. Jak poznamenal Desmond Reilly: „Příběh vývoje procesu amonium-soda je zajímavým příkladem způsobu, jakým lze provést objev, který pak lze odložit a po značnou dobu poté neaplikovat.“[9] Vážné zvážení této reakce jako základu průmyslového procesu se datuje od britského patentu vydaného v roce 1834 H. G. Dyarovi a J. Hemmingovi. Bylo několik pokusů omezit tuto reakci na průmyslovou praxi s různým úspěchem.
V roce 1861 belgický průmyslový chemik Ernest Solvay obrátil svou pozornost k problému; zjevně do značné míry nevěděl o rozsáhlé dřívější práci.[8] Jeho řešení, 24 metrů (79 stop) absorpční věž plynu, ve které oxid uhličitý bublal nahoru sestupným proudem solanky. To se spolu s účinným získáváním a recyklací amoniaku osvědčilo. V roce 1864 Solvay a jeho bratr Alfred získali finanční podporu a postavili závod v Couillet, dnes předměstí belgického města Charleroi. Nový proces se ukázal jako ekonomičtější a méně znečišťující než metoda Leblanc a jeho použití se rozšířilo. V roce 1874 rozšířili Solvays svá zařízení o nový, větší závod v Nancy, Francie.
Ve stejném roce, Ludwig Mond navštívil belgický Solvay a získal práva k používání nové technologie. On a John Brunner tvořil firmu Brunner, Mond & Co. a postavil závod Solvay v Winnington, blízko Northwich, Cheshire, Anglie. Zařízení začalo fungovat v roce 1874. Mond přispěl k tomu, aby byl proces Solvay komerčně úspěšný. V letech 1873 až 1880 provedl několik vylepšení, která odstranila vedlejší produkty, které mohly proces zpomalit nebo zastavit.
V roce 1884 bratři Solvayové licencovali Američany Williama B. Cogswella a Rowlanda Hazarda na výrobu uhličitanu sodného v USA a založili společný podnik (Společnost Solvay Process Company ) postavit a provozovat závod v Solvay, New York.

V 90. letech 19. století vyráběly závody zpracovávající Solvay většinu světového uhličitanu sodného.
V roce 1938 velká ložiska nerostu trona byly objeveny poblíž Zelená řeka v Wyoming ze kterého lze uhličitan sodný získat levněji, než se vyrábí tímto postupem. S uzavřením původního závodu Solvay v New Yorku v roce 1986 nebyly v provozu žádné závody založené na Solvay Severní Amerika. Ve zbytku světa zůstává Solvayův proces hlavním zdrojem uhličitanu sodného.
Chemie
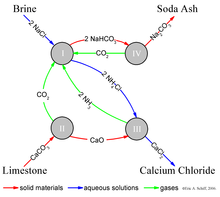

Výsledkem procesu Solvay je soda (převážně) uhličitan sodný (Na2CO3)) z solanka (jako zdroj chlorid sodný (NaCl)) az vápenec (jako zdroj uhličitan vápenatý (CaCO3)).[8] Celkový proces je:
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
Samotná implementace této globální, celkové reakce je složitá.[10][11][12] Zjednodušený popis lze podat pomocí čtyř různých chemických interakcí ilustrovaných na obrázku. V prvním kroku procesu oxid uhličitý (CO.)2) prochází koncentrovaným vodným roztokem chloridu sodného (kuchyňská sůl, NaCl) a amoniak (NH3).
- --- (I)
V průmyslové praxi se reakce provádí průchodem koncentrované solanky (slané vody) dvěma věžemi. V první amoniak probublává solným roztokem a je jím absorbován. Ve druhém probublává oxid uhličitý přes amoniakovanou solanku a hydrogenuhličitan sodný (soda bikarbóna) se vysráží z roztoku. Všimněte si, že v a základní řešení NaHCO3 je méně rozpustný ve vodě než chlorid sodný. Amoniak (NH3) Nárazníky řešení na základní (vysoké) pH; bez amoniaku, a kyselina chlorovodíková vedlejší produkt by poskytl řešení kyselé a zastavit srážky. Tady, NH4 spolu s amoniakálním solným roztokem působí jako „matečný louh“.
Potřebný amoniakální „katalyzátor“ pro reakci (I) je regenerován v pozdějším kroku a amoniak je spotřebován relativně málo. Oxid uhličitý potřebný pro reakci (I) se vyrábí zahříváním („kalcinace ") vápence při 950–1100 ° C a kalcinací hydrogenuhličitanu sodného (viz níže). Uhličitan vápenatý (CaCO3) ve vápenci se částečně převádí na nehasené vápno (oxid vápenatý (CaO)) a oxid uhličitý:
- --- (II)
Hydrogenuhličitan sodný (NaHCO3), který se vysráží v reakci (I), se odfiltruje z horkého chloridu amonného (NH4Cl) a roztok se poté nechá reagovat s nehasené vápno (oxid vápenatý (CaO)), který zbyl po zahřátí vápence v kroku (II).
- --- (III)
CaO vytváří silné základní řešení. Amoniak z reakce (III) se recykluje zpět do počátečního solankového roztoku reakce (I).
Hydrogenuhličitan sodný (NaHCO3) sraženina z reakce (I) se poté převede na konečný produkt, uhličitan sodný (promývací soda: Na2CO3) tím, že kalcinace (160–230 ° C), produkující vodu a oxid uhličitý jako vedlejší produkty:
- --- (IV)
Oxid uhličitý z kroku (IV) se izoluje pro opětovné použití v kroku (I). Pokud je zařízení Solvay správně navrženo a provozováno, dokáže získat zpět téměř veškerý svůj amoniak a ke kompenzaci ztrát spotřebuje jen malé množství dalšího amoniaku. Jediné hlavní vstupy do procesu Solvay jsou sůl, vápenec a Termální energie a jeho jediným hlavním vedlejším produktem je chlorid vápenatý, který se někdy prodává jako posypová sůl.
V modifikovaném procesu Solvay vyvinutém čínským chemikem Hou Debang ve třicátých letech je prvních pár kroků stejných jako u Solvayova procesu. Nicméně CaCl2 je nahrazen chlorid amonný (NH4Cl). Namísto ošetření zbývajícího roztoku vápnem se do roztoku čerpá oxid uhličitý a amoniak, potom se přidává chlorid sodný, dokud se roztok nenasycuje při 40 ° C. Poté se roztok ochladí na 10 ° C. Chlorid amonný se vysráží a odstraní se filtrací a roztok se recykluje, čímž se získá více uhličitanu sodného. Houův proces vylučuje produkci chloridu vápenatého. Vedlejší produkt chlorid amonný lze rafinovat, použít jako hnojivo a může mít vyšší komerční hodnotu než CaCl2, čímž se sníží rozsah skládek.
Další podrobnosti průmyslové implementace tohoto procesu jsou k dispozici ve zprávě připravené pro Evropskou asociaci producentů sodového popela.[11]
Vedlejší produkty a odpady
Hlavním vedlejším produktem procesu Solvay je chlorid vápenatý (CaCl2) ve vodném roztoku. Tento proces má i další odpad a vedlejší produkty.[11] Ne všechny vápence, které se kalcinují, se přemění na pálené vápno a oxid uhličitý (v reakci II); zbytkový uhličitan vápenatý a další složky vápence se stávají odpady. Kromě toho se solná solanka použitá v procesu obvykle čistí, aby se odstranily ionty hořčíku a vápníku, obvykle za vzniku uhličitanů; jinak by tyto nečistoty vedly k usazování vodního kamene v různých reakčních nádobách a věžích. Tyto uhličitany jsou další odpadní produkty.
Ve vnitrozemských rostlinách, jako například v Solvay, New York, vedlejší produkty byly uloženy do „odpadních lůžek“; hmotnost materiálu uloženého v těchto odpadních ložích překročila váhu vyrobené uhličitanu sodného asi o 50%. Tato odpadní lože vedla ke znečištění vody, zejména vápníkem a chloridy. Odpadní postele v Solvay v New Yorku podstatně zvýšily slanost v okolí Jezero Onondaga, která dříve patřila k nejvíce znečištěným jezerům v USA[13] a je superfond místo znečištění.[14] Jak takové odpadní postele stárnou, začínají podporovat rostlinná společenství, která byla předmětem několika vědeckých studií.[15][16]
Na přímořských místech, jako jsou ty v Saurashtra, Gudžarát, Indie,[17] CaCl2 Řešení může být vypouštěno přímo do moře, zjevně bez podstatného poškození životního prostředí, hlavním problémem je umístění vypouštění spadající do mořského národního parku v zálivu Kutch, který slouží jako stanoviště pro korálové útesy, mořské trávy a řasy. Na Osborne, Jižní Austrálie,[18] usazovací nádrž se nyní používá k odstranění 99% CaCl2 protože bývalý výboj zanášel přepravní kanál. Na Rosignano Solvay v italském Toskánsku změnil vápencový odpad z továrny Solvay krajinu a vytvořil „Spiagge Bianche“ („Bílé pláže“). Zpráva zveřejněná v roce 1999 programem OSN pro životní prostředí (UNEP) zařadila Spiagge Bianche mezi prioritní oblasti znečišťování priorit v pobřežních oblastech Středozemního moře[19].
Sekvestrace uhlíku a Solvayův proces
Byly navrženy variace v procesu Solvay sekvestrace uhlíku. Jednou z myšlenek je reagovat s oxidem uhličitým, který vzniká pravděpodobně spalováním uhlí, za vzniku pevných uhličitanů (například hydrogenuhličitanu sodného), které by mohly být trvale skladovány, čímž se zabrání emisím oxidu uhličitého do atmosféry.[20][21] Proces Solvay lze upravit tak, aby poskytoval celkovou reakci:
- 2 NaCl + CaCO3 + CO
2 + H
2Ó → 2NaHCO3 + CaCl2
Byly navrženy variace v Solvayově procesu k přeměně emisí oxidu uhličitého na uhličitany sodné, ale slibnější se jeví sekvestrace uhlíku uhličitanem vápenatým nebo hořečnatým.[pochybný ] Avšak množství oxidu uhličitého vyčerpaného lidstvem ve srovnání s množstvím, které lze použít pro sekvestraci uhlíku pomocí vápníku nebo hořčíku, je velmi nízké. Variace procesu Solvay navíc s největší pravděpodobností přidá další energetický krok, který zvýší emise oxidu uhličitého.
Viz také
Reference
- ^ Law, Jonathan Law Jonathan; Rennie, Richard Rennie Richard (2020-03-19), Law, Jonathan; Rennie, Richard (eds.), "Solvay proces", Slovník chemie, Oxford University Press, doi:10.1093 / acref / 9780198841227.001.0001, ISBN 978-0-19-884122-7, vyvoláno 2020-10-08
- ^ Kostick, Dennis (2006). "Soda Ash", kapitola v Ročenka minerálů 2005, Geologický průzkum Spojených států. Viz tabulka I.
- ^ Barilla používaná k výrobě uhličitanu sodného se vztahuje na kteroukoli z několika hustých rostlin, které jsou dobře přizpůsobeny k pěstování v močálech a které jsou běžné ve Španělsku a Itálii. Popel těchto rostlin může obsahovat až 30% uhličitanu sodného. Hlavními druhy pro výrobu uhličitanu sodného byly „slané třešně " Salsola soda nebo Salsola kali, ale mohlo by být použito i několik dalších druhů.
- ^ Pérez, Joaquín Fernández (1998). „Od barrilla po továrnu Solvay v Torrelavega: Výroba solené soli ve Španělsku,“ Antilia: The Spanish Journal of History of Natural Sciences and Technology, Sv. IV, čl. 1. ISSN 1136-2049. Archivovány WebCite z tuto původní adresu URL dne 01.03.2008.
- ^ Grieve, M. (1931). Moderní bylina, ISBN 0-486-22798-7 & 0486227995. Viz část na sklenice. Citováno 21. října 2005.
- ^ Hothersall, Susan (2012). „Skotský řasy a jeho archeologie“ (PDF). Historický Argyll: 32–36.
- ^ A b Kiefer, David M. „Bylo to všechno o zásadách“. Dnešní chemik v práci. 11 (1): 45–6. Archivovány od originálu 7. listopadu 2002.CS1 maint: unfit url (odkaz) Online verze archivována na WebCite od tuto původní adresu URL dne 12. 3. 2008.
- ^ A b C Kiefer, David M. (únor 2002). "Soda Ash, Solvay Style". Dnešní chemik v práci. 11 (2): 87–88, 90. Archivováno od originálu 20. ledna 2003.CS1 maint: unfit url (odkaz) Online verze archivována na WebCite od tuto původní adresu URL dne 12. 3. 2008.
- ^ Reilly, Desmond (prosinec 1951). „Soli, kyseliny a zásady v 19. století. Srovnání pokroků ve Francii, Anglii a Německu“. Isis. 42 (4): 287–296. doi:10.1086/349348. JSTOR 226807. PMID 14888349.
- ^ Speight, James (2001). Příručka o chemických procesech a konstrukci. McGraw Hill. doi:10.1036/0071374337. ISBN 978-0-07-137433-0.
- ^ A b C „Process Best Practices Reference Document (BREF) for Soda Ash,“ zpráva vypracovaná Evropská asociace producentů uhličitanu sodného, Březen 2004. Archivovány na WebCite od tuto původní adresu URL dne 01.03.2008.
- ^ Moore, John T. Edd (2005). Jednoduchá chemie. Broadway Books. str.190. ISBN 978-0-7679-1702-5.
- ^ Partnerství pro jezero Onondaga. Citováno 2006-10-14.
- ^ Americká agentura na ochranu životního prostředí, superfund ID NYD986913580. Citováno 2006-10-14.
- ^ Cohn, E.V.J .; Rostanski, A .; Tokarska-Guzik, B .; Trueman, I.C .; Wozniak, G. (2001). „Flóra a vegetace starého hrotu procesu Solvay v Jaworzně (Horní Slezsko, Polsko)“. Acta Soc. Bot. Pol. 70 (1): 47–60. doi:10,5586 / asbp.2001.008.
- ^ Michalenko, Edward M. (1991). „Pedogeneze a mikrokomunitní sukcese bezobratlých v nezralých půdách pocházejících z chlor-alkalických odpadů,“ disertační práce, State University of New York College of Environmental Science and Forestry.
- ^ „Technologie v indickém průmyslu soda“ Zpráva o stavu technologie č. 148 (říjen 1995), Oddělení vědeckého a průmyslového výzkumu, Ministerstvo vědy a technologie, Indie. Archivovány WebCite z tuto původní adresu URL dne 01.03.2008.
- ^ Penrice Soda Holdings Limited. Citováno 2006-10-14.
- ^ UNEP. Koordinační jednotka pro Středomořský akční plán Koordinovaný program pro monitorování a výzkum znečištění Středomoří, WHO (1999). „Identifikace prioritních znečišťujících oblastí a citlivých oblastí ve Středomoří“ (PDF). Série technických zpráv MAP (124). Citováno 11. září 2020.
- ^ Huijgen, W.J.J. and Comans, R.N.J. (Únor 2003). „Sekvestrace oxidu uhličitého pomocí uhličitanu minerálů: Literature Review,“ Zpráva ECN C-03-016,Centrum pro výzkum energie v Nizozemsku. Citováno 2006-10-14.
- ^ Lackner, Klaus S. (2002). "Uhličitanová chemie pro sekvestraci fosilního uhlíku". Výroční zpráva o energii a životním prostředí. 27 (1): 193–232. doi:10.1146 / annurev.energy.27.122001.083433.
Další čtení
- Moffat, Wicky; Walmsley, M. R. W. (2006). „Pochopení kinetiky kalcinace vápna pro snížení nákladů na energii“. Technické sdružení průmyslu papíru a celulózy v Jižní Africe. Minimální energie potřebná k kalcinaci vápence je přibližně 3,16 gigajoulů (3,00 milionů britských tepelných jednotek) na tunu.




