Polythiazyl - Polythiazyl
 | |
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména polythiazyl poly (nitrid síry) | |
| Identifikátory | |
| ChemSpider |
|
| Vlastnosti | |
| (SN)X | |
| Vzhled | bronzová barva, kovový lesk[1] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Polythiazyl (polymerní síra nitrid ), (SN)X, je elektricky vodivý, zlatý nebo bronzový polymer s kovový lesk. Bylo to první vodivé anorganický polymer objevil[1][2] a bylo také zjištěno, že je supravodič při velmi nízkých teplotách (pod 0,26 K).[3][4] Je to vláknitá pevná látka, popsaná jako „lesklá zlatá na tvářích a tmavě modročerná“, v závislosti na orientaci vzorku. Je stabilní na vzduchu a nerozpustný ve všech rozpouštědlech.[5]
Dějiny
Sloučenina byla poprvé uvedena již v roce 1910 F.P. Burta, který to získal zahřátím tetrasulfur tetranitrid ve vakuu nad stříbrnou vlnou.[6]
Sloučenina byla první nekovovou sloučeninou, ve které supravodivost lze prokázat. Nicméně, relativně nízká přechodová teplota při přibližně 0,3 K je praktická aplikace nepravděpodobná.[7][8]
Vlastnosti
Polythiazyl je kovově zlatý a lesklý, krystalický, ale vláknitý materiál.[8] Polymer je většinou inertní vůči kyslíku a vodě, ale na vzduchu se rozkládá na šedý prášek.[9][10] Při teplotách nad 240 ° C může dojít k explozivnímu rozkladu.[11] Sloučenina také exploduje při nárazu.[10]
Polythiazyl vykazuje anizotropní elektrickou vodivost. Podél vláken nebo SN řetězců je vazba elektricky vodivá, kolmá na ni působí jako izolátor. Jednorozměrná vodivost je založena na podmínkách vazby v řetězci S-N, kde každý atom síry poskytuje dva π elektrony a každý atom dusíku poskytuje jeden π elektron za vzniku dvou středových 3π elektronových vazebných jednotek.[8]
Ve sloučenině byly pozorovány dvě polymorfní krystalové formy. Monoklinická forma I získaná syntézou může být převedena na ortorombickou formu II mechanickým zpracováním, jako je mletí.[12]
Struktura a lepení
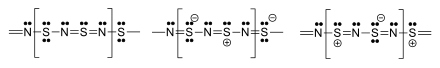
Materiál je polymer. Atomy S a N na sousedních řetězcích se vyrovnají.[2][13][14] Několik rezonanční struktury lze psát.[15]
Struktura krystalické sloučeniny byla vyřešena Rentgenová difrakce. To ukázalo střídavé délky vazeb SN 159 pm a 163 pm a SNS vazebné úhly 120 ° C a NSN vazebné úhly 106 ° C.[16][17][9][8]
Syntéza
Polythiazyl je syntetizován polymerizace dimeru dinitrid disulfur (S.2N2), který je zase syntetizován z cyklického střídání tetramer tetrasulfur tetranitrid (S.4N4).[2] Konverze z cyklického tetrameru na dimer je katalyzovaný s horkým stříbrný vlna.[2][1][18]
- S4N4 + 8 Ag → 4 Ag2S + 2 N.2
- S4N4 (w / Ag2S katalyzátor) → 2 S2N2 (w / 77K studený prst) → S2N2
- S2N2 (@ 0 ° C, sublimuje na povrch) → termická polymerace → (SN)X
Použití
Vzhledem ke své elektrické vodivosti se polythiazyl používá v LED diody, tranzistory, katody baterie, a solární články.[18]
Literatura
King, R.S.P .: Nová chemie a aplikace polythiazylu, Disertační práce Loughborough University 2009, pdf ke stažení
Reference
- ^ A b C Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. str. 725–727. ISBN 978-0-08-037941-8.
- ^ A b C d Goehring, Margot; Voigt, Dietrich (1953). "Über die Schwefelnitride (SN) 2 und (SN) x". Die Naturwissenschaften (v němčině). 40 (18): 482. doi:10.1007 / BF00628990. ISSN 0028-1042. S2CID 8181710.
- ^ Labes, M. M .; Láska, P .; Nichols, L.F. (1979). "Nitrid polysulfur - kovový, supravodivý polymer". Chemické recenze. 79 (1): 1–15. doi:10.1021 / cr60317a002.
- ^ Harry R. Allcock (20. září 2011). Úvod do chemie materiálů. John Wiley & Sons. p. 131. ISBN 978-1-118-21098-7. Citováno 29. června 2012.
- ^ A. G. MacDiarmid; C. M. Mikulsk; A. J. Heeger; A. F. Garito (1983). „Polymeric Sulphur Nitride (Polythiazyl), (SN) X“. Polymerní nitrid síry (Polythiazyl), (SN)X. Anorganické syntézy. 22. 143–149. doi:10.1002 / 9780470132531.ch31. ISBN 9780470132531.
- ^ Burt, Frank Playfair (1910). „XCIX. - nový sulfid dusíku“. J. Chem. Soc., Trans. 97: 1171–1174. doi:10.1039 / CT9109701171. ISSN 0368-1645.
- ^ Labes, M.M .; Láska, P .; Nichols, L.F .: Polysulfur nitrid - kovový, supravodivý polymer v Chem. Rev. 79 (1979) 1–15, doi:10.1021 / cr60317a002.
- ^ A b C d Alsfasser, R .; Janiak, C .; Klapötke, T. M.; Meyer, H.-J .: Moderne Anorganische Chemie, Herausgeber Riedel, E., 3. Auflage 2007, Walter de Gruyter GmbH & Co. KG, Berlín / Boston, ISBN 978-3-11-019060-1, S. 129–132, (abgerufen über De Gruyter Online).
- ^ A b MacDiarmid, A.G .; Mikulski, C.M .; Saran, M.S .; Russo, P.J .; Cohen, M. J.; Bright, A.A .; Garito, A.F .; Heeger, A.J .: Syntéza a vybrané vlastnosti polymerního nitridu síry, (Polythiazyl), (SN)X v Pokroky v chemii 150 (2009) 63–72, doi:10.1021 / ba-1976-0150.ch006.
- ^ A b Vstup na Schwefel-Stickstoff-Verbindungen. na: Römpp online. Georg Thieme Verlag, získaný 2. března 2017.
- ^ Wiberg, E.; Wiberg, N.; Holleman, A.F.: Anorganische Chemie, 103. Auflage, 2017 Walter de Gruyter GmbH & Co. KG, Berlín / Boston, ISBN 978-3-11-026932-1, S. 681, (abgerufen über De Gruyter Online).
- ^ Baughman, R.H .; Apgar, P.A .; Chance, R.R .; MacDiarmid, A.G .; Garito, A.F .: Nová fáze (SN)X v J. Chem. Soc. Chem. Comm. 1977, 49–50, doi:10.1039 / C39770000049.
- ^ Goehring, Margot (1956). "Nitrid síry a jeho deriváty". Čtvrtletní recenze, Chemická společnost. 10 (4): 437. doi:10.1039 / qr9561000437. ISSN 0009-2681.
- ^ Cohen, M. J.; Garito, A. F .; Heeger, A. J .; MacDiarmid, A. G .; Mikulski, C. M .; Saran, M. S .; Kleppinger, J. (1976). "Polymerace S v pevném stavu2N2 do (SN)X". Journal of the American Chemical Society. 98: 3844–3848. doi:10.1021 / ja00429a018.
- ^ Okada, M .; Tanaka, K .; Takata, A .; Yamabe, T. (1993). „Zkoumání elektronické fáze Hartree-Fockova řešení izolovaného polythiazylového řetězce“. Syntetické kovy. 59 (2): 223–230. doi:10.1016/0379-6779(93)91029-2.
- ^ Boudeulle, M .: v Cryst. Struct. Comm. 4 (1975) 9–13.
- ^ MacDiarmid, A.G .; Mikulski, C.M .; Russo, P.J .; Saran, M.S .; Garito, A.F .; Heeger, A.J .: Syntéza a struktura polymerního kovu (SN)Xa jeho předchůdce, S.2N2 v J. Chem. Soc. Chem. Comm. 1975, 476–477, doi:10.1039 / C39750000476.
- ^ A b Ronald D. Archer (26. února 2001). Anorganické a organokovové polymery. John Wiley & Sons. p. 213. ISBN 978-0-471-24187-4. Citováno 29. června 2012.