Komplex peridinin-chlorofyl-protein - Peridinin-chlorophyll-protein complex
| Vazebný protein peridinin-chlorofyl A. | |||||||||
|---|---|---|---|---|---|---|---|---|---|
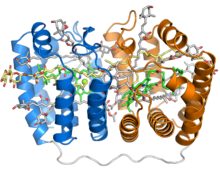 Krystalická struktura rozpustného komplexu peridinin-chlorofyl-protein z fotosyntetického dinoflagelátu Amphidinium carterae. Tento komplex se nachází v mnoha fotosyntetických dinoflagelátech a zahrnuje protein ve tvaru člunu nebo kolébky se dvěma pseudosymetrickými opakováními osmi alfa šroubovic (znázorněných modře a oranžově) obalených kolem centrální dutiny vyplněné pigmentem. Každý segment s osmi šroubovicemi váže jednu molekulu chlorofylu (zelená, s centrálním iontem hořčíku zobrazeným jako zelená koule), jednu molekulu diacylglycerolu (žlutá) a čtyři molekuly peridininu (šedá).[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | PCP | ||||||||
| Pfam | PF02429 | ||||||||
| InterPro | IPR003376 | ||||||||
| SCOP2 | 1ppr / Rozsah / SUPFAM | ||||||||
| |||||||||
The komplex peridinin-chlorofyl-protein (PCP nebo PerCP) je rozpustný molekulární komplex skládající se z a-protein peridinin-chlorofyl vázán peridinin, chlorofyl, a lipidy. Molekuly peridininu absorbují světlo v modrozelených vlnových délkách (470 až 550 nm) a přenášejí energii na molekuly chlorofylu s extrémně vysokou účinností.[1] PCP komplexy se nacházejí v mnoha fotosyntetický dinoflageláty, ve kterém mohou být primární světelné komplexy.[2]
Struktura

Protein PCP byl identifikován v dinoflagelátu genomy alespoň ve dvou formách, homodimerní forma složená ze dvou 15-kD monomery a monomerní forma přibližně 32 kD, o které se předpokládá, že se vyvinula z homodimerní formy prostřednictvím genová duplikace. Monomerní forma se skládá ze dvou pseudosymetrických osmispirála domény, ve kterých jsou šroubovice zabaleny ve složité topologii připomínající topologii beta listy v skládací želé.[1] Trojrozměrné uspořádání šroubovic tvoří molekulu ve tvaru člunu s velkou centrální dutinou, ve které jsou vázány pigmenty a lipidy. Každý segment s osmi šroubovicemi obvykle váže čtyři peridinin molekuly, jedna chlorofyl a molekula a jedna lipid molekula, jako je digalaktosyl diacyl glycerol; nicméně toto stechiometrie se liší mezi druhy a mezi PCP izoformy.[3][2] Nejběžnější poměr peridinin: chlorofyl 4: 1 byl předpovězen spektroskopie v 70. letech[4] ale byla nepotvrzena až do Krystalická struktura z Amphidinium carterae PCP komplex byl vyřešen v 90. letech.[1] Ať už je vytvořen z proteinového monomeru nebo dimeru, sestavený komplex protein-pigment je někdy známý jako bPCP (pro "stavební blok") a je minimální stabilní jednotkou.[3] Alespoň v některých formách PCP, včetně formulářů z A. carteraese tyto stavební bloky sestavují do trimeru považovaného za biologicky funkční stav.[1]
Když Rentgenová krystalografie struktura PCP byla řešena v roce 1997, představovala román proteinový záhyb a jeho topologie zůstává mezi známými proteiny jedinečná. Na strukturu odkazuje CATH databáze, který systematicky klasifikuje proteinové struktury jako záhyb „alfa solenoidu“; nicméně, jinde v literatuře termín alfa solenoid se používá pro otevřené a méně kompaktní spirálové proteinové struktury.[5]
Funkce

Fotosyntetický dinoflageláty obsahovat membrána -vázaný světelné komplexy podobné těm, které najdete v zelené rostliny. Dále obsahují ve vodě rozpustné komplexy protein-pigment, které se využívají karotenoidy jako peridinin rozšířit jejich fotosyntetickou kapacitu. Peridinin absorbuje světlo v modrozelených vlnových délkách (470 až 550 nm), které jsou samotné chlorofylu nepřístupné; místo toho komplex PCP využívá geometrii relativních orientací pigmentu k uskutečnění extrémně vysoce účinného přenosu energie z molekul peridininu do sousedních molekul chlorofylu.[3][2] PCP sloužil jako společný modelový systém pro spektroskopie a pro teoretické výpočty týkající se fotofyziky proteinu.[6]
Předpokládá se, že komplexy PCP zabírají tylakoidní lumen. Po přenosu energie z peridininu na chlorofylový pigment se předpokládá, že komplexy PCP poté přenášejí energii z excitovaného chlorofylu na membránově vázaný světelné komplexy.[3]
Reference
- ^ A b C d E F Hofmann E, klíč PM, Sharples FP, Hiller RG, Welte W, Diederichs K (červen 1996). „Strukturní základ sběru světla karotenoidy: peridinin-chlorofyl-protein z Amphidinium carterae“. Věda. 272 (5269): 1788–91. doi:10.1126 / science.272.5269.1788. PMID 8650577.
- ^ A b C Jiang J, Zhang H, Kang Y, Bina D, Lo CS, Blankenship RE (červenec 2012). "Charakterizace komplexu peridinin-chlorofyl a-protein v dinoflagelátu Symbiodinium". Biochimica et Biophysica Acta (BBA) - bioenergetika. 1817 (7): 983–9. doi:10.1016 / j.bbabio.2012.03.027. PMC 3947849. PMID 22497797.
- ^ A b C d Schulte T, Johanning S, Hofmann E (prosinec 2010). "Struktura a funkce nativních a refoldovaných peridinin-chlorofylových proteinů z dinoflagelátů". European Journal of Cell Biology. 89 (12): 990–7. doi:10.1016 / j.ejcb.2010.08.004. PMID 20846743.
- ^ Song, Pill-Soon; Koka, Prasad; Prezelin, Barbara B .; Haxo, Francis T. (říjen 1976). „Molekulární topologie fotosyntetického pigmentového komplexu pro sběr světla, peridinin-chlorofyl-a-protein, z mořských dinoflagelátů“. Biochemie. 15 (20): 4422–4427. doi:10.1021 / bi00665a012. PMID 987799.
- ^ Field MC, Sali A, Rout MP (červen 2011). „Evolution: On a bender - BARs, ESCRTs, COPs, and konečne getting your coat“. The Journal of Cell Biology. 193 (6): 963–72. doi:10.1083 / jcb.201102042. PMC 3115789. PMID 21670211.
- ^ Carbonera D, Di Valentin M, Spezia R, Mezzetti A (2014). „Jedinečné fotofyzikální vlastnosti Peridinin-Chlorofyl-α-Proteinu“. Současná věda o proteinech a peptidech. 15 (4): 332–50. doi:10.2174/1389203715666140327111139. PMC 4030626. PMID 24678668.
