Perfluorobutansulfonylfluorid - Perfluorobutanesulfonyl fluoride - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC 1,1,2,2,3,3,4,4,4-nonafluorbutan-l-sulfonylfluorid | |
| Identifikátory | |
3D model (JSmol ) | |
| Zkratky | NfF |
| ChemSpider | |
| Informační karta ECHA | 100.006.175 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4F10Ó2S | |
| Molární hmotnost | 302,09 g / mol |
| Hustota | 1,682 g / ml[1] |
| Bod tání | <-120 ° C (-184 ° F; 153 K) |
| Bod varu | 65 až 66 ° C (149 až 151 ° F; 338 až 339 K)[2] |
| Související sloučeniny | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Perfluorobutansulfonylfluorid (nonafluorbutansulfonylfluorid, NfF) je bezbarvá těkavá kapalina, která je nemísitelná s vodou, ale rozpustná v běžných organických rozpouštědlech. Připravuje se elektrochemickou fluorací sulfolan. NfF slouží jako vstupní bod pro nonafluorbutansulfonáty (nonaflates ), které jsou cenné jako elektrofily v palladium katalyzovaný křížová spojka reakce. Jako perfluoralkylsulfonylační činidlo nabízí NfF výhody nižší ceny a větší stability oproti častěji používaným anhydrid kyseliny triflické. The fluorid odstupující skupina je snadno substituována nukleofily, jako je aminy, fenoxidy, a enoláty, čímž se získají sulfonamidy, aryl-nonafláty a alkenyl-nonafláty. Není však napaden vodou (ve které je stabilní při pH <12). Hydrolýza hydroxid barnatý dává Ba (ONf)2, který po léčbě kyselina sírová dává kyselina perfluorbutansulfonová a nerozpustný síran barnatý.
Čištění

Komerčně dostupný NfF je kontaminován 6-10 mol% perfluorosulfolanem získaným z jeho výroby. To se snadno odstraní intenzivním mícháním komerčního materiálu s koncentrovaným vodným roztokem K.3PO4 a K.2HPO4 v molárním poměru 1: 1 po dobu 96 hodin. Toto zpracování, následované odstraněním vodné vrstvy a destilací z P2Ó5, dává produkt, který obsahuje> 99 mol% NfF s téměř kvantitativní výtěžností.[3]
Syntéza aryl a alkenyl nonaflátů
Jak bylo uvedeno výše, aryl a alkenyl nonafláty jsou užitečné jako elektrofily v palladiem katalyzovaných křížových vazebných reakcích. Jejich reaktivita obecně odráží reaktivitu častěji se vyskytujících triflátových elektrofilů, ale nonafláty bývají méně náchylné k hydrolýze na ketony (v případě alkenylsulfonátů) a fenoly (v případě arylsulfonátů). Jejich odolnost vůči hydrolýze činí nonafláty vynikajícími elektrofily v Buchwald-Hartwigových spojkách, kde tato vedlejší reakce může být škodlivá pro výtěžky požadovaného produktu.[4]
Sodné enoláty β-ketoesterů reagují s 1,15 ekvivalenty NfF za vzniku odpovídajících alkenyl nonaflátů ve vysokém výtěžku. Ethyl 2-methylacetoacetát (R = R '= Me) poskytuje touto metodou geometricky čistý E isomer.[5]
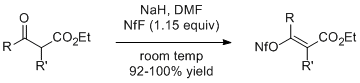
Jednoduché aldehydy a ketony reagují s NfF v přítomnosti bází, jako je DBU nebo fosfazeny, za vzniku alkenyl nonaflátů ve vysokých výtěžcích bez tvorby diskrétního enolátu. Použití P2 fosfazenová báze při -30 až -20 ° C poskytuje méně substituovaný alkenyl nonaflát s nesymetricky substituovanými ketony.[3] Podobné reakce s anhydridem kyseliny trifliové obecně vyžadují použití drahého 2,6-di-tert-butylpyridin k dosažení vysokých výtěžků.
Reakce enolátů s NfF silně závisí jak na struktuře enolátu, tak na jeho kovovém protiiontu. Lithiové enoláty methylketonů poskytují směsi produktů odvozených z elektrofilního napadení O (očekávaných) nebo C (neočekávaných) atomů enolátu. Tento účinek je zvláště patrný u lithium enolátu pinakolonu, který poskytuje směs 2: 1 upřednostňující C-útok. Více substituovaných lithných enolátů poskytuje pouze produkty O sulfonylace v různých výtěžcích.[6]
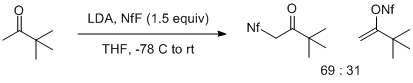
Trimethylsilyl-enolethery reagují s NfF v přítomnosti substechiometrického zdroje fluoridu při teplotě 0 ° C až teplotě okolí za vzniku alkenyl nonaflátů ve středních až dobrých výtěžcích. Sušené Bu4F byl v jedné studii preferovaným zdrojem fluoridů,[6] ale CsF byl použit v obtížných případech s vynikajícími výsledky.[7]

Aryl nonafláty lze připravit přímo z fenolů a NfF v přítomnosti bází, jako jsou Uhličitan draselný[8] a Et3N[4] v téměř kvantitativních výnosech. Silnější základy jako např NaH a BuLi[9] lze také použít, ale mají tendenci poskytovat o něco nižší výnosy.
Reakce s alkoholy
Reakce NfF s alkoholy zdůrazňuje labilitu alkyl nonaflátů - ve většině případů je konečným produktem reakce buď alkylfluorid (z F− útok na meziprodukt alkyl nonaflát) nebo olefin (z eliminace NfOH z meziproduktu nonaflát).
Syntéza bis-nonafluorbutansulfonimid (Nf2NH)
NfF reaguje s chlorid amonný v přítomnosti triethylaminu v acetonitrilu za vzniku triethylamoniové soli superkyseliny bis-nonafluorbutansulfonimid v 97% výtěžku. Odpovídající draselná sůl se získá zpracováním a methanolový roztok triethylamoniové soli s KOH.[10] Kyselina se získá iontoměničovou chromatografií triethylamoniové soli s Amberlite IR-100 jako stacionární fází a methanolem jako eluentem.[11] Skutečný druh produkovaný v druhém postupu je pravděpodobně MeOH2+ Nf2N−.
Reference
- ^ „Perfluor-1 -butansulfonylfluorid“. Citováno 22. července 2012.
- ^ „1,1,2,2,3,3,4,4,4-nonafluorbutan-1-sulfonylfluorid“. Národní institut pro standardy a technologie. Citováno 22. července 2012.
- ^ A b Vogel, Michael A. K .; Christian B. W. Stark; Ilya M. Lyapkalo (2007). „Přímá syntéza alkenyl nonaflátů z karbonylových sloučenin za použití nonafluorbutan-1-sulfonylfluoridu v kombinaci s fosfazenovými bázemi“. Synlett. 2007 (EFirst): 2907–2911. doi:10.1055 / s-2007-991084. ISSN 0936-5214.
- ^ A b Meadows, Rebecca E .; Simon Woodward (11.02.2008). „Sterické účinky při aminaci aryl triflátů a nonaflátů katalyzovaných palladiem s primárními aminy PhCH (R) NH2 (R = H, Me)“. Čtyřstěn. 64 (7): 1218–1224. doi:10.1016 / j.tet.2007.11.074. ISSN 0040-4020.
- ^ Bellina, Fabio; Donatella Ciucci; Renzo Rossi; Piergiorgio Vergamini (12. 2. 1999). „Syntéza vinylových nonaflátů odvozených od β-ketoesterů, β-diketonů nebo α-diketonů a jejich křížově vazebných reakcí katalyzovaných palladiem s halogenidy organozinku.“. Čtyřstěn. 55 (7): 2103–2112. doi:10.1016 / S0040-4020 (98) 01221-6. ISSN 0040-4020.
- ^ A b Lyapkalo, Ilya M .; Matthias Webel; Hans-Ulrich Reißig (2002). „Účelná a stereoselektivní syntéza alkenyl-nonaflátů od silyl-etherů: optimalizace, rozsah a omezení“. European Journal of Organic Chemistry. 2002 (6): 1015–1025. doi:10.1002 / 1099-0690 (200203) 2002: 6 <1015 :: AID-EJOC1015> 3.0.CO; 2-K. ISSN 1099-0690.
- ^ Bräse, Stefan (1999). “Syntéza Bis (enolnonaflates) and their 4-exo-trig-Cyclizations by Intramolecular Heck Reactions”. Synlett. 1999 (10): 1654–1656. doi:10,1055 / s-1999-2892. ISSN 0936-5214.
- ^ Shekhar, Shashank; Travis B. Dunn; Brian J. Kotecki; Donna K. Montavon; Steven C. Cullen (2011). "Obecná metoda pro palladiem katalyzované reakce primárních sulfonamidů s aryl nonafláty". J. Org. Chem. 76 (11): 4552–4563. doi:10.1021 / jo200443u. ISSN 0022-3263.
- ^ Uemura, Minoru; Hideki Yorimitsu; Koichiro Oshima (2008-02-18). „Cp ∗ Li jako báze: aplikace na křížovou kopulační reakci katalyzovanou palladiem aryl-X nebo alkenyl-X (X = I, Br, OTf, ONf) s koncovými acetyleny“. Čtyřstěn. 64 (8): 1829–1833. doi:10.1016 / j.tet.2007.11.095. hdl:2433/88969. ISSN 0040-4020.
- ^ Quek, Ser Kiang; Ilya M. Lyapkalo; Han Vinh Huynh (2006-03-27). "Syntéza a vlastnosti N, N'-dialkylimidazolium bis (nonafluorbutan-1-sulfonyl) imidů: nová podrodina iontových kapalin". Čtyřstěn. 62 (13): 3137–3145. doi:10.1016 / j.tet.2006.01.015. ISSN 0040-4020.
- ^ Hashmi, A. Stephen K .; Tobias Hengst; Christian Lothschütz; Frank Rominger (2010). „Nové a snadno přístupné dusíkaté acyklické karbeny zlata (I): Struktura a aplikace při syntéze fenolem katalyzované zlatem i při hydrataci alkany“. Pokročilá syntéza a katalýza. 352 (8): 1315–1337. doi:10.1002 / adsc.201000126. ISSN 1615-4169.
