Komplex nakládání peptidů - Peptide loading complex - Wikipedia
Tento článek má několik problémů. Prosím pomozte vylepši to nebo diskutovat o těchto problémech na internetu diskusní stránka. (Zjistěte, jak a kdy tyto zprávy ze šablony odebrat) (Zjistěte, jak a kdy odstranit tuto zprávu šablony)
|

The komplex s obsahem peptidů (PLC)[1] je krátkodobá multisubunit membránový protein komplex, který se nachází v endoplazmatické retikulum (ER). Řídí to peptid přemístění a výběr podle hlavní histokompatibilní komplex třídy I (MHC-I) molekuly. Stabilní komplexy peptid-MHC I se uvolňují na buněčný povrch za účelem podpory T-buňka reakce proti maligním nebo infikovaným buňkám. Na druhé straně T-buňky rozpoznávají aktivované peptidy, které by mohly být imunogenní nebo neimunogenní.
Přehled
Sestava PLC se skládá ze sedmi podjednotek, včetně transportérů spojených s zpracování antigenu (TAP1 a TAP2 - společně označované jako TAP), oxidoreduktáza ERp57, heterodimer MHC-I a chaperony tapasin a kalretikulin. TAP transportuje produkty proteazomálního rozkladu z cytosol do lumen ER, kde jsou naneseny na molekuly MHC-I. Komplexy peptid-MHC-I se poté pohybují sekreční cestou na buněčný povrch a prezentují svou antigenní zátěž cytotoxickým T-buňkám.
Obecně jsou předběžné těžké řetězce MHC-I chaperonovány systémem kalnexin-kalretikulin v ER. Spolu s β2-mikroglobulinem (β2m) tvoří těžké řetězce MHC-I sestavy heterodimerů, které působí jako receptory pro antigenní peptidy. Prázdné heterodimery MHC-I jsou získávány kalretikulinem a vytvářejí makromolekulární PLC s krátkou životností, kde chaperon tapasin dále zajišťuje stabilizaci v molekulách MHC-I. Dále se tvoří ERp57 a tapasin disulfid vázané konjugáty a tapasin jsou zásadní pro udržení strukturální stability PLC a pro usnadnění optimálního dávkování peptidů. Po závěrečné kontrole kvality, během níž heterodimery MHC-I procházejí editací peptidů, se na povrch buněk uvolňují stabilní komplexy peptid-MHC-I pro rozpoznání T-buněk. PLC může obsluhovat širokou škálu MHC-I alomorfy, čímž hraje ústřední roli při diferenciaci a aktivaci T lymfocytů a při kontrole virových infekcí a vývoje nádoru.
Struktura
Tato sekce potřebuje další citace pro ověření. (Července 2019) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
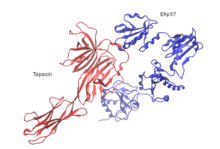
Doposud byla pomocí jedné částice objasněna pouze struktura lidského PLC elektronová kryomikroskopie (kryo-EM). Strukturální organizace se skládá z tapasinu, kalretikulinu, ERp57 a MHC-I molekul, které jsou soustředěny kolem TAP, nesoucí pseudosymetrickou orientaci. Velikost PLC je 150 Å na 150 Å s celkovou výškou 240 Å přes membránu ER. Dvě protichůdné molekuly tapasinu formují centrální doménu v PLC. V tomto modelu je zbytek E225 N-koncové domény podobné imunoglobulinu jedné molekuly a R60, který je umístěn v krátkém helikálním motivu sedmřetězcového N-koncového β-barelu druhé molekuly, ve vzdálenosti solného můstku . Tyto zbytky jsou mezi čelistmi obratlovců konzervovány, ale u ptačích PLC chybí. To je v souladu s existencí jediné kopie tapasinu ve ptačí PLC a absencí N-terminální transmembránové domény (TMD0) ve ptačí TAP1. ER-luminální domény protichůdných molekul tapasinu jsou nakloněny o 30 ° směrem k sobě, čímž jsou umístěny dva vstupní body membrány transmembránový šroubovice 60 Å od sebe. Výsledný zkroucení domény vylučuje vazbu kalretikulinu nebo kalnexin do glykan dimerního tapasinového lešení a vysvětluje, proč se do PLC může montovat pouze zralý tapasin. Další strukturální rys spočívá v tom, že ERp57 je ve své typické konformaci ve tvaru písmene U komplexován s tapasinem prostřednictvím katalyticky aktivních domén a a ′. Neočekávaná orientace tapasinu umožňuje C-koncové prodloužení a 'domény trans ERp57 interagovat s C-koncovou imunoglobulinovou doménou cis tapasinu, což potenciálně zvyšuje stabilitu PLC.
Tato kryo-EM struktura odhaluje vysoký stupeň plasticity N-terminálního sendviče tří β listů tapasinu a ukazuje, že flexibilní upevnění MHC-I je nezbytné pro to, aby tapasin mohl vykonávat svou korekturu. Kalretikulin je zásadní a je vysoce závislý na sestavení a zrání MHC-I v PLC. Globulární lektinová doména kalretikulinu obsahuje místo vázající glykan, které snímá monoglukózové skupiny N-jádra glykosylovaný MHC-I předtím, než se spojí s tapasinem. Monoglukosylovaná větev glykanu N-jádra, který vychází z N86 MHC-I, se váže na povrch vázající glykan kalretikulinu, zatímco jiná větev manózy pravděpodobně leží blízko zbytků na okraji p-sendviče lektinu. V souladu s navrhovanou aktivitou snímání lipidů závislou na vápníku směřuje C-koncový kyselý ocas kalretikulinu k letáku ER-luminální membrány, kde je umístěn v blízkosti C-terminální domény tapasinu podobné imunoglobulinu. V kryo-EM struktuře je kladen důraz na ústřední roli C-terminální imunoglobulinové domény tapasinu, která působí jako základní multivalentní interakční jádro pro zbývající podjednotky PLC. Centrální dutina, která spojuje výstup peptidové translokační dráhy TAP s lumenem ER prostřednictvím dvou bočních okének, může sloužit jako molekulární koš pro transportované peptidy, než jsou upraveny aminopeptidázami rezidentními v ER.
TAP
TAP je heterodimerní komplex, který se skládá z členů TAP1 (ABCB2) a TAP2 (ABCB3) nadrodiny ABC transportérů. Společným rysem všech transportérů ABC je jejich organizace: 1) do dvou transmembránových domén (TMD) a 2) do dvou nukleotid -vázací domény (NBD). Obě intramolekulární domény jsou navzájem spojeny a kdy ATP vazba probíhá, konformační změny v TMD umožňují proteazomálním rozkladným produktům pohyb přes membránu. TAP rozpoznává a transportuje antigenní peptidy produkované v cytosolu přímo do ER, zatímco tapasin rozpoznává druh peptidů, které mají schopnost tvořit stabilní komplexy s MHC-I. Tento proces je známý jako korektury nebo úpravy peptidů. Peptidy vybrané korekturou[2] zlepšit stabilitu MHC-I; tapasin také přispívá k úpravě imunogenních peptidových epitopů. Avšak až v poslední době bylo biochemickými, biofyzikálními a strukturálními studiemi prokázáno, že klíčovou funkcí adaptivní imunity je katalytické mechanismus korektury peptidů se provádí pomocí tapasinu a TAPBPR (TAP-binding protein related, tapasin homologue).[3]
Tapasin
Cresswell a spolupracovníci poprvé objevili tapasin (TAP-asociovaný glykoprotein) jako 48 kDa protein v komplexech izolovaných s TAP1 protilátkami z digitoninových lyzátů lidských B lymfoblastoidních buněk.[4] Tapasin váže HC / β2m spolu s chaperony ER na peptidový transportér.[5] Je umístěn v ER a jeho funkce zahrnuje držet pohromadě molekuly třídy I společně s chaperonovým kalretikulinem a ERp57 na TAP. Studie buněčné linie s nedostatkem tapasinu a od myší nesoucích narušený gen pro tapasin, krátkotrvající komplex molekul I. třídy.[je zapotřebí objasnění ]
Tapasin a TAP jsou velmi důležité pro stabilizaci molekul třídy I a také pro optimalizaci peptidu prezentovaného cytotoxickým T buňkám.[6] Na PLC nezávislý tapasinový homologní protein s názvem TAPBPR[3] Bylo zjištěno, že má schopnost působit jako druhý MHC-I specifický korektor peptidu nebo editor, ale nemá transmembránovou doménu.[7] Tapasin a TAPBPR[3] sdílet podobná vazebná rozhraní na MHC-I, jak je znázorněno na Struktura rentgenového záření TAPBPR s MHC-I (těžký řetězec a β2 mikroglobulin). Použití fotoštěpitelného vysoce afinitního peptidu umožnilo vědcům vytvořit stabilní (vázané) molekuly MHC-I a poté vytvořit stabilní TAPBPR[3] a komplex MHC-I se štěpením fotoindukovaným peptidem UV zářením.
ERp57
ERp57 je enzym z thiol oxidoreduktáza rodina umístěná v ER.[8] Je připojen k substrátům nepřímým způsobem prostřednictvím asociace s molekulárním chaperonovým kalretikulinem komplexu s peptidovým zatížením,[9][10] V raných stádiích vytváření molekul MHC-I je ERp57 spojen s volnými těžkými řetězci MHC-I. Výsledkem je, že jeho funkce je určena tvorbou disulfidových vazeb v těžkých řetězcích, oxidačním skládáním těžkého řetězce a nakonec skutečností, že ERp57 zavádí peptidy na molekuly MHC-I.
MHC-I
Předběžné těžké řetězce MHC-I tvoří chaperony pomocí komplexu kalnexin-kalretikulin v ER. Kromě toho je β2-mikroglobulin (β2m) připojen k těžkým řetězcům heterodimerů a jako celek působí jako receptory pro antigenní peptidy. Když jsou řetězce MHC-I prázdné, jsou přijímány kalretikulinem a tvoří přechodný PLC.
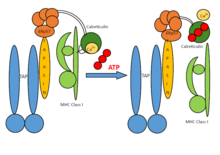
Tapasin pravidelně hraje roli při stabilizaci MHC-I. Teprve po zavedení heterodimerů MHC-I pro korektury nebo úpravy peptidů se uvolní stabilní komplexy pMHC-I (peptid-MHC-I) na povrch buňky za účelem rozpoznání a zničení virem infikovaných nebo maligně. neoplastický buňky. Obecně platí, že každý jednotlivý organismus vlastní sbírku šesti molekul MHC-I (tři od každého rodiče). Tak v autoimunitní v naléhavých případech jsou kompatibilními dárci příbuzní, kteří vlastní podobnou sbírku molekul MHC-I, kromě těch příjemců.[Citace je zapotřebí ]
Kalretikulin
Kalretikulin - zejména jeho lektinem podobná doména - interaguje s MHC-I. P doména směřuje k vazebnému místu pro peptid MHC-I směrem k ERp57. Tato orientace umožňuje tapasinu připojit a zajistit MHC-I. Tato translokace TAP usnadňuje její otevření do luminální dutiny ER, ohraničené standardními vstupními body membrány, jako jsou ty pro tapasin a MHC-I. Tyto dva vstupní body usnadňují nábor MHC-I s optimálním zavedením peptidů a případným uvolněním MHC-I v povrchech T-buněk pro rozpoznání.[Citace je zapotřebí ]
Reference
- ^ Blees A, Januliene D, Hofmann T, Koller N, Schmidt C, Trowitzsch S, Moeller A, Tampé R (listopad 2017). "Struktura komplexu lidského MHC-I peptidu s obsahem". Příroda. 551 (7681): 525–528. Bibcode:2017Natur.551..525B. doi:10.1038 / příroda24627. PMID 29107940. S2CID 4447406.
- ^ Thomas C, Tampé R (2017). „Korektury komplexů peptid-MHC prostřednictvím dynamických multivalentních interakcí“. Hranice v imunologii. 8: 65. doi:10.3389 / fimmu.2017.00065. PMC 5296336. PMID 28228754.
- ^ A b C d Thomas C, Tampé R (listopad 2017). „Struktura komplexu TAPBPR-MHC I definuje mechanismus zavádění a úpravy peptidů“. Věda. 358 (6366): 1060–1064. Bibcode:2017Sci ... 358.1060T. doi:10.1126 / science.aao6001. PMID 29025996.
- ^ Ortmann B, Androlewicz MJ, Cresswell P (duben 1994). „Komplexy MHC třídy I / beta 2-mikroglobulin se spojují s transportéry TAP před vazbou peptidu“. Příroda. 368 (6474): 864–7. Bibcode:1994 Natur.368..864O. doi:10.1038 / 368864a0. PMID 8159247. S2CID 4268516.
- ^ Sadasivan B, Lehner PJ, Ortmann B, Spies T, Cresswell P (srpen 1996). "Role pro kalretikulin a nový glykoprotein, tapasin, v interakci molekul MHC třídy I s TAP". Imunita. 5 (2): 103–14. doi:10.1016 / S1074-7613 (00) 80487-2. PMID 8769474.
- ^ Momburg F, Tan P (říjen 2002). „Tapasin - základní kámen zaváděcího komplexu optimalizujícího vazbu peptidů molekulami MHC třídy I v endoplazmatickém retikulu“. Molekulární imunologie. 39 (3–4): 217–33. doi:10.1016 / S0161-5890 (02) 00103-7. PMID 12200052.
- ^ McShan AC, Natarajan K, Kumirov VK, Flores-Solis D, Jiang J, Badstübner M a kol. (Srpen 2018). „Výměna peptidů na MHC-I pomocí TAPBPR je řízena negativním cyklem uvolňování allostery“. Přírodní chemická biologie. 14 (8): 811–820. doi:10.1038 / s41589-018-0096-2. PMC 6202177. PMID 29988068.
- ^ Frickel EM, Frei P, Bouvier M, Stafford WF, Helenius A, Glockshuber R, Ellgaard L (duben 2004). „ERp57 je multifunkční thiol-disulfid oxidoreduktáza“. The Journal of Biological Chemistry. 279 (18): 18277–87. doi:10,1074 / jbc.M314089200. PMID 14871896.
- ^ Oliver JD, Roderick HL, Llewellyn DH, High S (srpen 1999). „ERp57 funguje jako podjednotka specifických komplexů vytvořených s ER lektiny kalretikulin a kalnexin“. Molekulární biologie buňky. 10 (8): 2573–82. doi:10,1091 / mbc. 10. 8. 2573. PMC 25489. PMID 10436013.
- ^ Zhang Y, Baig E, Williams DB (květen 2006). "Funkce ERp57 při skládání a sestavování hlavních molekul histokompatibilního komplexu třídy I". The Journal of Biological Chemistry. 281 (21): 14622–31. doi:10,1074 / jbc.M512073200. PMID 16567808.
