Hmotová spektrální interpretace - Mass spectral interpretation
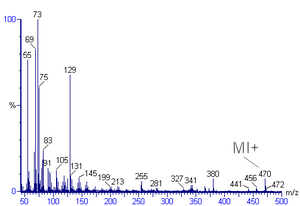
Hmotová spektrální interpretace je metoda použitá k identifikaci chemického vzorce, charakteristických vzorů fragmentů a možných fragmentových iontů z hmotnostního spektra.[1][2] Hmotnostní spektra jsou grafem relativní hojnosti proti poměru hmotnost k náboji. Běžně se používá k identifikaci organických sloučenin z elektronová ionizace hmotnostní spektrometrie.[3][4] Organičtí chemici získávají hmotnostní spektra chemické sloučeniny jako součást objasnění struktury a analýza je součástí mnoha organická chemie učební osnovy.
Generování hmotnostních spekter

Elektronová ionizace (EI) je typ hmotnostního spektrometru zdroj iontů ve kterém paprsek elektrony interaguje s molekulou M v plynné fázi za vzniku iontu podle
s molekulárním iontem .[5] Horní index „+“ označuje iontový náboj a horní index „•“ označuje an nepárový elektron z radikální ion. Energie elektronového paprsku je obvykle 70 elektronvolty a ionizační proces typicky produkuje rozsáhlou fragmentaci chemické vazby molekuly.
Vzhledem k vysokému vakuovému tlaku v ionizační komoře se střední volná dráha molekul pohybuje od 10 cm do 1 km a fragmentace jsou potom unimolekulární procesy. Jakmile je zahájena fragmentace, elektron je nejprve excitován z místa s nejnižší ionizační energií. Vzhledem k tomu, že pořadí energie elektronů je nevázací elektrony> elektrony vazby pi> elektrony vazby sigma, je pořadí preferencí ionizace nevázání elektronů> elektrony vazby pi> elektrony vazby sigma.[6]

Vrchol v hmotnostním spektru s největší intenzitou se nazývá základní vrchol. Vrchol odpovídající molekulárnímu iontu je často, ale ne vždy, základním vrcholem. Identifikace molekulárního iontu může být obtížná. Při zkoumání organických sloučenin relativní intenzita píku molekulárního iontu klesá s větvením a se zvyšující se hmotou v homologní sérii. Ve spektru pro toluen například pík molekulárního iontu je umístěn na 92 m / z, což odpovídá jeho molekulová hmotnost. Píkům molekulárních iontů také často předchází pík M-1 nebo M-2, který je výsledkem ztráty vodíkového radikálu nebo dihydrogenu.
Vrcholy s hmotností menší než je molekulární iont jsou výsledkem fragmentace molekuly. Existuje mnoho reakčních cest pro fragmentaci, ale v hmotnostním spektru se objeví pouze nově vytvořené kationty, nikoli radikální fragmenty nebo neutrální fragmenty. Metastabilní píky jsou široké píky s nízkou intenzitou při necelých hodnotách hmotnosti. Tyto vrcholy jsou výsledkem iontů s kratší životností, než je doba potřebná k překonání vzdálenosti mezi ionizační komorou a detektorem.
Stanovení molekulárního vzorce
Dusíkaté pravidlo
The pravidlo dusíku uvádí, že organické molekuly, které obsahují vodík, uhlík, dusík, kyslík, křemík, fosfor, síra a halogeny mají lichou nominální hmotnost, pokud mají lichý počet atomů dusíku, nebo sudou hmotnost, pokud mají sudý počet atomů dusíku.[7][8] Pravidlo dusíku platí pro struktury, ve kterých jsou všechny atomy v molekule mají počet kovalentních vazeb rovných jejich standardní valenci, počítajíc každou sigma vazba a pi vazba jako samostatná kovalentní vazba.
Pravidlo prstenů
Z hlediska principu nenasycení se podle vzorce řídí molekuly obsahující pouze uhlík, vodík, halogeny, dusík a kyslík
kde C je počet uhlíků, H je počet vodíků, X je počet halogenů a N je počet dusíku.
Dokonce i elektronové pravidlo
The dokonce i elektronové pravidlo uvádí, že ionty se sudým počtem elektronů (kationty, ale nikoliv radikální ionty) mají tendenci tvořit ionty fragmentů sudých elektronů a ionty lichých elektronů (radikální ionty) tvoří ionty lichých elektronů nebo ionty sudých elektronů.[9] Sudé elektronové druhy mají tendenci fragmentovat se na jiný párový elektronový kationt a neutrální molekulu než na dva zvláštní elektronové druhy.
OE+•→ EE++ R.•, OE+•→ OE+•+ N
Stevensonova pravidla
Čím stabilnější je kation produktu, tím hojnější je odpovídající proces rozkladu. K předpovědi procesu fragmentace lze použít několik teorií, jako je pravidlo elektronového oktetu, stabilizace rezonance a hyperkonjugace atd.[6]
Pravidlo 13
The Pravidlo 13 je jednoduchý postup pro vytvoření tabulky chemický vzorec pro danou molekulovou hmotnost.[10] Prvním krokem při aplikaci pravidla je předpokládat, že v molekule je přítomen pouze uhlík a vodík a že molekula obsahuje určitý počet CH „jednotek“, z nichž každá má jmenovitá hmotnost ze 13. Pokud je molekulová hmotnost dané molekuly M, počet možných jednotek CH je n a
kde r je zbytek. Základní vzorec pro molekulu je
a stupeň nenasycení je
Záporná hodnota u označuje přítomnost heteroatomů v molekule a poloviční celočíselnou hodnotu u označuje přítomnost lichého počtu atomů dusíku. Po přidání heteroatomů je molekulární vzorec upraven o ekvivalentní hmotnost uhlíku a vodíku. Například přidání N vyžaduje odstranění CH2 a přidání O vyžaduje odstranění CH4.
Izotopové účinky
Vrcholy izotopů ve spektru mohou pomoci při objasňování struktury. Sloučeniny obsahující halogeny (zejména chlór a bróm ) může produkovat velmi výrazné izotopové vrcholy. Hmotnostní spektrum methylbromid má dva výrazné vrcholy stejné intenzity v m / z 94 (M) a 96 (M + 2) a pak další dva na 79 a 81 patřící k bromovému fragmentu.
I když sloučeniny obsahují pouze prvky s méně intenzivními vrcholy izotopů (uhlík nebo kyslík ), rozdělení těchto vrcholů lze použít k přiřazení spektra správné sloučenině. Například dvě sloučeniny se stejnou hmotností 150 Da, C8H12N3+ a C.9H10Ó2+, bude mít dvě různé intenzity M + 2, což umožňuje rozlišovat mezi nimi.
Fragmentace
The fragmentační vzor spektra kromě stanovení molární hmotnosti neznámé sloučeniny vhodné také pro poskytnutí strukturní informace, zejména v kombinaci s výpočtem stupeň nenasycení z molekulární vzorec (když bude dostupný). Často se ztrácejí neutrální fragmenty kysličník uhelnatý, ethylen, voda, amoniak, a sirovodík. Existuje několik fragmentačních procesů.
α - štěpení
Fragmentace vzniká z a homolýza procesy. Toto štěpení je výsledkem tendence nepárového elektronu z radikálního místa spárovat se s elektronem z jiné vazby na atom sousedící s nábojovým místem, jak je znázorněno níže.[7] Tato reakce je definována jako homolytické štěpení, protože se přenáší pouze jeden elektron. Hnací silou takové reakce jsou schopnosti elektronů darovat radikály: N> S, O, π> Cl, Br> H.[11] Příkladem je štěpení vazby uhlík-uhlík vedle a heteroatom. V tomto zobrazení jsou pohyby jednoho elektronu označeny a jednohlavý šíp.

Štěpení vazby Sigma
Ionizace alkanů oslabuje vazbu C-C, což nakonec vede k rozkladu.[7] Při přerušení vazby se generují nabité A, dokonce i elektronové druhy (R +) a neutrální radikály (R •). Vysoce substituované karbokationty jsou stabilnější než nesubstituované. Příklad je znázorněn níže.
Indukční štěpení
Tato reakce je výsledkem indukčního účinku radikálových míst, jak je znázorněno níže. Tato reakce je definována jako heterolytické štěpení, protože je přenesen pár elektronů.[11] Hybnými silami takové reakce jsou elektronegativity radikálových míst: halogeny> O, S >> N, C. tato reakce je méně příznivá než reakce radikálních míst.[11]
McLaffertyho přesmyk
The McLaffertyho přesmyk se může vyskytovat v molekule obsahující ketoskupinu a zahrnuje β-štěpení se ziskem atomu y-vodíku.[12][13][14] Iontově neutrální komplex Tvorba zahrnuje homolýzu vazby nebo heterolýzu vazby, kdy fragmenty nemají dostatek kinetické energie k oddělení a místo toho vzájemně reagují jako reakce iontové molekuly.
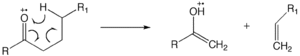
Přesmyk vodíku na nasycený heteroatom
Posun vodíku „1,5“ způsobí přenos jednoho γ-vodíku do radikálního místa na nasyceném heteroatomu. Stejné požadavky na McLaffertyho přesmyk platí i pro přeskupení vodíku na nasycený heteroatom. Takové přeskupení iniciuje reakci na náboji, což vede k tvorbě zvláštního elektronového iontu a malé neutrální molekuly (voda nebo kyselina atd.). U alkoholů toto heterolytické štěpení uvolňuje molekulu vody. Vzhledem k tomu, že reakce v místě náboje jsou dominantní u méně objemných alkoholů, je tato reakce u alkoholů upřednostňována jako primární> sekundární> terciární.[11]
Double-vodík přesmyk
Posun vodíku „1,5“ způsobí přenos dvou y-vodíku do dvou radikálních míst na dvou různých nenasycených atomech. Stejné požadavky na přeskupení McLafferty platí pro přeskupení s dvojitým vodíkem. Tato reakce je pozorována pro tři nenasycené funkční skupiny, konkrétně thioestery, estery a amidy.[15]
Ortho přesmyk
Posun vodíku „1,5“ způsobí přenos dvou y-vodíku do dvou radikálních míst na dvou různých nenasycených atomech. Stejné požadavky na „1,5“ posun vodíku se vyskytují mezi správnými substituenty v orto polohách aromatických kruhů. Stejné požadavky na přeskupení McLafferty platí pro orto přeskupení, s výjimkou silné dvojné vazby α, β uhlík-uhlík. Takové přeskupení iniciuje reakci na náboji, což má za následek tvorbu zvláštního elektronového iontu a malé neutrální molekuly (voda nebo HCl atd.). Tuto reakci lze použít k odlišení ortho od para a meta isomerů McLaffertyho přesmyk platí pro přeskupení s dvojným vodíkem. Tato reakce je pozorována pro tři nenasycené funkční skupiny, konkrétně thioestery, estery a amidy.[11]

Reakce Retro-Diels-Alder
K této reakci dochází hlavně v cyklohexenu a jeho derivátech. Po ionizaci jsou elektrony pí excitovány a generují nábojové místo a radikální místo. V návaznosti na to dvě po sobě následující štěpení α dávají butadienový radikál a neutrální eten, protože eten má vyšší ionizační energii než butadien (Stevensonova pravidla).[11]

Cykloreverzní reakce
K této reakci dochází hlavně u čtyřčlenných cyklických molekul. Jakmile je ionizovaný, produkuje distonický iont a poté další fragmenty, čímž se získá etherový radikální ion a neutrální molekula etenu.[11]
Fragmentační vzorce konkrétních tříd sloučenin
Alkany
U lineárních alkanů jsou často pozorovány píky molekulárních iontů. U sloučenin s dlouhým řetězcem je však intenzita vrcholů molekulárních iontů často slabá. Lineární fragmenty se často liší o 14 Da (CH2 = 14). Například vzory fragmentace hexanu. Butyl kation m / z = 57 je základní pík a další nejhojnější píky ve spektru jsou alkylové karbokationty při m / z = 15, 29, 43 Da.[6][2][11]

Rozvětvené alkany mají ve spektrech poněkud slabší vrcholy molekulárních iontů. Mají tendenci se fragmentovat v rozvětveném bodě. Pro 2,3-dimethylbutan je vrchol isopropylového kationtu (m / z = 43) velmi silný.[6][2][11]

Cykloalkany mají relativně intenzivní píky molekulárních iontů (musí se rozbít dvě vazby). Vrcholy fragmentace alkenů jsou často nejvýznamnějším režimem. Ztráta „CH2CH2„(= 28) je běžné, pokud je přítomno. Avšak pro substituované cykloalkany dávají přednost tvorbě cykloalkylových kationtů štěpením v rozvětvených bodech.[11]

Alkenes
Alkeny často produkují silnější molekulové iontové vrcholy než alkany kvůli nižší ionizační energii elektronu pí než elektronu σ. Po ionizaci mohou dvojné vazby snadno migrovat, což má za následek téměř nemožné stanovení izomerů. Allylové štěpení je nejvýznamnějším fragmentačním režimem kvůli rezonanční stabilizaci.[11]
Možné jsou přesmyky podobné McLafferty (podobné karbonylovým vazbám pi). Opět je možná migrace dluhopisů.[11]

Cyklohexeny často podléhají retro Diels-Alderovým reakcím.
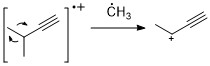
Alkyny
Podobně jako alkeny vykazují alkyny často silný vrchol molekulárních iontů. Propargylické štěpení je nejvýznamnějším fragmentačním režimem.[11]
Aromatické uhlovodíky
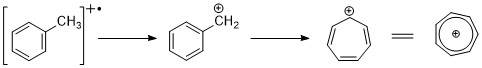
Aromatické uhlovodíky vykazují zřetelný vrchol molekulárních iontů. Benzylové štěpení je docela běžné. Pokud jsou na kruh připojeny alkylové skupiny, je výhodným způsobem štěpení ztráta H-radikálu za vzniku kationu tropylia (m / z 91).[2][11]
Alkylem substituované benzeny mohou fragmentovat kineticky řízeným procesem za vzniku C6H5+, C.6H6+ ionty.[11]

Dalším běžným způsobem fragmentace je McLaffertyův přesmyk, který vyžaduje, aby délka alkylového řetězce byla alespoň delší než 3 uhlíky.[11]

Alkoholy
Alkoholy mají obecně slabé molekulové iontové píky kvůli silné elektronegativitě kyslíku. Štěpení „alfa“ je běžné díky stabilizaci rezonance. Největší alkylová skupina bude ztracena.[2]

Dalším běžným režimem fragmentace je dehydratace (M-18). U alkoholů s delším řetězcem může přeskupení typu McLafferty produkovat vodu a ethylen (M -46).
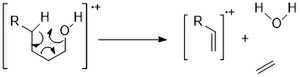
Cyklické alkoholy mají tendenci vykazovat silnější M + vrcholy než lineární řetězce. A sledují podobné cesty fragmentace: Alfa štěpení a dehydratace.[11]
Fenol
Fenol vykazuje silný vrchol molekulárních iontů. Je pozorována ztráta H · (M - 1), CO (M - 28) a formylového radikálu (HCO ·, M - 29).[2][11]

Éter
Ethery produkují o něco intenzivnější píky molekulárních iontů ve srovnání s odpovídajícími alkoholy nebo alkany. Existují dva běžné režimy štěpení. štěpení a-štěpením a C-O vazbou.

Aromatické ethery mohou generovat ionty C6H5O + spíše ztrátou alkylové skupiny než H; to může vyloučit CO jako při fenolické degradaci.[11]

Karbonylové sloučeniny
Existuje pět typů karbonylových sloučenin, včetně aldehydů, ketonů, karboxylových kyselin a esterů.[2] Hlavní režimy fragmentace jsou popsány následovně:
Alfa-štěpení může nastat na obou stranách karbonylové funkční skupiny, protože kyslík osamocený pár může stabilizovat pozitivní náboj.

β-štěpení je charakteristickým způsobem fragmentace karbonylových sloučenin v důsledku stabilizace rezonance.
U karbonylových sloučenin s delším řetězcem (počet uhlíků je větší než 4) jsou dominantní McLaffertyho přesmyky.

Podle těchto fragmentačních vzorů jsou charakteristické píky karbonylových sloučenin shrnuty v následující tabulce.
| m / z iontu pozorováno | ||||||
| Fragmentace | Cesta | Aldehydy G = H | Ketony G = CH3 | Estery G = OCH3 | Kyseliny G = OH | Amidové G = NH2 |
| Alfa-štěpení | Ztráta radikálu R. | 29 | 43 | 59 | 45 | 44 |
| Alfa-štěpení | Ztráta radikálu G. | M-1 | M-15 | M-59 | M-45 | M-44 |
| Beta-štěpení | M-43 | M-57 | M-73 | M-59 | M-58 | |
| McLaffertyho přesmyk | 44 | 58 | 74 | 60 | 59 | |
U aromatických karbonylových sloučenin je výhodné štěpení alfa především ztrátou G · (M - 1,15, 29…) za vzniku iontu C6H5CO + (m / z = 105), který může dále ztrácet CO (m / z = 77) a HCCH (m / z = 51).[6]

Miny
Aminy se řídí pravidlem dusíku. Zvláštní poměr hmotnosti a náboje molekulárních iontů naznačuje existenci lichých počtů dusíku. Píky molekulárních iontů jsou nicméně u alifatických aminů slabé kvůli snadné fragmentaci vedle aminů. Alfa-štěpné reakce jsou nejdůležitějším režimem fragmentace pro aminy; pro 1 ° n-alifatické aminy je intenzivní vrchol při m / z 30.[11][6]
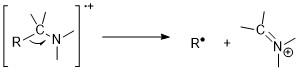
Aromatické aminy mají intenzivní píky molekulárních iontů. U anilinů dávají přednost ztrátě atomu vodíku před vyloučením HCN.
Nitrily
Principiálním režimem fragmentace je ztráta atomu H (M - 1) z uhlíku vedle skupiny CN v důsledku stabilizace rezonance. McLaffertyův přesmyk lze pozorovat, když mají delší délky řetězu.[6]
Nitrosloučeniny
Alifatické nitrosloučeniny obvykle vykazují píky slabých molekulárních iontů, zatímco aromatické nitrosloučeniny poskytují silný pík. Běžným režimem degradace je ztráta NO+ a žádná2+.[6]

Elektrosprej a chemická ionizace za atmosférického tlaku
Elektrosprej a chemická ionizace za atmosférického tlaku mají různá pravidla pro interpretaci spektra kvůli různým ionizačním mechanismům.[16]
Viz také
- Algoritmus detekce členů (CODA), algoritmus používaný při analýze dat hmotnostní spektrometrií
- Seznam softwaru pro hmotnostní spektrometrii
Reference
- ^ Terrence A. Lee (4. února 1998). Průvodce pro začátečníky po interpretaci hmotnostního spektra. John Wiley & Sons. ISBN 978-0-471-97629-5.
- ^ A b C d E F G Fred W. McLafferty (1. ledna 1993). Interpretace hmotového spektra. University Science Books. ISBN 978-0-935702-25-5.
- ^ Spektrometrická identifikace organických sloučenin Silverstein, Bassler, Morrill, 4. vyd.
- ^ Organická spektroskopie William Kemp 2. vyd. ISBN 0-333-42171-X
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “elektronová ionizace ". doi:10.1351 / zlatá kniha.E01999
- ^ A b C d E F G h Pavia, Donald L. Úvod do spektroskopie. p. 141. ISBN 1-285-46012-X.
- ^ A b C Tureček, František; McLafferty, Fred W. (1993). Interpretace hmotnostních spekter. Sausalito, Kalifornie: University Science Books. 37–38. ISBN 0-935702-25-3.
- ^ David O. Sparkman (2007). Referenční příručka pro hmotnostní spektrometrii. Pittsburgh: Global View Pub. p. 64. ISBN 0-9660813-9-0.
- ^ Karni, Miriam; Mandelbaum, Asher (1980). „Pravidlo„ sudých elektronů “'". Organická hmotnostní spektrometrie. 15 (2): 53–64. doi:10,1002 / oms. 1210150202. ISSN 0030-493X.
- ^ Bright, J. W .; Chen, E. C. M. (1983). "Hmotnostní spektrální interpretace pomocí" pravidla "13" "". Journal of Chemical Education. 60 (7): 557. Bibcode:1983JChEd..60..557B. doi:10.1021 / ed060p557. ISSN 0021-9584.
- ^ A b C d E F G h i j k l m n Ó str q r s t Dass, Chhabil (2007). Základy současné hmotnostní spektrometrie. Wiley-interscience. 219–232. ISBN 978-0-471-68229-5.
- ^ F. W. McLafferty (1959). "Hmotnostní spektrometrická analýza. Molekulární přesmyky". Anální. Chem. 31 (1): 82–87. doi:10.1021 / ac60145a015.
- ^ Gross ML (2004). „Zaměření na počest nositele ceny Fred McLafferty, 2003 za mimořádný přínos, za objev„ McLaffertyho přesmyku"". J. Am. Soc. Hmotnostní spektrum. 15 (7): 951–5. doi:10.1016 / j.jasms.2004.05.009. PMID 15234352.
- ^ Nibbering NM (2004). „McLaffertyův přesmyk: osobní vzpomínka“. J. Am. Soc. Hmotnostní spektrum. 15 (7): 956–8. doi:10.1016 / j.jasms.2004.04.025. PMID 15234353.
- ^ Kingston, David G. (1974). „Intramolekulární přenos vodíku v hmotnostních spektrech. II. McLaffertyho přesmyk a související reakce“. Chemické recenze. 74: 216–242. doi:10.1021 / cr60288a004.
- ^ Holčapek, Michal; Jirásko, Robert; Lísa, Miroslav (2010). "Základní pravidla pro interpretaci hmotnostního spektra ionizujícího atmosférického tlaku malých molekul". Journal of Chromatography A. 1217 (25): 3908–3921. doi:10.1016 / j.chroma.2010.02.049. ISSN 0021-9673. PMID 20303090.






