Lýzový pufr - Lysis buffer
tento článek potřebuje další citace pro ověření. (Únor 2016) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
A lyzační pufr je pufrovací roztok používané za účelem rozbití otevřených buněk pro použití v molekulární biologie experimenty, které analyzují labilní makromolekuly buněk (např. western blot pro bílkoviny nebo pro Extrakce DNA ). Většina lyzačních pufrů obsahuje pufrovací soli (např. Tris-HCl ) a iontové soli (např. NaCl ) k regulaci pH a osmolarita z lyzát. Někdy čisticí prostředky (např Triton X-100 nebo BL ) se přidávají k rozbití membránových struktur. Pro lyzační pufry zaměřené na extrakce bílkovin, inhibitory proteázy jsou často zahrnuty a ve složitých případech mohou být téměř vyžadovány. Lysické pufry lze použít jak na zvířecí, tak na rostlinné tkáňové buňky.[1]
Výběr vyrovnávací paměti
Primárním účelem lyzačního pufru je izolace sledovaných molekul a jejich udržování ve stabilním prostředí. U proteinů by u některých experimentů měly být cílové proteiny úplně denaturovaný, zatímco v některých dalších experimentech by měl cílový protein zůstat složený a funkční. Různé proteiny mají také různé vlastnosti a nacházejí se v různých buněčných prostředích. Je tedy nezbytné zvolit nejlepší vyrovnávací paměť na základě účelu a designu experimentů. Mezi důležité faktory, které je třeba vzít v úvahu, patří: pH, iontová síla, použití detergentu, inhibitory proteázy k prevenci proteolytických procesů.[2] Například přidávání detergentu je nezbytné při lýze gramnegativních bakterií, ale ne u grampozitivních bakterií.[3] Je běžné, že se při studiu proteinů s fosforylací do lyzačního pufru přidává inhibitor proteázy spolu s dalšími vybranými inhibitory enzymů, jako je inhibitor fosfatázy.
Součásti
Buffer
Pufr vytváří prostředí pro izolované proteiny. Každá volba pufru má specifické rozmezí pH, proto by měl být pufr vybrán na základě toho, zda je váš cílový protein stabilní při určitém pH. U pufrů s podobným rozsahem pH je také důležité zvážit, zda je pufr kompatibilní s vaším cílovým proteinem.[4] Níže uvedená tabulka obsahuje několik nejčastěji používaných pufrů a jejich rozmezí pH.[4]
| Buffer | Rozsah pH |
|---|---|
| Dihydrogenfosforečnan sodný / hydrogenfosforečnan sodný | 5.8 - 8.0 |
| Tris - HCl | 7.0 - 9.0 |
| HEPES - NaOH | 7.2 - 8.2 |
Přísady
Solí
Lyzační pufr obvykle obsahuje jednu nebo více solí. Funkcí solí v lyzačním pufru je stanovení iontové síly v pufrovacím roztoku. Některé z nejčastěji používaných solí jsou NaCl, KCl a (NH4)2TAK4. Obvykle se používají v koncentraci mezi 50 a 150 mM.[4]

Čisticí prostředek
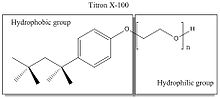
Detergenty jsou organické amfipatické (s hydrofobním ocasem a hydrofilní hlavou) povrchově aktivní látky. Používají se k oddělení membránových proteinů od membrány, protože hydrofobní část detergentu může obklopovat biologické membrány, a tak izolovat membránové proteiny z membrán.[5] Přestože jsou detergenty široce používány a mají podobné funkce, je důležité porozumět fyzikálním a chemickým vlastnostem požadovaných detergentů, abyste mohli určit optimální, který použijete pro svůj experiment.
Detergenty jsou často kategorizovány jako neiontové, aniontové, kationtové nebo zwitteriontové na základě jejich hydrofilní funkce hlavní skupiny.[5]
Neiontové detergenty jako Triton X-100 a zwitteriontové detergenty jako CHAPS (3 - [(3-cholamidopropyl) dimethylamonio] -1-propansulfonát) jsou nedenaturující (nenaruší proteinové funkce). Iontové detergenty, jako je dodecylsulfát sodný (SDS), a kationtové detergenty, jako je ethyltrimethylamoniumbromid, jsou denaturační (naruší proteinové funkce).[6] Detergenty jsou hlavní složkou, která určuje lyzační sílu daného lyzačního pufru.
Ostatní
Mezi další přísady patří kovové ionty, cukr jako glukóza, glycerol, chelatátory kovů (např. EDTA ) a redukční činidla jako dithiothreitol (DTT).[4]
Běžně používané vyrovnávací paměti
NP-40 lyzační pufr
Může to být nejpoužívanější lyzační pufr. Solubilizační činidlo je NP-40, které lze nahradit jinými čisticími prostředky v různých koncentracích. Protože NP-40 je neiontový detergent, má tento lyzační pufr mírnější účinek než pufr RIPA. Může být použit, když mají být zachovány proteinové funkce s minimálním narušením.[7]
Recept:[7]
- 150 mM NaCI
- 1,0% Nonidet P-40 nebo Triton X-100
- 50 mM Tris-Cl
- Upravte pH na 7,4
Pufr pro lýzu RIPA (RadioImmunoPrecipitation Assay)
RIPA pufr je běžně používaný lyzační pufr pro imunoprecipitaci a obecnou extrakci proteinu z buněk a tkání. Pufr lze skladovat bez vanadátu při 4 ° C po dobu až 1 roku.[8] RIPA pufr uvolňuje proteiny z buněk a narušuje většinu slabých interakcí mezi proteiny.[7]
Recept:[8]
- 1% (hm.) Nonidet P-40 (NP-40)
- 1% (hmotn./obj.) Deoxycholát sodný
- 0,1% (hm./obj.) SDS
- 0,15 M NaCl
- 0,01 M fosforečnan sodný, pH 7,2
- 2 mM EDTA
- 50 mM fluorid sodný (NaF)
- 0,2 mM čerstvého orthovanadátu sodného (Na3VO4.2H2O, má funkci inhibitoru fosfatázy, protože napodobuje fosfát)
- 100 U / ml inhibitoru proteázy, jako je aprotinin
Pufr pro lýzu SDS (dodecylsulfát sodný)
SDS je iontový denaturační prací prostředek. Horký SDS pufr se často používá, když je třeba proteiny úplně solubilizovat a denaturovat.
Recept:[8]
- 0,5% (hm./obj.) SDS
- 0,05 M Tris⋅Cl
- Upravte pH na 8,0
- Přidejte 1 mM čerstvého dithiothreitolu (DTT)
Pufr pro lýzu ACK (chlorid amonný-draselný)
ACK se používá pro lýzu červené krvinky v biologických vzorcích, kde jiné buňky, jako např bílé krvinky jsou většího zájmu.[9]
- 150 mM chlorid amonný
- 10 mM hydrogenuhličitan draselný
- 0,1 mM EDTA
- Upravte pH na 7,2-7,4
Lýzový pufr ve studiích DNA a RNA
Ve studiích, jako je otisk DNA, se pro izolaci DNA používá lyzační pufr. Mýdlo na nádobí lze použít jako špetku k rozbití buněk a jaderných membrán, což umožňuje uvolnění DNA. Mezi další takové lyzační pufry patří patentovaný produkt Qiagen Buffer P2.
Reference
- ^ Posch, Anton (01.12.2014). "Pokyny pro přípravu vzorků pro dvourozměrnou elektroforézu". Archiv fyziologie a biochemie. 120 (5): 192–197. doi:10.3109/13813455.2014.955031. ISSN 1744-4160. PMID 25211021.
- ^ Peach, Mandy; Marsh, Noelle; Miskiewicz, EwaI .; MacPhee, Daniel J. (01.01.2015). Kurien, Biji T .; Scofield, R. Hal (eds.). Solubilizace proteinů: Důležitost volby lyzačního pufru. Metody v molekulární biologii. 1312. Springer New York. str. 49–60. doi:10.1007/978-1-4939-2694-7_8. ISBN 9781493926930. PMID 26043989.
- ^ Posch, Anton (2008). 2D STRÁNKA: Příprava vzorku a frakcionace. Humana Press. str.24. ISBN 978-1-58829-722-8.
- ^ A b C d Affairs, EMBL - Úřad pro informace a veřejnost. „Čištění bílkovin - Extrakce a čištění - Výběr lyzačního pufru a přísad - EMBL“. www.embl.de. Citováno 2016-03-16.
- ^ A b Linke, Dirk (01.01.2009). Deutscher, Richard R. Burgess a Murray P. (ed.). Kapitola 34 Čisticí prostředky: Přehled. Metody v enzymologii. Průvodce purifikací bílkovin, 2. vydání. 463. 603–617. doi:10.1016 / s0076-6879 (09) 63034-2. ISBN 9780123745361. PMID 19892194.
- ^ "Detergenty pro buněčnou lyzi a extrakci proteinů". www.thermofisher.com. Citováno 2016-03-16.
- ^ A b C Ji, Hong (01.08.2010). "Lýza kultivovaných buněk pro imunoprecipitaci". Cold Spring Harbor Protocols. 2010 (8): pdb.prot5466. doi:10.1101 / pdb.prot5466. ISSN 1940-3402. PMID 20679375.
- ^ A b C Sefton, Bartholomew M. (01.01.2001). "Značení kultivovaných buněk pomocí32Piand a příprava buněčných lyzátů pro imunoprecipitaci". Značení kultivovaných buněk pomocí 32Pi a příprava buněčných lyzátů na imunoprecipitaci. Současné protokoly v molekulární biologii. Kapitola 18. John Wiley & Sons, Inc. str. Jednotka 18.2. doi:10.1002 / 0471142727.mb1802s40. ISBN 9780471142720. PMID 18265167.
- ^ https://www.thermofisher.com/order/catalog/product/A1049201
- ^ „ACK Lysis Buffer“. Cold Spring Harbor Protocols. 2014 (11): pdb.rec083295. 2014. doi:10.1101 / pdb.rec083295.
- ^ "A10492 - ACK Lysing Buffer - US".
