Latrunculin - Latrunculin

The latrunculiny jsou rodina přírodní produkty a toxiny produkoval jistý houby, včetně rodu Latrunculia a Negombata, odkud je název odvozen. To se váže aktin monomery poblíž štěrbiny vázající nukleotidy v poměru 1: 1 stechiometrie a brání jim v tom polymeruje. Spravováno in vivo, tento účinek má za následek narušení aktinových filamentů cytoskelet a umožňuje vizualizaci příslušných změn provedených v buněčných procesech. Tato vlastnost je podobná vlastnosti cytochalasin, ale má úzké efektivní koncentrační rozmezí.[1] Latrunculin byl použit s velkým účinkem při objevu kadherin regulace distribuce a má potenciální lékařské aplikace.[2] Bylo zjištěno, že latrunculin A, typ toxinu, dokáže reverzibilní morfologické změny v savčích buňkách narušením sítě aktinů.[3]
Latrunculin A:
Cíl a funkce
Gelsolin - Latrunculin A způsobuje koncové blokování; tento protein se váže na ostnaté strany aktinových vláken, což urychluje tvorbu jader. Tento protein regulovaný vápníkem také hraje roli při sestavování a demontáži řasinek[4] který hraje rozhodující roli v rukou.
Latrunculin B:
| Molekulární vzorec: | C20H29NE5S[4] |
| Molekulární váha: | 395,514 g / mol |
Cíl a funkce
Aktin-Latrunculin B tvoří strukturu aktinových vláken.
Homolog proteinového spirála 2 - potřebný pro buněčné dělení, transport vezikul uvnitř aktinového vlákna a je nezbytný pro tvorbu formace štěpení během buněčného dělení[4].
Dějiny
Latrunculin je toxin, který se produkuje houbami. Červeně zbarvené Latrunculia Magnifica Keller je hojná houba v Eilatský záliv a záliv Suez[5] v Rudém moři, kde žije v hloubce 6–30 metrů.[6] Toxin byl objeven kolem roku 1970. Vědci zjistili, že červeně zbarvené houby Latrunculia Magnifica Keller nebyly nikdy poškozeny ani konzumovány rybami, zatímco jiné ano. Kromě toho, když vědci stiskli houby v moři, zjistili, že z nich vytéká červená tekutina. Ryby poblíž okamžitě utekly z okolí, když houba vylučovala tekutinu. To byly první náznaky, že tyto houby produkovaly toxin. Později hypotézu potvrdili mačkáním houby v akváriu s rybami. Ryby vykazovaly ztrátu rovnováhy a silné krvácení a uhynuly během pouhých 4–6 minut.[6] Podobné účinky byly pozorovány, když byl toxin injikován myším.
Latrunculin tvoří až 0,35% suché hmotnosti houby.[5] Existují dvě hlavní formy toxinu, A a B. Latrunculin A je přítomen pouze v houbách, které žijí v Suezském zálivu, zatímco latrunculin B existuje pouze v houbách v zálivu Eilat. Proč tomu tak je, je stále předmětem šetření.[5]
Struktura

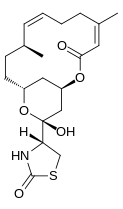
Existuje několik izomerů latrunculinu, A, B, C, D, G, H, M, S a T. Nejběžnějšími strukturami jsou latrunculin A a B. Jejich vzorce jsou příslušně C22H31NE5S a C.20H29NE5S. makrolaktonový prsten nahoře, který obsahuje dvojné vazby, je strukturní rys molekul latrunculinu. Boční řetěz obsahuje acylthiazolidinon náhradní. Kromě těchto přirozeně se vyskytujících forem vytvořili vědci také syntetické formy s různými toxickými silami. Obrázek 2 ukazuje některé z těchto forem s jejich relativní schopností narušit mikrofilament aktivita. Polosyntetický formy, které obsahovaly N-alkylované deriváty, byly neaktivní.[7]
Mechanismus účinku
Latrunculin A a latrunculin B ovlivňují polymeraci aktin. Latrunculin váže aktinové monomery poblíž štěrbiny vázající nukleotidy v poměru 1: 1 stechiometrie a brání jim v tom polymeruje.[1] Nukleotidovým monomerům je zabráněno v disociaci z štěrbiny vázající nukleotidy, což brání polymeraci.[8]
Experimentální důkazy ukazují, že latruculin-A je biologicky aktivní v rozpouštědle DMSO, ale ne ve vodných roztocích, jak bylo prokázáno v buněčné kultuře a v mozkové tkáni[9] pravděpodobně kvůli buněčné permeaci.
Pokud je aktin narušen latrunculinem, Shiga toxiny mít větší šanci proniknout do střevní epitel monovrstva v E-coli, což může způsobit vyšší šanci na generování gastrointestinální nemoci.[10]
Zdá se, že aktinové monomery jsou citlivější na vazbu latrunculinu A než na vazbu Latrunculinu B.[11] Jinými slovy, latrunculin A je účinnějším toxinem. Latrunculin B je inaktivován rychleji než latrunculin A.[12]
Prevence polymerace aktinových vláken způsobuje reverzibilní změny v morfologii savčích buněk.[13] Lantranculin interferuje se strukturou cytoskeletu u potkanů.[14]
Po expozici latrunculinu B se myší fibroblasty zvětšily a ledvinové buňky PtK2 z kmene potoroo produkovaly dlouhé, rozvětvené prodloužení.[15] Rozšíření se zdají být akumulací aktinových monomerů.
Metabolismus
Buňky kvasinek v nepřítomnosti proteinů osh3 nebo osh5 prokázaná přecitlivělost na latrunculin B.[16] Osh proteiny jsou homologní OSBP generované enzymy, které se objevují u savců, což naznačuje, že by mohly hrát roli v toxikokinetika latrunculinů.
Kvasinkové mutanty, které jsou rezistentní na latrunculin, vykazují mutaci D157E, která iniciuje vodíkovou vazbu s latrunculinem.[8] Jiné kvasinkové mutanty upravují vazebné místo, čímž se stávají rezistentními vůči latrunculinu.
Nebyl proveden žádný výzkum, aby se zjistilo, jak biotransformace latrunculinu funguje v eukaryotických buňkách. Výzkum však naznačuje, že je to nezměněná forma latrunculinu, která má toxické účinky.[3]
Toxicita
Protože latrunculin inhibuje polymeraci aktinu a aktomyosin kontraktilní schopnost, vystavení latrunculinu může vést k buněčné relaxaci, expanzi drenážních tkání a snížení odtokového odporu např. the trabekulární síť.
Rostlina
Latrunculin B způsobuje výrazné a na dávce závislé snížení frekvence klíčení pylu a pylová trubice tempo růstu.[17]
Přidání latrunculinu B do roztoků pylu F-aktin způsobil rychlý pokles celkového množství polymeru, rozsah depolymerace se zvyšoval s koncentracemi toxického. Koncentrace latrunculinu B požadovaná pro poloviční maximální inhibici klíčení pylu je 40 až 50 nM, zatímco prodloužení pylové trubice je mnohem citlivější a vyžaduje pouze 5 až 7 nM LATB pro poloviční maximální inhibici. Narušení klíčení a růstu pylové trubice latrunculinem B je při nízkých koncentracích částečně reverzibilní. (<30 nM).[17]
Zvíře
Mačkání Latrunculia magnifica do akvária s rybami způsobí jejich téměř okamžité rozrušení, po kterém následuje krvácení, ztráta rovnováhy a smrt za 4–6 minut.[18]
Latrunculin A byl použit jako akrozomová reakce inhibitor morčete v laboratorních podmínkách.[19]
Člověk
Lat-A indukuje snížení kontraktility aktomyosinu. To je spojeno s trabekulární síť porézní expanze bez důkazů o snížené expresi strukturního proteinu extracelulární matrice nebo životaschopnosti buněk.[20] Ve vysokých dávkách může latrunculin vyvolat akutní poškození buněk a naprogramovanou buněčnou smrt aktivací dráhy kaspázy-3/7.[18]
Smrtící dávky
TDLO - Nejnižší publikovaná toxická dávka
LD50 – střední smrtelná dávka[21]
| Indikátor | Druh | Dávka |
| Ústní TDLO | Muž | 1,14 ml / kg, 650 mg / kg |
| Orálně LD50 | Krysa | 7,06 mg / kg |
| Orálně LD50 | Myš | 3,45 g / kg, 10,5 ml / kg |
| Orálně LD50 | Králičí | 6,30 mg / kg |
| Inhalace LC50 | Krysa | 6h: 5 900 mg / m3 10 h: 20 000 ppm |
| Inhalace LCLO | Myš | 7 h: 29 300 ppm |
| Inhalace TCLO | Člověk | 20 m: 2 500 mg / m3 30 m: 1 800 ppm |
| Podráždění očí | Králičí | 24h: 500 mg |
| Podráždění pokožky | Králičí | 24h: 20 mg |
Aplikace
V přírodě jsou latrunculiny používány samotnými houbami jako obranný mechanismus a pro stejný účel jsou také izolovány určitými nudibranchs.[22]
Latrunculiny se vyrábějí pro základní výzkum a mají potenciální lékařské aplikace, protože latrunculiny a jejich deriváty vykazují antiangionové, antiproliferativní, antimikrobiální a antimetastatické účinky.[2]
Obranný mechanismus
Stejně jako mnoho jiných přisedlých organismů jsou houby bohaté na sekundární metabolity s toxickými vlastnostmi a většina z nich, včetně Latrunculin, má obrannou roli proti dravci, konkurenty a epibionty.[23]
Samotné houby nejsou latrunculinem poškozeny. Jako opatření proti sebe-toxinaci udržují latrunculin v membránové vazbě vakuoly, které také fungují jako sekreční a skladovací vezikuly. Tyto vakuoly neobsahují aktin a zabraňují vstupu latrunculinu do cytosolu, kde by poškodil aktin.[23] Po výrobě v choanocyty, latrunculin se přenáší přes archeocyty do zranitelných oblastí hub, kde je nutná obrana, jako jsou zraněná nebo regenerační místa.[23]
Sekvestrace nudibranchs
Mořští slimáci rodu Chromodoris izolovat různé toxické látky z hub, které jedí jako obranné metabolity, včetně latrunculinu. Selektivně přenášejí a ukládají latrunculin v místech pláště, která jsou nejvíce vystavena potenciálním predátorům.[22] Má se za to, že při detoxikaci hraje důležitou roli trávicí systém nudibranch.[22]
V roce 2015 objev, že pět úzce příbuzných mořských slimáků rodu Chromodoris používá jako obranu latrunculin, naznačuje, že toxikum lze použít prostřednictvím Müllerova mimika.[22]
Výzkum
Latrunculiny se používají pro základní výzkum, jako jsou studie cytoskeletu. Mnoho funkcí aktinu bylo stanoveno pomocí latrunculinů k blokování polymerace aktinu a následným zkoumáním účinků na buňku. Pomocí této metody je důležitý aktin pro polarizovanou lokalizaci proteinů, polarizovaných exocytóza a bylo prokázáno zachování polarity buněk.[24]
V oblasti neurovědy byl latrunculin použit k prokázání role aktinu při regulaci napěťově řízené iontové kanály v různých nervových buňkách,[25] což ukazuje, že léčba latrunculinem může změnit elektrickou aktivitu nervových buněk.[25][26] Latrunculin vykazuje na dávce závislou inhibici K + proudů a akutní aplikace může vyvolat vypálení více akční potenciály , který by mohl být základem mechanismu obrany prostřednictvím nociceptory.[26] Kromě toho byl k prokázání role látky latrunculin-A použit dentritická páteř smrštění krku pro indukci synaptická plasticita[9].
Lékařské aplikace
Latrunculin A a B a deriváty mají potenciál jako nové chemoterapeutické agenti.[2][27] Potenciální použití latrunculinu jako inhibitorů růstu nádorových buněk již bylo zkoumáno u určitých forem rakovina žaludku,[18] metastatický karcinom prsu[27] a nádory prostaty.[28] V nižších dávkách lze latrunculin použít ke snížení disagregace a migrace buněk, čímž se zabrání invazivním aktivitám nádorových buněk.[28] Ve vyšších dávkách může latrunculin vyvolat akutní poškození buněk a programovaná buněčná smrt aktivací dráhy kaspázy-3/7, a tak se použít k zabíjení nádorových buněk.[18]
Latrunculin je také potenciálním léčivem pro oční hypertenze a glaukom. Ukázalo se, že latrunculin A a B narušují aktinový cytoskelet trabekulární sítě, což je důležité pro regulaci odporu odtoku humoru a tím i nitroočního tlaku.[29][30] Díky buněčné relaxaci a uvolněným spojům mezi buňkami může latrunculin zvýšit odtok humoru. První lidská studie s lantruculinem B při léčbě oční hypertenze a glaukomu prokázala u pacientů významně nižší nitrooční tlak.[30]
Reference
- ^ A b Braet F, De Zanger R, Jans D, Spector I, Wisse E (září 1996). „Činidlo narušující mikrofilamenta latrunculin A indukuje a zvyšuje počet fenester v sinusových endoteliálních buňkách jater krys: srovnání s cytochalasinem B“. Hepatologie. 24 (3): 627–35. doi:10,1002 / hep 510240327. PMID 8781335.
- ^ A b C El Sayed KA, Youssef DT, Marchetti D (únor 2006). "Bioaktivní přírodní a polosyntetické latrunculiny". Journal of Natural Products. 69 (2): 219–23. doi:10.1021 / np050372r. PMID 16499319.
- ^ A b Coué M, Brenner SL, Spector I, Korn ED (březen 1987). "Inhibice aktinové polymerace latrunculinem A". FEBS Dopisy. 213 (2): 316–8. doi:10.1016/0014-5793(87)81513-2. PMID 3556584.
- ^ A b C Pubchem. „Latrunculin A“. pubchem.ncbi.nlm.nih.gov. Citováno 2018-04-26.
- ^ A b C Groweiss A, Shmueli U, Kashman Y (01.10.1983). "Mořské toxiny Latrunculia magnifica". The Journal of Organic Chemistry. 48 (20): 3512–3516. doi:10.1021 / jo00168a028.
- ^ A b Kashman V, Groweiss A, Shmueli U (leden 1980). „Latrunculin, nový 2-thiazolidinon makrolid z mořské houby“. Čtyřstěn dopisy. 21 (37): 3629–3632. doi:10.1016/0040-4039(80)80255-3.
- ^ Maier ME (květen 2015). „Návrh a syntéza analogů přírodních produktů“. Organická a biomolekulární chemie. 13 (19): 5302–43. doi:10.1039 / C5OB00169B. PMID 25829247.
- ^ A b Morton WM, Ayscough KR, McLaughlin PJ (červen 2000). „Latrunculin mění rozhraní podjednotky aktin-monomer, aby se zabránilo polymeraci.“ Přírodní buněčná biologie. 2 (6): 376–8. doi:10.1038/35014075. hdl:1842/757. PMID 10854330.
- ^ A b Tazerart S, Mitchell DE, Miranda-Rottmann S, Araya R (srpen 2020). „Pravidlo plasticity závislé na časování špiček pro dendritické trny“. Příroda komunikace. 11 (1): 4276. doi:10.1038 / s41467-020-17861-7. PMC 7449969. PMID 32848151.
- ^ Maluykova I, Gutsal O, Laiko M, Kane A, Donowitz M, Kovbasnjuk O (červen 2008). „Latrunculin B usnadňuje transcelulární transcytózu Shiga toxinu 1 napříč intestinálními epitelovými buňkami T84“. Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1782 (6): 370–7. doi:10.1016 / j.bbadis.2008.01.010. PMC 2509583. PMID 18342638.
- ^ Wakatsuki T, Schwab B, Thompson NC, Elson EL (březen 2001). "Účinky cytochalasinu D a latrunculinu B na mechanické vlastnosti buněk". Journal of Cell Science. 114 (Pt 5): 1025–36. PMID 11181185.
- ^ Spector I, Shochet NR, Blasberger D, Kashman Y (1989). „Latrunculiny - nové mořské makrolidy, které narušují organizaci mikrofilamentů a ovlivňují růst buněk: I. Srovnání s cytochalasinem D“. Motilita buněk a cytoskelet. 13 (3): 127–44. doi:10,1002 / cm. 970130302. PMID 2776221.
- ^ Pendleton A, Koffer A (leden 2001). "Účinky latrunculinu odhalují požadavky na cytoskelet aktinu během sekrece z žírných buněk". Motilita buněk a cytoskelet. 48 (1): 37–51. doi:10.1002 / 1097-0169 (200101) 48: 1 <37 :: aid-cm4> 3.0.co; 2-0. PMID 11124709.
- ^ Yarmola EG, Somasundaram T, Boring TA, Spector I, Bubb MR (září 2000). „Struktura a funkce aktin-latrunculinu A. Diferenciální modulace funkce proteinu vázajícího aktin latrunculinem A“. The Journal of Biological Chemistry. 275 (36): 28120–7. doi:10.1074 / jbc.m004253200. PMID 10859320.
- ^ Gronewold TM, Sasse F, Lünsdorf H, Reichenbach H (leden 1999). "Účinky rhizopodinu a latrunculinu B na morfologii a na aktinový cytoskelet buněk savců". Výzkum buněk a tkání. 295 (1): 121–9. doi:10.1007 / s004410051218. PMID 9931358.
- ^ Fairn GD, McMaster CR (leden 2008). „Vznikající role rodiny proteinů vázajících oxysterol v metabolismu, transportu a signalizaci“. Buněčné a molekulární biologické vědy. 65 (2): 228–36. doi:10.1007 / s00018-007-7325-2. PMID 17938859.
- ^ A b Gibbon BC, Kovar DR, Staiger CJ (prosinec 1999). „Latrunculin B má různé účinky na klíčení pylu a růst tuby“. Rostlinná buňka. 11 (12): 2349–63. doi:10.1105 / tpc.11.12.2349. PMC 144132. PMID 10590163.
- ^ A b C d Konishi H, Kikuchi S, Ochiai T, Ikoma H, Kubota T, Ichikawa D, Fujiwara H, Okamoto K, Sakakura C, Sonoyama T, Kokuba Y, Sasaki H, Matsui T, Otsuji E (červen 2009). „Latrunculin a má silný protirakovinový účinek v modelu peritoneální diseminace lidské rakoviny žaludku u myší“. Protinádorový výzkum. 29 (6): 2091–7. PMID 19528469.
- ^ Roa-Espitia AL, Hernández-Rendón ER, Baltiérrez-Hoyos R, Muñoz-Gotera RJ, Cote-Vélez A, Jiménez I, González-Márquez H, Hernández-González EO (září 2016). „Kináza fokální adheze je nutná pro polymeraci aktinu a remodelaci cytoskeletu během kapacitace spermií“. Biologie otevřená. 5 (9): 1189–99. doi:10,1242 / bio.017558. PMC 5051654. PMID 27402964.
- ^ Spector I, Shochet NR, Kashman Y, Groweiss A (únor 1983). „Latrunculiny: nové mořské toxiny, které narušují organizaci mikrofilament v kultivovaných buňkách“. Věda. 219 (4584): 493–5. doi:10.1126 / science.6681676. PMID 6681676.
- ^ Cayman Chemical (2017). "BEZPEČNOSTNÍ LIST Latrunculin A" (PDF).
- ^ A b C d Cheney KL, White A, Mudianta IW, Winters AE, Quezada M, Capon RJ, Mollo E, Garson MJ (2016-01-20). „Vyberte si svou zbraň: Selektivní skladování jediné toxické sloučeniny Latrunculin A úzce příbuznými nudibranchovými měkkýši“. PLOS ONE. 11 (1): e0145134. doi:10.1371 / journal.pone.0145134. PMC 4720420. PMID 26788920.
- ^ A b C Gillor O, Carmeli S, Rahamim Y, Fishelson Z, Ilan M (květen 2000). "Imunolokalizace toxinu latrunculinu B v houbě Negombata magnifica (Demospongiae, Latrunculiidae)". Mořská biotechnologie. 2 (3): 213–23. doi:10,1007 / s101260000026. PMID 10852799.
- ^ Ayscough KR, Stryker J, Pokala N, Sanders M, Crews P, Drubin DG (duben 1997). „Při použití inhibitoru aktinu latrunculin-A byly odhaleny vysoké rychlosti obratu aktinových vláken u začínajících kvasinek a role aktinu při vytváření a udržování polarity buněk.“. The Journal of Cell Biology. 137 (2): 399–416. doi:10.1083 / jcb.137.2.399. PMC 2139767. PMID 9128251.
- ^ A b Schubert T, Akopian A (2004). „Aktinová vlákna regulují napěťově řízené iontové kanály v salamandrových sítnicových gangliových buňkách“. Neurovědy. 125 (3): 583–90. doi:10.1016 / j.neuroscience.2004.02.009. PMID 15099672.
- ^ A b Houssen WE, Jaspars M, Wease KN, Scott RH (leden 2006). „Akutní působení mořského toxinu latrunculinu A na elektrofyziologické vlastnosti kultivovaných neuronů ganglií dorzálních kořenů“. Srovnávací biochemie a fyziologie. Toxikologie a farmakologie. 142 (1–2): 19–29. doi:10.1016 / j.cbpc.2005.09.006. PMID 16280258.
- ^ A b Khanfar MA, Youssef DT, El Sayed KA (únor 2010). „Semisyntetické deriváty latrunculinu jako inhibitory metastatického karcinomu prsu: biologická hodnocení, předběžný vztah mezi strukturou a aktivitou a studie molekulárního modelování“. ChemMedChem. 5 (2): 274–85. doi:10,1002 / cmdc.200900430. PMC 3529144. PMID 20043312.
- ^ A b Sayed KA, Khanfar MA, Shallal HM, Muralidharan A, Awate B, Youssef DT, Liu Y, Zhou YD, Nagle DG, Shah G (březen 2008). „Latrunculin A a jeho C-17-O-karbamáty inhibují invazi buněk prostaty a aktivaci HIF-1 v buňkách nádoru prsu“. Journal of Natural Products. 71 (3): 396–402. doi:10.1021 / np070587w. PMC 2930178. PMID 18298079.
- ^ Gonzalez JM, Ko MK, Pouw A, Tan JC (únor 2016). „Tkáňová multiphotonová analýza aktomyosinu a strukturálních odpovědí v lidské trabekulární síti“. Vědecké zprávy. 6 (1): 21315. doi:10.1038 / srep21315. PMC 4756353. PMID 26883567.
- ^ A b Rasmussen CA, Kaufman PL, Ritch R, Haque R, Brazzell RK, Vittitow JL (září 2014). „Latrunculin B snižuje nitrooční tlak u lidské oční hypertenze a primárního glaukomu s otevřeným úhlem“. Věda a technologie translační vize. 3 (5): 1. doi:10.1167 / tvst.3.5.1. PMC 4164113. PMID 25237590.
