Hofmann – Löfflerova reakce - Hofmann–Löffler reaction
| Reakce Hofmann – Löffler – Freytag | |
|---|---|
| Pojmenoval podle | August Wilhelm von Hofmann Karl Löffler Curt Freytag |
| Typ reakce | Reakce tvořící prsten |
The Hofmann – Löfflerova reakce (označovaný také jako Reakce Hofmann – Löffler – Freytag, Löffler – Freytagova reakce, Löffler – Hofmannova reakce, stejně jako Löfflerova metoda) je organická reakce ve kterém cyklický amin 2 (pyrrolidin nebo v některých případech piperidin ) je generován tepelným nebo fotochemickým rozkladem N-halogenovaný amin 1 v přítomnosti silné kyseliny (koncentrovaný kyselina sírová nebo koncentrované CF3CO2H ). Reakce Hofmann – Löffler – Freytag probíhá přenosem intramolekulárního atomu vodíku na radikál soustředěný na dusík a je příkladem vzdálené intramolekulární volné funkce radikálů C – H.[1]

Historická perspektiva
V roce 1878 byla struktura piperidin byl stále neznámý a A. W. Hofmann[2] pokusil se přidat k němu chlorovodík nebo brom ve víře, že sloučenina má nenasycenost (tj. provádí standard alken klasifikační testovací reakce). V průběhu studia A.W. Hofmann syntetizoval řadu N-haloaminy a N-haloamidy a zkoumali jejich reakce za kyselých a bazických podmínek.[3][4]Uvádí, že zpracování 1-brom-2-propylpiperidinu 3 za horka kyselina sírová, následovaný základním zpracováním, vedl k tvorbě terciárního aminu,[5][6] který byl později[7]ukázáno jako δ-konecein 4.

Ačkoliv se reakce Hofmann – Löffler – Freytag měla stát obecným a rychlým procesem tvorby pyrrolidinů, teprve asi 25 let po Hofmannově práci byly uvedeny další příklady reakce. V roce 1909 K. Löffler a C. Freytag rozšířili rozsah této transformace na jednoduché sekundární aminy a demonstrovali syntetickou užitečnost procesu, jak dokládá jejich elegantní syntéza nikotin 6 od N-bromo-N-methyl-4- (pyridin-3-yl) butan-l-amin 5.[8][9][10]

Reakční mechanismus
Mechanistické studie
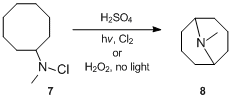
Ačkoli reakce byla poprvé zaznamenána v roce 1883, její mechanické podrobnosti byly objasněny koncem padesátých let. Mechanismus reakce Hofmann – Löffler – Freytag nejprve zkoumal S. Wawzonek, který studoval cyklizace reakce různých N-halogenované aminy.[11][12][13] V roce 1949 Wawzonek a Thelan[11] oznámil, že řešení N-chlorN-methylcyklooktylamin 7 palců kyselina sírová při ozáření ultrafialovým světlem v přítomnosti chlór nebo při léčbě peroxid vodíku ve tmě poskytl až 24% výtěžek N-methylgranatinin 8, mnohem více, než se tvoří za nepřítomnosti světla a peroxidu. Na základě těchto důkazů správně navrhli, aby reakce probíhala cestou radikální řetězové reakce. Přesněji řečeno, Wawzonek a Thelan[11] navrhl, že N-chloramin je nejprve protonován kyselinou a poté podroben homolytickému štěpení pod vlivem tepla, světla nebo jiných iniciátorů za vzniku volných radikálů amonia a chloridu. Amonný radikál intramolekulárně abstrahuje stéricky zvýhodněný atom vodíku za vzniku alkylového radikálu, který při řetězové reakci abstrahuje chlor od jiného N-chloramonný iont za vzniku alkylchloridu a nového amonného radikálu. Alkylchlorid se později cyklizuje pod vlivem zásady a vznikají cyklické terciární aminy.[14]
Podrobnější mechanistické studie provedl E. J. Corey et al., který zkoumal několik rysů reakce relevantní pro mechanismus: stereochemie, účinek izotopu vodíku, iniciace, inhibice, katalýza, meziprodukty a selektivita přenosu vodíku.[15] Výsledky, uvedené níže, přesvědčivě poukázaly na mechanismus volných radikálů zahrnující přenos intramolekulárního vodíku jako jeden z kroků šíření.
- Stereochemie
Aby bylo možné určit, zda nahrazení vodíku při cyklizaci N-haloaminy probíhají s retencí, inverzí nebo ekvilibrací konfigurace, byl syntetizován deuterovaný amin 9. Chlorace 9 následovaná jeho tepelným rozkladem N-chlorderivát 10 v kyselině sírové při 90 ° C produkoval opticky neaktivní 1,2-dimethylpyrrolidin. Toto experimentální pozorování bylo silným důkazem ve prospěch intermediacie druhu se sp2-hybridizovaný δ-uhlík.

- Izotopový efekt
Účinek izotopu vodíku na náhradu δ-H při rozkladu 10 byl stanoven analýzou směsi 1,2-dimethylpyrrolidinu 11 a 1,2-dimethylpyrrolidin-2-d 12 pro obsah deuteria. Spalovací analýza směsi deuterovaných a nedeuterovaných 1,2-dimethylpyrrolidinů poskytla hodnotu 0,78 atomu deuteria na molekulu, což odpovídá izotopovému účinku (kH/kD) z 3,54. Hodnota izotopového efektu byla ověřena nezávislou metodou deuteriové analýzy, která se opírá o srovnání intenzity absorpcí roztažení CD v infračerveném spektru smíšených 1,2-dimethylpyrrolidinů z cyklizace 10 s čistým vzorkem 1 , 2-dimethylpyrrolidin-2-d 12; vytvořená IR analýza kH/kD z 3,42, což je v souladu s analýzou spalování. Provedené studie k určení kH/kD pro cyklizaci na primární uhlík také dal kH/kD>> 1, což silně naznačuje, že k rozbití vazby CH dochází v přechodném stavu v poměrně značné míře.
- Iniciace, inhibice, katalýza
Bylo pozorováno, že N-chlorodi-n-butylamin byl stabilní v 85% H2TAK4 při 25 ° C ve tmě, ale brzy po ozáření UV zářením to začalo mizet. Bylo zjištěno, že reakce má indukční období asi 12 minut po začátku ozařování, ale byla téměř úplně odstraněna, když byla reakce prováděna v atmosféře dusíku; za podmínek bez kyslíku významné zvýšení rychlosti rozkladu katalyzovaného světlem N-haloaminy byly hlášeny. Tato pozorování poskytla silný důkaz inhibice reakce molekulárním kyslíkem.
Rovněž bylo zjištěno, že přidání katalytického množství Fe2+ soli k roztoku dibutylchloraminu v H2TAK4 ve tmě mělo za následek zmizení chloroaminu; N-butylpyrrolidin byl izolován v dobrém výtěžku po zpracování. Toto pozorování bylo jasným znamením, že rozklad chloroaminu je řetězová reakce volných radikálů iniciovaná Fe2+ iont v procesu oxidace a redukce.
Další výzkumy prokázaly, že jak rychlost ultrafialového katalyzovaného rozkladu dibutylchloraminu, tak výtěžek nově vytvořeného pyrrolidinu jsou silně závislé na kyselosti reakčního média - byla pozorována rychlejší a výtěžnější reakce se zvyšující se koncentrací kyseliny sírové.
Důležitou otázkou při diskusi o roli kyseliny je, zda N-haloamin v iniciačním kroku reaguje ve volné formě nebo ve formě soli. Na základě pKA hodnoty konjugovaných kyselin 2 ° alkyl aminů (které jsou obvykle v rozmezí 10–11), je zřejmé, že N-chloraminy existují převážně ve formě solí v roztoku vysokého obsahu kyselina sírová koncentrace. Výsledkem je, že v případě chemické nebo tepelné iniciace lze rozumně předpokládat, že se jedná o N-chloramonný iont, který poskytuje amonný volný radikál. Situace se však změní, když je reakce zahájena po ozáření UV zářením. Radiace musí být absorbována a kvantum dopadajícího světla musí být dostatečně velké, aby disociovalo vazbu N-Cl, aby mohlo dojít k fotochemické reakci. Protože konjugované kyseliny z N-chloraminy nemají znatelnou absorpci UV nad 225 mμ, zatímco volné N- chloramin absorbuje UV světlo s dostatečnou energií, aby způsobil disociaci (λmax 263 mμ, εmax 300),[16] E. J. Corey předpokládal, že v tomto případě se jedná o malé procento zdarma N-chloramin, který je zodpovědný za většinu iniciace. Rovněž bylo navrženo, aby nově generovaný neutrální dusíkový radikál byl okamžitě protonován. Je však důležité si uvědomit, že alternativní scénář může být v provozu, když je reakce zahájena UV zářením; jmenovitě zdarma N-haloamin nemusí po ozáření projít disociací, ale místo toho může fungovat jako fotosenzibilizátor. I když bylo navrženo, že vyšší koncentrace kyseliny snižuje rychlost iniciačního kroku, kyselá katalýza zahrnuje zrychlení kroků šíření a / nebo zpomalení ukončení řetězce. Vliv určitých kyselých rozpouštědel na fotolytickou reakci Hofmann – Löffler – Freytag byl také studován Nealem a spolupracovníky.[17]
- Meziprodukty
Izolace 4-chlorodibutylaminu z rozkladu dibutylchloraminu v H2TAK4 potvrdila intermediacu δ – chloroaminů.[13] Když se kyselý roztok zalkalizuje, δ-chloroamin cyklizuje za vzniku cyklického aminu a chloridového iontu.
- Selektivita přenosu vodíku
Za účelem stanovení strukturních a geometrických faktorů ovlivňujících intramolekulární přenos atomu vodíku existuje řada různých N-chloraminy byly zkoumány v reakci Hofmann – Löffler – Freytag. Systémy byly uvážlivě vybrány tak, aby získaly údaje o následujících bodech: relativní migrační tendence primárního (1 °), sekundárního (2 °) a terciárního (3 °) vodíku; relativní rychlosti přeskupení 1,5 a 1,6 vodíku; a zařízení přeskupení vodíku v cyklických systémech s omezenou geometrií.
Vyšetřování rozkladu volných radikálů N-chlorbutylamylamin 13 se nechá určit 1 ° vs. 2 ° migrace vodíku. Bylo hlášeno, že pouze 1-n-butyl-2-methylpyrrolidin 14 byl vytvořen za reakčních podmínek, žádný 1-n-amylpyrrolidin 15 byl detekován. Toto pozorování poskytlo podstatné důkazy o tom, že radikální útok vykazuje silnou preferenci pro 2 ° nad 1 ° vodík.

Tendence migrace vodíku 3 ° proti 1 ° byla studována pomocí n-butylisohexylamin 16. Když byla sloučenina 16 vystavena standardním reakčním podmínkám, bylo pozorováno rychlé vymizení sloučeniny 16, ale nemohl být izolován žádný pyrrolidinový produkt. Tento výsledek naznačuje, že existuje vysoká selektivita pro 3 ° vodík, ale meziproduktová terciární chlorosloučenina 17 je rychle solvolyzována.

Podobně nebyl pozorován žádný cyklický amin při reakci n-amylisohexylamin, který prokazuje selektivitu pro 3 ° vs. 2 ° migrace vodíku.
Kvalitativní studie produktů z reakce Hofmann – Löffler – Freytag společnosti N-chlormethyl-nbyl proveden -hexylamin 18 za účelem vyhodnocení relativní snadnosti migrace 1,5- a 1,6-vodíku. UV rozkladem katalyzovaný rozklad sloučeniny 18 s následnou alkalizací poskytl směs 1-methyl-2-ethylpyrrolidinu 19 a 1,2-dimethylpiperidinu 20 v poměru 9: 1, což ukazuje, že lze pozorovat rozsah tvorby šestičlenných kruhů.

Z hlediska geometrických požadavků v intramolekulárním přesmyku vodíku bylo pozorováno, že za stejných reakčních podmínek UV-katalyzovaný rozklad methylcyklohexylchloroaminu a N-chlorazacykloheptan probíhá mnohem pomaleji než u dibutylchloroaminu. Tato zjištění naznačují, že převládající geometrie jsou v těchto dvou případech nepříznivé, aby došlo k přesmyku, a nelze snadno dosáhnout úhlu vazby Cδ – H – N potřebného pro intramolekulární přenos vodíku.
Obecně přijímaný mechanismus
Obecně se uznává, že prvním krokem reakce Hofmann – Löffler – Freytag provedené v kyselém prostředí je protonace N-halogenovaný amin 21 za vzniku odpovídajícího N-halogenovaná amonná sůl 22. V případě tepelného nebo chemického zahájení řetězové reakce volných radikálů se: Nhalogenovaná amonná sůl 22 podléhá homolytickému štěpení vazby dusík-halogen za vzniku radikálového kationu 23. Centrovaného v dusíku. Naopak se tvrdilo, že iniciace katalyzovaná UV zářením zahrnuje volnou formu N-haloamin a rychlá protonace nově vytvořeného neutrálního dusíkatého radikálu (argumenty podporující toto tvrzení viz část věnovaná mechanistickým studiím). Intramolekulární přenos 1,5-atomu vodíku produkuje radikál 24 zaměřený na uhlík, který následně oddělí atom halogenu z N-halogenovaná amonná sůl 22. Získá se protonovaný 5-halogenovaný amin 25 a regeneruje se radikálový kation 23 se středem dusíku, nosič řetězce při reakci. Po ošetření bází podstoupí 25 deprotonaci následovanou intramolekulárním SN2 reakce, čímž se získá pyrrolidin 28 meziproduktem 27.
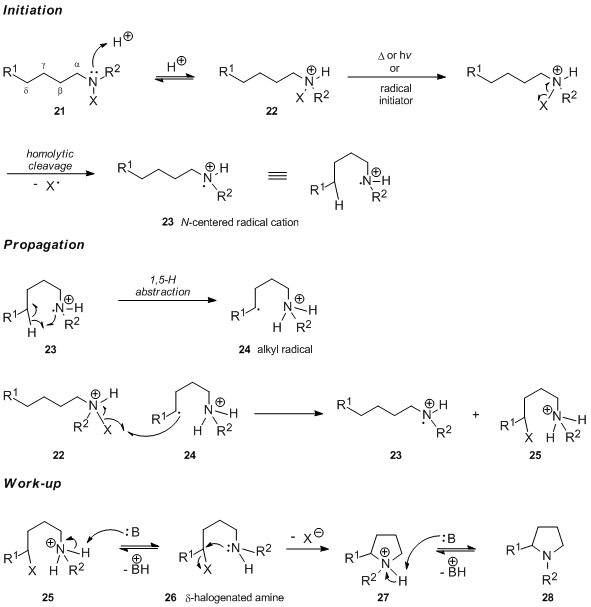
Preferenční abstrakce atomu δ – vodíku odpovídá šestičlennému přechodovému stavu, který může přijmout nenapjatou konformaci cyklohexanového křesla 29.

Reakce Hofmann – Löffler – Freytag koncepčně souvisí se známým Bartonova reakce.
Obecné rysy reakce
- Výchozí materiál pro reakci Hofmann – Löffler – Freytag by mohl být N-chloro-, N-bromo- a N-jodoaminy. V případě iniciace tepla N-chloraminy poskytují lepší výtěžky pyrrolidinům, protože N-bromoaminy jsou tepelně méně stabilní než odpovídající N-chloraminy.[18] Naproti tomu, když je iniciace prováděna ozářením, je N-bromoaminy dávají pyrrolidiny vyšší výtěžek.[11][ověření se nezdařilo ]
- Hofmann – Löffler – Freytagova reakce byla původně prováděna za kyselých podmínek, ale bylo prokázáno, že mohou být úspěšně použity i neutrální nebo dokonce slabě bazické podmínky.[19][20]
- Původně vytvořený radikál soustředěný na dusík abstrahuje atom H většinou z polohy 5, a tak se tvoří převážně 5členné kruhy.
- Je také možné vytvoření šestičlenných kruhů, ale relativně vzácné a ve většině případů je pozorováno u rigidních cyklických systémů.[11]
- Reakce může být provedena za mírnějších podmínek za předpokladu, že alkylový radikál zažije nějakou formu další stabilizace, např. sousedním heteroatomem.[20]
- Radikální proces může být zahájen zahřátím, ozářením světlem nebo radikálovými iniciátory (např. Peroxidy, kovové soli).
Úpravy a vylepšení
Protože původní silně kyselé reakční podmínky často nejsou kompatibilní s citlivými funkčními a ochrannými skupinami komplexních substrátů, bylo zavedeno několik modifikací reakce Hofmann – Löffler – Freytag:
- M. Kimura a Y. Ban prokázali, že sousední atomy dusíku mohou stabilizovat radikální druhy generované abstrakcí atomů H a umožnit, aby tento krok probíhal za slabě bazických podmínek[20][21] Uvádějí, že daleko lepšího výtěžku se dosáhne fotoiradiací v přítomnosti triethylaminu, který neutralizuje chlorovodík generovaný cyklizací. M. Kimura a Y. Ban použili modifikované podmínky reakce Hofmann – Löffler – Freytag na syntézu dihydrodeoxyepiallocernuinu 35.[20]

- Bylo prokázáno, že fotolýza N-haloamidy probíhají efektivně za neutrálních podmínek. Ozařování N-bromoamid 36 (R =tBu) poskytl brommethyl-cyklohexan-amid 37, který po zpracování bází in situ poskytl iminolakton 38 v 92% výtěžku.[22]

Podobně S. W. Baldwin a T. J. Doll zkoumali modifikaci reakce Hofmann – Löffler – Freytag během studií zaměřených na syntézu alkaloidu gelsemicinu 41. Tvorba pyrrolidinového kruhu 40 byla dosažena ozářením N-chloroamid 39.[19]

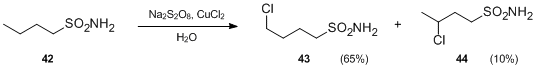
- Další variace reakce Hofmann – Löffler – Freytag zahrnuje sulfonamidy místo N-haloaminy. V přítomnosti persíranů a solí kovů mohou sulfonamidy podstoupit intramolekulární radikálovou funkcionalizaci za vzniku γ- a δ-chloralkenylsulfonamidů za neutrálních podmínek. Například při léčbě Na2S2Ó8 a CuCl2butylsulfonamid 42 byl transformován na 4-chlorbutylsulfonamid 43 a 3-chlorbutylsulfonamid 44 v nepřítomnosti kyseliny.[23]
- Nejdůležitější variantou reakce Hofmann – Löffler – Freytag je Suárezova modifikace. V roce 1980 Suárez et al.[24] uvádí proces využívající neutrální podmínky pro reakci Hofmann – Löffler – Freytag z N-nitroamidy. Další vývoj této transformace vedl k rozšíření rozsahu substrátu na N-kyanamidy, N-fosforamidáty a karbamáty.[25][26][27][28][29] Všechny tyto druhy reagují s hypervalentními jodovými činidly v přítomnosti jodu (I.2) generovat radikál zaměřený na dusík homolytickou fragmentací hypotetického jodamidového meziproduktu. Takto vytvořené N-radikály se mohou účastnit intramolekulární reakce na odběr 1,5-vodíku z neaktivních uhlíků, což má za následek tvorbu pyrrolidinů.

Velkou výhodou Suárezova modifikace je, že reakce může být provedena za velmi mírných neutrálních podmínek kompatibilních se stabilitou ochranných skupin nejčastěji používaných v syntetické organické chemii. V důsledku toho umožňuje použití reakce Hofmann – Löffler – Freytag s citlivějšími molekulami. Další pozoruhodné rysy této metodiky jsou následující: (1) nestabilní jodamidové meziprodukty jsou generovány in situ; (2) homolýza jodoamidu probíhá tepelně při nízké teplotě (20–40 ° C) nebo ozařováním viditelným světlem, což vylučuje potřebu UV lampy. The Suárezova modifikace našel četné aplikace v syntéze (viz níže).
- Nagib a spolupracovníci použili trijodidovou strategii, která rozšiřuje rozsah reakce Hofmann – Löffler – Freytag prostřednictvím Suárezova modifikace umožnit aminaci sekundárních CH vazeb.[30] Tento přístup využívá NaI místo I2, jako radikální předchůdce prevence nežádoucích I2- zprostředkované cesty rozkladu. Další halogenidové soli (např. NaCl a NaBr) poskytují postulované meziprodukty přerušeného mechanismu Hofmann – Löffler – Freytag.
Aplikace v syntéze
Nejrozšířenější syntetickou utilitou reakce Hofmann – Löffler – Freytag je sestavení pyrrolidinového kruhu.
Hofmann – Löffler – Freytagova reakce za standardních podmínek
Postup reakce Hofmann – Löffler – Freytag tradičně vyžaduje silně kyselé podmínky, což omezuje jeho přitažlivost. Nicméně, to bylo úspěšně aplikováno na funkcionalizaci široké škály strukturně rozmanitých molekul, jak je uvedeno níže.
V roce 1980 J. P. Lavergne. et al.[31] použil tuto metodiku k přípravě L-prolin 49.

P. E. Sonnet a J. E. Oliver[32] použil klasické reakční podmínky Hofmann – Löffler – Freytag při syntéze potenciálních prekurzorů pohlavních feromonů mravenců (tj. oktahydroindolizinu 51).

Dalším příkladem konstrukce bicyklického aminu prostřednictvím standardní metodiky Hofmann – Löffler – Freytag je Waegellova syntéza[33] azabicyklo [3.2.1] oktanového derivátu 53.
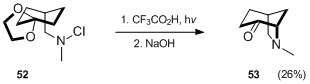
Hofmann – Löffler – Freytagova reakce byla použita k syntéze přemostěné dusíkové struktury (±) -6,15,16-iminopodokarpanu-8,11,13-trienu 55, meziproduktu použitelného pro přípravu alkaloidů kobusinového typu, z bicyklického chloroaminu 54.[34] Ozařování 54 vysokotlakou rtuťovou výbojkou 400 W v kyselina trifluoroctová pod atmosférou dusíku při teplotě místnosti po dobu 5 hodin poskytl střední výtěžek produktu.

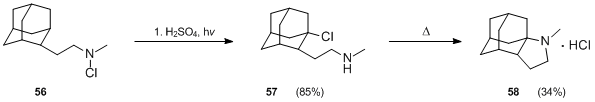
Deriváty adamantan byly také připraveny pomocí reakce Hofmann – Löffler – Freytag.[35] Když N-chloramin 56 byl ošetřen kyselina sírová a teplo, 2-adamantanon vznikl, ale fotolýza sloučeniny 56 ve směsi kyseliny sírové a kyseliny octové za použití nízkotlaké rtuťové lampy po dobu 1 hodiny poskytla dobrý výtěžek (85%) požadovaného produktu 57. Cyklizace sloučeniny 57 značné obtíže, ale nakonec to bylo dosaženo v 34% výtěžku za podmínek nucení (zahřívání na 290 ° C po dobu 10 minut).
Obdobně to bylo prokázáno[36] že deriváty diaza-2,6 adamantanu, jako je 60, mohou vznikat za standardních reakčních podmínek Hofmann – Löffler – Freytag; výnosy jsou však jen mírné.

R. P. Deshpande a U. R. Nayak[37] uvádí, že reakce Hofmann – Löffler – Freytag je použitelná pro syntézu pyrrolidinů obsahujících a longifolene jádro, např. 62.

Vynikající aplikace reakce Hofmann – Löffler – Freytag se nachází při přípravě steroidní alkaloid deriváty. J. Hora[38] a G. van de Woude[39][40][41] použili tento postup při syntéze konessin deriváty uvedené níže.

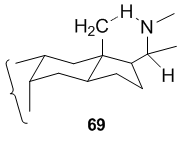
V případě 64 a 66 je pětičlenný dusíkový kruh vytvořen útokem na neaktivovanou methylovou skupinu C-18 prekurzoru (63, respektive 65) vhodně umístěným radikálem se středem dusíku na C-20. Snadnost této reakce je dána skutečností, že v rigidní steroidní struktuře jsou β-C-18 methylová skupina a β-C-20 postranní řetězec nesoucí dusíkový radikál vhodně uspořádány v prostoru, aby umožnily 1,5 -odstoupení vodíku, které bude probíhat prostřednictvím šestičlenného přechodového stavu.
Reakce Hofmann – Löffler – Freytag za mírných podmínek
V části věnované změnám a vylepšením původních reakčních podmínek byla uvedena řada příkladů reakce Hofmann – Löffler – Freytag za neutrálních podmínek. Proto je hlavním zaměřením této části aplikace Suárezova modifikace reakce Hofmann – Löffler – Freytag.
The Suárezova modifikace reakce Hofmann – Löffler – Freytag byl základem nové syntetické metody vyvinuté H. Togem et al.[42][43] Autoři prokázali, že různé N-alkylsachariny (N-alkyl-1,2-benzisothiazolin-3-on-1,1, -dioxidy) 77 se snadno připravují ve středních až dobrých výtěžcích reakcí N-alkyl (Ó-methyl) arensulfonamidy 70 s PhI (OAc)2 v přítomnosti jód pod ozářením wolframovou lampou. 1,5 -Odběr vodíku / jodace Ó-methylová skupina se opakuje třikrát a nejpravděpodobněji po ní následuje cyklizace na dijodo meziprodukt 76, který poté podstoupí hydrolýzu.

Velmi zajímavá transformace je pozorována, když jsou sulfonamidy primárních amidů nesoucích aromatický kruh v poloze y ošetřeny různými jodany a jodem za ozařování wolframovou lampou.[44] Reakce vede k 1,2,3,4-tetrahydrochinolinovým derivátům a je dobrou přípravnou metodou šestičlenných cyklických aromatických aminů. Například sulfonamid 78 prochází intramolekulární radikálovou cyklizací, čímž se získá 79 v relativně dobrém výtěžku.

Stejným postupem se 3,4-dihydro-2,1-benzothiazin-2,2-dioxidy 81 získají z N-alkyl-2- (aryl) ethansulfonamidy přes sulfonamidyl.[45]

E. Suárez et al.[46] uvádí, že amidylové radikály meziprodukty, vyrobené fotolýzou středních laktamů, např. 82 v přítomnosti PhI (OAc)2 a jod, podrobit se transanulární abstrakci vodíku, aby se získaly intramolekulárně funkcionalizované sloučeniny, jako jsou oxoindolizidiny 83.

E. Suárez a spolupracovníci[27] také uplatnili svou metodiku při syntéze chirálních 8-oxa-6-azabicyklo [3.2.1] -oktanových 85 a 7-oxa-2-azabicyklo [2.2.1] heptanových 87 kruhových systémů. Tuto reakci lze považovat za intramolekulární N-glykosidace, která prochází intramolekulární abstrakcí 1,5-vodíku podporovanou an N-amido radikál následovaný oxidací přechodného meziproduktu C-radikálu na oxykarboniový iont, který je následně zachycen vnitřním nukleofilem.

Užitečnost Suárezova modifikace reakce Hofmann – Löffler – Freytag byla demonstrována jeho aplikací při syntéze řady steroidních a triterpenových sloučenin.[25][26][28][29][47] Jak je ilustrováno níže, funkcionalizace iniciované fosforamidátem obecně probíhají ve vyšších výtěžcích než reakce, kterých se to týká N-nitro nebo N-kyanamidy.

V roce 2008 Baran et al.[48] uvádí novou metodu pro syntézu 1,3-diolů za použití varianty reakce Hofmann – Löffler – Freytag.

V roce 2017 Nagib et al.[49][50] popsali novou metodu pro syntézu 1,2-aminoalkoholů s využitím varianty reakce Hofmann – Löffler – Freytag na podporu β-selektivní C-H aminace alkoholů. V roce 2020 byla stejným týmem zveřejněna asymetrická varianta.[51]

Viz také
Reference
- ^ Majetich, G .; Wheless, K. (1995). Msgstr "Vzdálené intramolekulární funkcionalizace volnými radikály: aktualizace". Čtyřstěn. 51 (26): 7095–7129. doi:10.1016 / 0040-4020 (95) 00406-X.
- ^ Hofmann, A. W. (1879). „Zur Kenntniss des Piperidins und Pyridins“. Ber. Dtsch. Chem. Ges. 12 (1): 984–990. doi:10,1002 / cber.187901201254.
- ^ Hofmann, A. W. (1881). „Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide“. Ber. Dtsch. Chem. Ges. 14 (2): 2725–2736. doi:10.1002 / cber.188101402242.
- ^ Hofmann, A. W. (1883). „Ueber die Einwirkung des Broms in alkalischer Lösung auf die Amine“. Ber. Dtsch. Chem. Ges. 16 (1): 558–560. doi:10,1002 / cber.188301601120.
- ^ Hofmann, A. W. (1885). „Zur Kenntniss der Coniin-Gruppe“. Ber. Dtsch. Chem. Ges. 18 (1): 5–23. doi:10,1002 / cber.18850180103.
- ^ Hofmann, A. W. (1885). „Zur Kenntniss der Coniin-Gruppe“. Ber. Dtsch. Chem. Ges. 18 (1): 109–131. doi:10,1002 / cber.1850180126.
- ^ Lellmann, E. (1890). „Ueber die Coniceïne“. Ber. Dtsch. Chem. Ges. 23 (2): 2141–2142. doi:10.1002 / cber.18900230269.
- ^ Löffler, K .; Freytag, C. (1909). „Über eine neue Bildungsweise von N-alkylierten Pyrrolidinen“. Ber. Dtsch. Chem. Ges. 42 (3): 3427–3431. doi:10,1002 / cber.19090420377.
- ^ Löffler, K .; Kober, S. (1909). „Über die Bildung des i-Nicotins aus N-Methyl-p-pyridyl-butylamin (Dihydrometanicotin)“. Ber. Dtsch. Chem. Ges. 42 (3): 3431–3438. doi:10,1002 / cber.19090420378.
- ^ Löffler, K. (1910). „Über eine neue Bildungsweise N-alkylierter Pyrrolidine“. Ber. Dtsch. Chem. Ges. 43 (2): 2035–2048. doi:10,1002 / cber.191004302146.
- ^ A b C d E Wawzonek, S .; Thelan, P. J. (1950). "Příprava N-methylgranatanin ". J. Am. Chem. Soc. 72 (5): 2118–2120. doi:10.1021 / ja01161a068.
- ^ Wawzonek, S .; Thelan, M. F. Jr.; Thelan, P. J. (1951). "Příprava chinuklidinů". J. Am. Chem. Soc. 73 (6): 2806–2808. doi:10.1021 / ja01150a111.
- ^ A b Wawzonek, S .; Culbertson, T. P. (1959). „Tvorba 4-chlorodibutylaminu z N-chlorodibutylamin “. J. Am. Chem. Soc. 81 (13): 3367–3369. doi:10.1021 / ja01522a053.
- ^ Wolff, M. E. (1963). „Cyklizace N-halogenovaných aminů (Hofmann – Löfflerova reakce)“. Chem. Rev. 63 (1): 55–64. doi:10.1021 / cr60221a004.
- ^ Corey, E. J .; Hertler, W. R. (1960). "Studie tvorby haloaminů a cyklických aminů rozkladem volných radikálů řetězce N-halogenamoniové ionty (Hofmann-Löfflerova reakce) ". J. Am. Chem. Soc. 82 (7): 1657–1668. doi:10.1021 / ja01492a035.
- ^ Metcalf, W. S. (1942). „Absorpční spektra mono-, di- a trichloraminů a některých alifatických derivátů“. J. Chem. Soc.: 148–150. doi:10.1039 / JR9420000148.
- ^ Neale, R. S .; Walsh, M. R.; Marcus, N.L. (1965). „Vliv struktury rozpouštědel a chloraminů na produkty radikálního přesmyku N-Chlorodialkylaminy “. J. Org. Chem. 30 (11): 3683. doi:10.1021 / jo01022a022.
- ^ Coleman, G. H .; Goheen, G. E. (1938). "Příprava pyrrolidinů". J. Am. Chem. Soc. 60 (3): 730. doi:10.1021 / ja01270a512.
- ^ A b Baldwin, S. W .; Doll, T. J. (1979). „Syntéza 2-aza-7-oxatricyklo [4.3.2.04,8] undekanové jádro některých gelsemiových alkaloidů ". Tetrahedron Lett. 20 (35): 3275–3278. doi:10.1016 / S0040-4039 (01) 95383-3.
- ^ A b C d Ban, Y .; Kimura, M .; Oishi, T. (1976). „Syntéza (±) -dihydrodeoxyepiallocernuinu aplikací typu fotocyklizace typu Facile Hofmann-Loeffler. Chem. Pharm. Býk. 24 (7): 1490–1496. doi:10,1248 / cpb.24.1490.
- ^ Kimura, M .; Ban, Y. (1976). „Syntéza 1,3-diaza heterocyklů. Hofmann-Loefflerův typ fotocyklizace za nepřítomnosti silné kyseliny“. Syntéza. 1976 (3): 201–202. doi:10.1055 / s-1976-23992.
- ^ Chow, Y. L .; Mojelsky, T. W .; Magdzinski, L. J .; Tichy, M. (1985). "Chemie amidových radikálů: intramolekulární odběr vodíku ve vztahu k konfiguracím amidových radikálů". Umět. J. Chem. 63 (8): 2197–2202. doi:10.1139 / v85-361.
- ^ Nikishin, G. I .; Troyansky, E. I .; Lazareva, M. I. (1985). "Regioselektivní jednokroková γ-chlorace alkansulfonamidů. Preference reakce 1,5-H migrace ze sulfonylové skupiny na amidovou skupinu v sulfonylamidylových radikálech". Tetrahedron Lett. 26 (31): 3743–3744. doi:10.1016 / S0040-4039 (00) 89238-2.
- ^ Hernández, R .; Rivera, A .; Salazar, J. A .; Suárez, E. (1980). „Nitroaminové radikály jako meziprodukty při funkcionalizaci neaktivních atomů uhlíku“. J. Chem. Soc., Chem. Commun. (20): 958–959. doi:10.1039 / C39800000958.
- ^ A b De Armas, P .; Francisco, C. G .; Hernández, R .; Salazar, J. A .; Suárez, E. (1988). „Steroidní N-nitroaminy. Část 4. Intramolekulární funkcionalizace N-nitroaminové radikály: syntéza sloučenin 1,4-nitroiminu ". J. Chem. Soc., Perkin Trans. 1 (12): 3255–3265. doi:10.1039 / P19880003255.
- ^ A b Carrau, R .; Hernández, R .; Suárez, E .; Betancor, C. (1987). "Intramolekulární funkcionalizace N-kyanamidové radikály: syntéza 1,4- a 1,5-N-kyanoepimino sloučeniny “. J. Chem. Soc., Perkin Trans. 1: 937–943. doi:10.1039 / P19870000937.
- ^ A b Francisco, C. G .; Herrera, A. J .; Suárez, E. (2003). "Intramolekulární reakce na odběr vodíku podporovaná N-Radikály v sacharidech. Syntéza chirálních 7-oxa-2-azabicyklo [2.2.1] heptanu a 8-oxa-6-azabicyklo [3.2.1] oktanových kruhových systémů ". J. Org. Chem. 68 (3): 1012–1017. doi:10.1021 / jo026314h. PMID 12558429.
- ^ A b Betancor, C .; Concepción, J. I .; Hernández, R .; Salazar, J. A .; Suárez, E. (1983). "Intramolekulární funkcionalizace neaktivních uhlíků amidylfosfátovými radikály. Syntéza 1,4-epiminových sloučenin". J. Org. Chem. 48 (23): 4430–4432. doi:10.1021 / jo00171a066.
- ^ A b De Armas, P .; Carrau, R .; Concepción, J.I .; Francisco, C.G .; Hernández, R .; Suárez, E. (1985). "Syntéza sloučenin 1,4-epiminu. Jodosobenzen diacetát, účinné činidlo pro tvorbu neutrálních dusíkatých radikálů". Tetrahedron Lett. 26 (20): 2493–2496. doi:10.1016 / S0040-4039 (00) 94862-7.
- ^ A., Wappes, Ethan; C., Fosu, Stacy; C., Chopko, Trevor; A., Nagib, David (16. srpna 2016). „Trijodidem zprostředkovaná δ-aminace sekundárních C-H vazeb“. Angewandte Chemie International Edition. 55 (34): 9974–9978. doi:10,1002 / anie.201604704. ISSN 1521-3773. PMC 5166987. PMID 27384522.
- ^ Titouani, S.L .; Lavergne, J. P .; Viallefont, P .; Jacquier, R. (1980). „Nouvelles synthèses de l-amino-acid — I: Synthèse stèréospécifique de l-proline, cis(trans) méthyl-3 (4) l-prolinů “. Čtyřstěn. 36 (20–21): 2961–2965. doi:10.1016/0040-4020(80)88020-3.
- ^ Sonnet, P.E .; Oliver, J. E. (1975). "Syntéza hmyzích stopových feromonů: izomerní 3-butyl-5-methyloktahydroindoliziny". J. Heterocycl. Chem. 12 (2): 289–294. doi:10,1002 / jhet. 5570120215.
- ^ Esposito, G .; Furstoss, R .; Waegell, B. (1971). „Synthese de la methyl-6, aza-6, bicyklo (3,2,1) oktanon-4". Tetrahedron Lett. 12 (14): 899–902. doi:10.1016 / S0040-4039 (01) 96584-0.
- ^ Shibanuma, Y .; Okamoto, T. (1985). „Syntetický přístup k diterpenovým alkaloidům: konstrukce přemostěného azabicyklického kruhového systému Kobusine“. Chem. Pharm. Býk. 33 (8): 3187–3194. doi:10,1248 / cpb.33.3187.
- ^ Narayanan, V. L .; Setescak, L. (1971). "Syntéza 1-methyladamantano [1,2-b] pyrrolidinu, nového heterocyklického systému". J. Org. Chem. 33 (26): 4127–4129. doi:10.1021 / jo00825a026.
- ^ Dupeyre, R. M .; Rassat, A. (1973). „Application de la response de Hofmann-Löffler-Freytag synthese de derives diaza-2,6 adamantane“. Tetrahedron Lett. 14 (29): 2699–2701. doi:10.1016 / S0040-4039 (01) 96116-7.
- ^ Deshpande, R. P .; Nayak, UR (1979). Indian J. Chem. 17: 310. Chybějící nebo prázdný
| název =(Pomoc) - ^ Hora, J .; Sorm, F. (1968). "Na steroidech. CXIV. Syntéza 18-dimethylamino-3p-hydroxy-5a-androstan-17-onu a jeho 5β-izomeru". ChemPlusChem. 33 (7): 2059–2065. doi:10.1135 / cccc19682059.
- ^ Van De Woude, G .; van Hove, L. (1973). "Amino steroidy - deriváty konaninu a heterokonaninu". Býk. Soc. Chim. Belg. 82 (1–2): 49–62. doi:10.1002 / bscb.19730820105.
- ^ Van De Woude, G .; van Hove, L. (1975). "Amino steroidy - příprava 12-okysličených derivátů konaninu (částečná syntéza dihydroholarrheninu)". Býk. Soc. Chim. Belg. 84 (10): 911–922. doi:10.1002 / bscb.19750841001.
- ^ Van De Woude, G .; Biesemans, M .; van Hove, L. (1980). "Amino steroidy - funkcionalizace polohy 20 z polohy 18 v systému pregnanu prostřednictvím procesu Hofmann-Löffler. Převládající tvorba 5α-heteroconan-3β-ol". Býk. Soc. Chim. Belg. 89 (11): 993–1000. doi:10.1002 / bscb.19800891109.
- ^ Togo, H .; Katohgi, M .; Yokoyama, M. (1998). "Přímá příprava sacharinových koster z N-Metyl (o-methyl) arensulfonamidy s (Diacetoxyjod) areny ". Synlett. 1998 (2): 131–132. doi:10.1055 / s-1998-1615.
- ^ Katohgi, M .; Togo, H .; Yamaguchi, K .; Yokoyama, M. (1999). „Nová syntetická metoda pro 1,2-benzisothiazolin-3-on-1,1-dioxidy a 1,2-benzisothiazolin-3-on-1-oxidy z N-alkyl (o-methyl) arensulfonamidy ". Čtyřstěn. 55 (52): 14885–14900. doi:10.1016 / S0040-4020 (99) 00974-6.
- ^ Togo, H .; Hoshina, Y .; Muraki, T .; Nakayama, H .; Yokoyama, M. (1998). "Studie o radikální amidaci na aromatické kruhy s (Diacyloxyiodo) areny". J. Org. Chem. 63 (15): 5193–5200. doi:10.1021 / jo980450y.
- ^ Togo, H .; Harada, Y .; Yokoyama, M. (2000). "Příprava 3,4-dihydro-2,1-benzothiazin 2,2-dioxidového skeletu z N-Metyl 2- (aryl) ethansulfonamidy s (Diacetoxyjodo) areny ". J. Org. Chem. 65 (3): 926–929. doi:10.1021 / jo991419e.
- ^ Dorta, R.L .; Francisco, C. G .; Suárez, E. (1989). „Hypervalentní organojodové reagencie v transanulární funkcionalizaci středně velkých laktamů: syntéza 1-azabicyklo sloučenin“. Chem. Commun. (16): 1168–1169. doi:10.1039 / C39890001168.
- ^ Hernández, R .; Medina, M.C .; Salazar, J. A.; Suárez, E .; Prangé, T. (1987). "Intramolekulární funkcionalizace amidů vedoucí k laktamům". Tetrahedron Lett. 28 (22): 2533–2536. doi:10.1016 / S0040-4039 (00) 95460-1.
- ^ Baran, P. S .; Chen, K .; Richter, J. M. (2008). "Syntéza 1,3-diolu prostřednictvím řízené, radikálně zprostředkované C-H funkcionalizace". J. Am. Chem. Soc. 130 (23): 7247–7249. doi:10.1021 / ja802491q. PMID 18481847.
- ^ Wappes, Ethan A .; Nakafuku, Kohki M .; Nagib, David A. (2. srpna 2017). „Směrovaná β C – H aminace alkoholů pomocí radikálových reléových chaperonů“. Journal of the American Chemical Society. 139 (30): 10204–10207. doi:10.1021 / jacs.7b05214. ISSN 0002-7863. PMC 5940001. PMID 28741940.
- ^ Stateman, Leah M .; Wappes, Ethan A .; Nakafuku, Kohki M .; Edwards, Kara M .; Nagib, David A. (27. února 2019). „Katalytická aminace β C – H prostřednictvím imidátového radikálního relé“. Chemická věda. 10 (9): 2693–2699. doi:10.1039 / C8SC05685D. ISSN 2041-6539. PMC 6419930. PMID 30996986.
- ^ Nakafuku, Kohki M .; Zhang, Zuxiao; Wappes, Ethan A .; Stateman, Leah M .; Chen, Andrew D .; Nagib, David A. (22. června 2020). „Enantioselektivní radikál C – H aminace pro syntézu β-aminoalkoholů“. Přírodní chemie. 12 (8): 697–704. doi:10.1038 / s41557-020-0482-8. ISSN 1755-4349. PMC 7390680. PMID 32572164. S2CID 219976955.
