Kontrolní bod poškození G2-M DNA - G2-M DNA damage checkpoint - Wikipedia

The G2-M kontrolní bod poškození DNA je důležité kontrolní bod buněčného cyklu v eukaryotický organizmy, které zajišťují, že buňky se neiniciují mitóza dokud není poškozená nebo neúplně replikovaná DNA dostatečně opravena. Buňky, které mají vadný G2-M kontrolní bod, pokud vstoupí do M fáze před opravou své DNA, vede to k apoptóza nebo smrt po buněčném dělení.[1] Definujícím biochemickým rysem tohoto kontrolního bodu je aktivace M-fáze komplexy cyklin-CDK, které fosforylují proteiny, které podporují vřeteno shromáždění a přiveďte buňku metafáze.[2]
Cyklin B-CDK 1 aktivita
The buněčný cyklus je řízen bílkovinami zvanými cyklin dependentní kinázy které se stýkají s cyklin regulační proteiny na různých kontrolních bodech buněčného cyklu. V různých fázích buněčného cyklu dochází k aktivaci a / nebo deaktivaci specifických komplexů cyklin-CDK.
Aktivita CyclinB-CDK1 je specifická pro kontrolní bod G2 / M. Akumulace cyklin B zvyšuje aktivitu lidského homologu cyklin dependentní kinázy Cdk1 Cdc2 jak se buňky připravují na vstup do mitózy. Aktivitu Cdc2 dále reguluje fosforylace /defosforylace odpovídajících aktivátorů a inhibitorů. Prostřednictvím a Pozitivní zpětná vazba smyčka, CyclinB-Cdc2 aktivuje fosfatázu Cdc25 což zase deaktivuje inhibitory CyclinB-Cdc2, Wee1 a Myt1. Cdc25 aktivuje komplex odstraněním fosfátů z aktivního místa, zatímco Wee1 deaktivuje komplex fosforylací zbytků tyrosinu, konkrétně tyrosinu-15.[3]
Tato smyčka je dále nepřímo zesilována prostřednictvím koordinované interakce Aurora A kináza a kofaktor Bora. Během Fáze G2, Bora se hromadí a vytváří aktivační komplex s Aurorou A. Tento komplex pak reguluje aktivaci Kináza podobná pólu 1 (Plk1). Plk1 fosforyluje Wee1 a cílí jej na degradaci prostřednictvím komplexu SCF ubikvitin ligázy (SCF komplex ), a aktivuje Cdc25 fosforylací kombinovanou aktivací Cdc2. Kombinovaná aktivita a komplex Cdc2, Cdc25 a Plkl s akumulací cyklinu B aktivuje komplex CyclinB-Cdc2 a podporuje vstup do mitózy.[4]
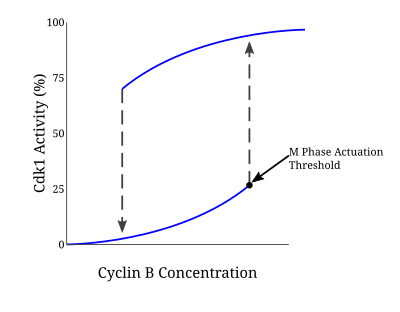
Mnoho proteinů zapojených do této smyčky pozitivní zpětné vazby řídí aktivaci komplexu CyclinB-Cdc2, protože vstup do mitózy vyžaduje reakci všeho nebo žádného. The Model Novak-Tyson je matematický model používaný k vysvětlení takové regulační smyčky, která předpověděla nevratný přechod do mitózy poháněné hysterezí.[5]Prostřednictvím experimentů v Xenopus laevis bezbuněčné vaječné extrakty, takový model byl potvrzen jako základ pro vstup do mitózy. Jakmile koncentrace cyklinu dosáhne určité minimální prahové hodnoty pro aktivaci, Cdc2 se rychle aktivuje. Zůstává v tomto stavu, dokud aktivita neklesne pod samostatnou prahovou hodnotu pro deaktivaci, při které je náhle inaktivována prostřednictvím fosforylace tyrosinu pomocí Wee1 a Myt1. V případě nereplikované DNA se prahová hodnota koncentrace cyklinu pro aktivaci Cdc2 dále zvyšuje. Prostřednictvím tohoto mechanismu existují dvě oddělené ustálené podmínky oddělené nestabilním ustáleným stavem. Bistabilní a hysteretická povaha CyclinB-Cdc2 zajišťuje vysoce regulovanou povahu kontrolního bodu G2 / M.[6]
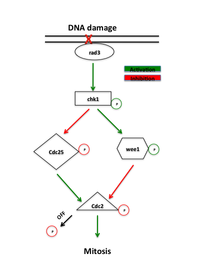
Cesta reakce na poškození DNA
Proteiny, které se lokalizují do míst poškození DNA ve fázi G2, iniciují signální kaskádu, která reguluje důležité složky dráhy, jak je popsáno výše, a proto řídí mitotický vstup prostřednictvím aktivity CyclinB-Cdc2. Negativní regulace aktivity CyclinB-Cdc2 vede ke zpoždění mitotického vstupu, což je důležité pro buňky k opravě poškození DNA, které se mohlo nahromadit po S fáze a nezbytné, než může buněčné dělení pokračovat.
Proteiny, které fungují v kontrolním bodě G2-M, byly původně identifikovány na kvasinkových obrazovkách, které hledaly mutanty, které vykazují zvýšenou citlivost na záření, nazývané "rad" mutanty.[1] Neúčinná oprava DNA poškozené ionizujícím zářením nebo chemickými látkami u těchto mutantů odhalila proteiny nezbytné v této cestě. Časné signální proteiny v dráze kontrolního bodu jsou členy rodiny fosfatidylinositol 3-kináz, rad3 v kvasinkách a ATR u obratlovců, o nichž se předpokládá, že se lokalizují do míst poškození DNA.[7] Rad3 fosforyluje rad26, který je vyžadován k zahájení, ale neudržení kontrolního bodu. Rad3 také fosforyluje řadu dalších proteinů, jejichž nepřítomnost ruší opravu DNA kontrolního bodu, včetně rad1, rad9, hus1 a rad17.[1] Předpokládá se, že rad9, hus1 a rad17 jsou podobné proteinům podílejícím se na tvorbě svorky, která zvyšuje procesivita z DNA polymeráza v době replikace DNA.[8] V souladu s touto myšlenkou je rad17 podobný proteinům zapojeným do zavádění svorky na DNA. To podporuje model, kde fosforylace rad3 způsobuje nábor těchto proteinů do míst poškození DNA, kde zprostředkovávají aktivitu DNA polymeráz zapojených do Oprava DNA.[1]
Hlavním efektorem rad3 je kináza Chk1, který je nutný pro zastavení G2-M v reakci na látky poškozující DNA.[9]Chk1 je efektorová protein kináza, která udržuje mitotický cyklin v neaktivním stavu a je fosforylována rad3 mezi S fází a mitózou, což implikuje jeho specifickou roli při zástavě G2.[10]Své upregulace přes nadměrná exprese může vyvolat zatčení nezávisle na poškození DNA.[11]Nadměrná exprese Chk1 navíc zachraňuje radiační citlivost rad mutantů, pravděpodobně tím, že umožňuje opravu DNA před vstupem do mitózy.[7]
Přítomnost poškození DNA spouští bankomat (Mutovaná Ataxia telangiectasia) nebo ATR (Související s Ataxia Telangiectasia a Rad3), které aktivují kinázy Chk2 a Chk1. Tyto kinázy působí před Cdc25 a Wee1, přímými regulátory komplexu CyclinB-Cdc2. Chk1 a Chk2 fosforylují Cdc25, inhibují jeho fosforylační aktivitu a označují je pro ubikvitinovanou degradaci.[11][12]Tyto dráhy také stimulují tumor supresor p53. p53 reguluje funkci inhibitoru Cdk2 p21 a 14-3-3 bílkovin že fosforylují (a tím inaktivují) a sekvestrují Cdc25 v cytoplazmě.[13]Nedávné studie také naznačují, že Cdk1 a 14-3-3 pozitivně regulují Wee1 podobným způsobem. The hyperfosforylace Wee1 by Cdk1 umožňuje vazbu 14-3-3, sekvestrování Wee1 k jádru a zvýšení jeho schopnosti fosforylovat Cdc2.[14] Fosforylace Wee1 i Cdc25 brání aktivaci Cdc2.[12]
Dráha ATM / ATR také vede k negativní regulaci Plk1, která přispívá ke stabilitě Wee1. Stabilizace Wee1 a Myt1 zajišťuje zastavení buněk v G2 a umožňuje opravu DNA.[13][15]
Do reakce kontrolního bodu je zapojeno více cest, a proto není cílení Cdc25 jediným mechanismem, který je základem zpoždění buněčného cyklu, jak navrhují některé modely. The spolupráce mezi pozitivní regulací Wee1 a negativní regulací Cdc25 Chk1 v reakci na nereplikovanou nebo poškozenou DNA vede k silnému zastavení G2.[1][11][13][15] Zvýšení množství Wee1 a snížení množství Cdc25 přispívá ke zvýšení prahové hodnoty koncentrace cyklinu B v hysterezní smyčce potřebné k zavedení buňky do mitózy.
Údržba kontrolního bodu
Rad3 je vyžadován pro aktivaci Chkl a zahájení zástavy G2, ale předpokládá se, že různé proteiny udržují zástavu G2, aby mohlo dojít k dostatečné opravě DNA. Jeden takový protein je rad18 to je nutné pro zástavu G2, i když je Chk1 fosforylovaný a aktivní. Rad18 je tedy vyžadován pro údržbu kontrolního bodu G2 / M, zatímco Chk1 je vyžadován pro spuštění kontrolního bodu.[16] To je dále podporováno jeho další funkcí při opravě DNA, konkrétně při udržování chromozomálních struktur. Jeho nezbytnost se prokazuje skutečností, že při absenci rad18 není DNA schopna opravit, i když je zástava G2 prodloužena jinými prostředky.
Udržování takového zadržení ve fázi G2 je dále udržováno p53 a p21. Při absenci p53 nebo p21 bylo prokázáno, že vyzařované buňky postupovaly do mitózy.[17] Absence p21 nebo 14-3-3 nemůže dostatečně inhibovat komplex CyclinB-Cdc2, čímž vykazuje regulační kontrolu p53 a p21 v kontrolním bodě G2 v reakci na poškození DNA.[12] Mutace p53 mohou vést k významnému deficitu kontrolního bodu, což má důležité důsledky při léčbě rakoviny.
Deaktivace kontrolního bodu
Deaktivace oba Wee1 a Cdc25 ruší kontrolní bod poškození DNA G2-M. Absence Wee1 nebo odstranění místa tyrosinu-15 odstraňuje negativní regulaci aktivity Cdc2 a způsobuje, že buňky vstupují do mitózy bez dokončení opravy, což účinně ruší kontrolní bod G2-M.[18] Absence Cdc25 zadržuje buňky v G2, ale stále umožňuje aktivaci kontrolního bodu G2-M, což znamená, že aktivace Wee1 a deaktivace Cdc25 jsou důležitými regulačními kroky v kontrolním bodě.[11]
Inaktivace Chk1 je dostatečná k překročení kontrolního bodu a podpoře vstupu do mitózy, bez ohledu na to, zda je poškození DNA opraveno. Stále však není známo přesné mechanismy týkající se ukončení kontrolního bodu s možnými mechanismy, včetně proteinových fosfatáz reverzujících aktivační fosforylace, cílené degradace ubikvitinu aktivujících proteinů a antagonistů kontrolních bodů podporujících mitózu nezávislými cestami.[10]
Rakovina
Bylo zjištěno, že mnoho regulátorů buněčného cyklu, jako jsou Cdks, cykliny a p53, má abnormální expresi u rakoviny. Přesněji řečeno, podílejí se na účasti na přechodu G2 / M lokalizací do centrozomu, což tedy vede ke studiím manipulace s těmito proteiny za účelem zlepšení citlivosti rakoviny na záření a chemoterapii.[13] Chk1 má důležité důsledky v cílení léků na rakovinu, protože jeho funkce působí jako reakce na poškození DNA. Cytotoxické účinky chemoterapie jsou v současné době studovány v modulaci přechodu G2 / M, týkající se jak zrušení kontrolního bodu, tak jeho zastavení.[19] Mnoho terapií se zaměřuje na deaktivaci kontrolního bodu, aby se buňky s nadměrným poškozením DNA donutily pokračovat mitózou a indukovat buněčnou smrt.[12]
Reference
- ^ A b C d E Cuddihy, Andrew R .; O'Connell, Matthew J. (2003). "Odpovědi buněčného cyklu na poškození DNA v G2". International Review of Cytology. 222: 99–140. doi:10.1016 / s0074-7696 (02) 22013-6. ISBN 9780123646262. ISSN 0074-7696. PMID 12503848.
- ^ Morgan, David Owen, 1958- (2007). Buněčný cyklus: principy řízení. London: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Gould, K. L .; Nurse, P. (1989). „Tyrosinová fosforylace štěpných kvasinek cdc2 + protein kináza reguluje vstup do mitózy“. Příroda. 342 (6245): 39–45. Bibcode:1989 Natur.342 ... 39G. doi:10.1038 / 342039a0. PMID 2682257.
- ^ Seki, A .; Coppinger, J. A .; Jang, C.-Y .; Yates, J. R .; Fang, G. (20. června 2008). "Bora a kináza Aurora A aktivujte společně kinázu Plk1 a ovládejte mitotický vstup". Věda. 320 (5883): 1655–1658. Bibcode:2008Sci ... 320.1655S. doi:10.1126 / science.1157425. PMC 2834883. PMID 18566290.
- ^ Novak, B .; Tyson, J. J. (1993). „Numerická analýza komplexního modelu kontroly M-fáze u extraktů oocytů Xenopus a intaktních embryí“. Journal of Cell Science. 106: 1153–1168. PMID 8126097.
- ^ Sha, Wei; et al. (Září 2002). „Hystereze podporuje přechody buněčného cyklu v extraktech vajec z Xenopus laevis“. Sborník Národní akademie věd. 100 (3): 975–980. Bibcode:2003PNAS..100..975S. doi:10.1073 / pnas.0235349100. PMC 298711. PMID 12509509.
- ^ A b Al-Khodairy, F .; Carr, A. M. (1992). "DNA opravní mutanti definující dráhy kontrolního bodu G2 v Schizosaccharomyces pombe". Časopis EMBO. 11 (4): 1343–1350. doi:10.1002 / j.1460-2075.1992.tb05179.x. PMC 556583. PMID 1563350.
- ^ Thelen, M. P .; Venclovas, C .; Fidelis, K. (1999). "Posuvný upínací model pro rodinu Rad1 proteinů kontrolního bodu buněčného cyklu". Buňka. 96 (6): 769–770. doi:10.1016 / s0092-8674 (00) 80587-5. PMID 10102265.
- ^ Walworth, N .; Davey, S .; Beach, D. (1993). "Štěpná kvasinková proteinová kináza chkl spojuje cestu rad kontrolního bodu s cdc2". Příroda. 363 (6427): 368–371. Bibcode:1993 Natur.363..368W. doi:10.1038 / 363368a0. PMID 8497322.
- ^ A b Calonge, T. M .; O'Connell, M. J. (2007). „Vypnutí kontrolního bodu poškození DNA G2“. Oprava DNA (Amst). 7 (2): 136–140. doi:10.1016 / j.dnarep.2007.07.017. PMC 2233850. PMID 17851138.
- ^ A b C d Raleigh, J. M .; O'Connell, M. J. (2000). „Kontrolní bod poškození DNA G (2) cílí na Wee1 i Cdc25“. Journal of Cell Science. 113 (10): 1727–1736. PMID 10769204.
- ^ A b C d Morgan, David (2007). Principy řízení buněčného cyklu. New Science Press. str. 227–245.
- ^ A b C d Wang, Y .; Ji, P .; Liu, J .; Broaddus, R. R .; Xue, F .; Zhang, W. (2009). „Regulátory G2 / M spojené s centrosomy jako cíle léčby rakoviny“. Molekulární rakovina. 8 (1): 8. doi:10.1186/1476-4598-8-8. PMC 2657106. PMID 19216791.
- ^ Lee, J .; Kumagai, A .; Dunphy, W. G. (2001). „Pozitivní regulace Wee1 proteiny Chk1 a 14-3-3“. Molekulární biologie buňky. 12 (3): 551–563. doi:10,1091 / mbc. 12.3.551. PMC 30963. PMID 11251070.
- ^ A b Harper, J. W .; Elledge, S. J. (prosinec 2007). „Odpověď na poškození DNA: deset let poté“. Molekulární buňka. 28 (5): 739–745. doi:10.1016 / j.molcel.2007.11.015. PMID 18082599.
- ^ Verkade, H. M .; Bugg, S. J .; Lindsay, H. D .; Carr, A. M .; O'Connell, M. J. (1999). „Rad18 je vyžadován pro opravy DNA a reakce kontrolních bodů ve štěpných kvasnicích“. Molekulární biologie buňky. 10 (9): 2905–2918. doi:10,1091 / mbc. 10.9.2905. PMC 25529. PMID 10473635.
- ^ Bunz, F .; Dutriaux, A .; Lengauer, C .; Waldman, T .; Zhou, S .; Brown, J. P .; Sedivy, J. M .; Kinzler, K. W .; Volgestein, B. (1998). "Požadavek na p53 a p21 k udržení zatčení G2 po poškození DNA". Věda. 282 (5393): 1497–1501. doi:10.1126 / science.282.5393.1497. PMID 9822382.
- ^ Lundgren, K .; Walworth, N .; Booher, R .; Dembski, M .; Kirschner, M .; Beach, D. (1991). "Mik1 a wee1 spolupracují na inhibiční fosforylaci tyrosinu cdc2". Buňka. 64 (6): 1111–1122. doi:10.1016/0092-8674(91)90266-2. PMID 1706223.
- ^ DiPaola, R. S. (2002). „Zatknout nebo nezastavit buněčný cyklus G2-M“. Klinický výzkum rakoviny. 8 (11): 3311–3314.
