Enone – alkenové cykloadice - Enone–alkene cycloadditions
v organická chemie, enone – alkenové cykloadice jsou verzí [2 + 2] cykloadice Tato reakce zahrnuje enone a alken jako substráty. Ačkoli je povolena koordinovaná fotochemická [2 + 2] cykloadice, reakce mezi enony a alkeny je postupná a zahrnuje diskrétní diradikální meziprodukty.[1]
Dějiny
V roce 1908 bylo oznámeno, že expozice carvone do „italštiny sluneční světlo „na jeden rok dává kafr.[2] Následující výzkumy prokázaly užitečnost fotochemické [2 + 2] cykloadice enonů na alkeny.[3][4]
Mechanismus
I přes postupný radikální mechanismus se objevily stereoselektivní intra- a intermolekulární varianty. Jsou použity cyklické enony, jinak konkurenční cis-trans izomerizace následuje.
Mechanismus [2 + 2] fotocyklizace je navržen tak, aby začínal fotoexcitací enonu na singlet vzrušený stav. Stav singletu je obvykle velmi krátkodobý a rozpadá se křížení mezi systémy do stav tripletů. V tomto okamžiku enone tvoří exciplex s základní stav alken, nakonec dává triplet diradical. Spin inverze k singlet diradical umožňuje uzavření na cyklobutan.[5] Jako alternativa a pericyklický je navržen reakční mechanismus, ve kterém po překročení mezikrystalu radikál kation a radikál anion vznikají, které se pak rekombinují na cyklobutan.[6]
Rozsah a omezení
Enloadalkenové cykloadice mohou produkovat dva izomery, v závislosti na orientaci substituentů na alkenové a enonové karbonylové skupině. Pokud jsou enonový karbonyl a substituent s nejvyšší prioritou proximální, isomer se označuje jako „hlava-k-hlava“. Když jsou enonový karbonyl a substituent distální, nazývá se izomer „od hlavy k patě“. Selektivita pro jeden z těchto izomerů závisí na sterických i elektronických faktorech (viz níže).
Regiochemie reakce je řízena primárně dvěma faktory: sterickými interakcemi a elektrostatickými interakcemi mezi excitovaným enonem a alkenem. V jejich vzrušeném stavu je polarita enonů obrácena, takže β uhlík má částečný záporný náboj. V přechodném stavu pro vznik první vazby má alken tendenci se srovnávat, takže negativní konec jeho dipólu směřuje od β uhlíku enonu.[7]
Sterické interakce podporují umístění velkých substituentů na opačných stranách newcyklobutanového kruhu.[7]
Pokud jsou enon a alken obsaženy v kruzích s pěti atomy nebo méně, je zachována konfigurace dvojné vazby. Pokud se však použijí větší kruhy, stává se izomerace dvojné vazby během reakce pravděpodobností. Tento proces plýtvání energií soutěží s cykloadicí[8] a je evidentní v reakcích, které poskytují směsi cis- a trans- tavené výrobky.
Diastereofaciální selektivita je ve většině případů vysoce předvídatelná. Méně bráněné tváře enonea a alkenu reagují.[9]
Intramolekulární enone – alkenová cykloadice může poskytovat buď „ohnuté“, nebo „přímé“ produkty v závislosti na reakčníregioselektivitě. Když je svazek mezi enonem a alkenem dlouhý dva atomy, převládaly ohnuté produkty rychlou tvorbou pětičlenných kruhů.[10] Delší postroje mají tendenci dávat přímé výrobky.[11]
Tether může být také připevněn v poloze 2 enonu. Když je zde alken vázán, vynucují objemné substituenty v poloze 4 enonu mírnou diastereoselektivitu.[12]
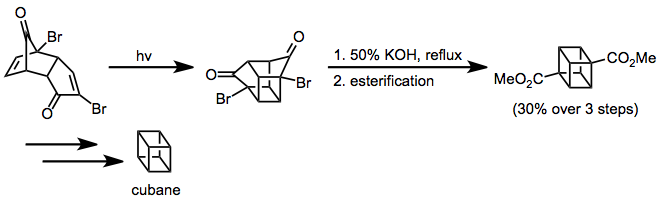
K syntéze kubanu byla použita enone-alkenová cykloadice.[13] The Favorskii přesmyk založil uhlíkovou kostru kubanu a další syntetické manipulace poskytly požadovaný nefunkční cíl.
Metodologie
Enone – alkenové cykloadice často trpí vedlejšími reakcemi, např. ty spojené s diradikálním meziproduktem. Tyto vedlejší reakce lze často minimalizovat uvážlivým výběrem reakčních podmínek.
Je zabráněno rozpuštěnému kyslíku, protože je fotoreaktivní.
Lze použít řadu rozpouštědel. Aceton je užitečné rozpouštědlo, protože může sloužit jako triplet senzibilizátor. Rozpouštědla na bázi alkanu jsou vybrána tak, aby neobsahovala alkeny. Vlnová délka buzení je důležitá. Pro intermolekulární reakce může být použit nadbytek alkenu, aby se zabránilo kompetitivní dimerizaci enonu.
Svítící tyčinky
Zvrátit [2 + 2] fotocykloadice, rozklad 1,2-dioxetandionu, se uvádí jako mechanismus, který produkuje světlo svítící tyčinky.
Reference
- ^ Crimmins, M. T .; Reinhold, T. L. (2004). "Enone Olefin [2 + 2] Photochemical Cycloadditions". Org. Reagovat.: 297–588. doi:10.1002 / 0471264180.or044.02. ISBN 0471264180.
- ^ Ciamician, G .; Silber. P. (1908). „Chemische Lichtwirkungen“. Ber. 41 (2): 1928. doi:10,1002 / cber.19080410272.
- ^ Buchi, G. M .; Goldman, I. M. (1957). „Fotochemické reakce. VII.1 Intramolekulární cyklizace karvonu na karvonkamfor2“. J. Am. Chem. Soc. 79 (17): 4741. doi:10.1021 / ja01574a042.
- ^ Cookson, R. C .; Crundwell, E .; Hudac, J. (1958). Chem. Ind.: 1003.CS1 maint: periodikum bez názvu (odkaz)
- ^ Loutfy, R.O .; DeMayo, P. (1972). „Primární tvorba vazeb při přidání cyklopentenonu k chlorethylenům“. Umět. J. Chem. 50 (21): 3465. doi:10.1139 / v72-560.
- ^ Schmeling, N .; Hunger, K .; Engler, G .; Breiten, B .; Roelling, P .; (Mixa, A .; Staudt, C .; Kleinermanns, K. (2009). „Foto-zesíťování poly [ethen-stat- (kyselina methakrylová)] funkcionalizované s maleimidovými vedlejšími skupinami“. Polym. Int. 58 (7): 720. doi:10,1002 / pi.2583.
- ^ A b Corey, E. J .; Bass, J. D .; LeMahieu, R .; Mitra, R. B. (1964). „Studie fotochemických reakcí 2-cyklohexenonů se substituovanými olefiny“. J. Am. Chem. Soc. 86 (24): 5570. doi:10.1021 / ja01078a034.
- ^ DeMayo, P .; Nicholson, A. A .; Tchir, M. F. (1969). "Důkazy o reverzibilní tvorbě meziproduktů v cyklopentenonové cykloadici". Umět. J. Chem. 47 (4): 711. doi:10.1139 / v69-115.
- ^ Baldwin, S. W .; Crimmins, M. T. (1982). Msgstr "Celková syntéza (-) - sarraceninu fotoanalací". J. Am. Chem. Soc. 104 (4): 1132. doi:10.1021 / ja00368a054.
- ^ Tamura, Y .; Kita, Y .; Ishibashi, H .; Ikeda, M. (1971). „Intramolekulární fotocykloadice 3-allyloxy- a 3-allylamino-cyklohex-2-enonů: tvorba oxa- a aza-bicyklo [2,1,1] hexanů“. J. Chem. Soc. D (19): 1167. doi:10.1039 / C29710001167.
- ^ Coates, R. M .; Senter, P. D .; Baker, W. R. (1982). „Annelativní expanze kruhu prostřednictvím intramolekulárního [2 + 2] fotocykloadice a,. Beta-nenasycených y-laktonů a redukčního štěpení: syntéza hydrocyklopentacyklookten-5-karboxylátů“. J. Org. Chem. 47 (19): 3597–3607. doi:10.1021 / jo00140a001.
- ^ Becker, D .; Haddad, N. (1986). "O stereochemii intramolekulárních [2 + 2] fotocykloadic". Tetrahedron Lett. 27 (52): 6393. doi:10.1016 / S0040-4039 (00) 87817-X.
- ^ Eaton, P.E .; Cole, T. W. Jr. (1964). „Kubánský“. J. Am. Chem. Soc. 86 (15): 3157–3158. doi:10.1021 / ja01069a041.