Dimethylfenylfosfin - Dimethylphenylphosphine
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Dimethylfenylfosfan | |||
| Ostatní jména Dimethylfenylfosfin | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.010.543 | ||
| Číslo ES |
| ||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C8H11P | |||
| Molární hmotnost | 138,14 g / mol | ||
| Vzhled | průhledná světle bledě žlutá kapalina | ||
| Hustota | 0,971 g / cm3 | ||
| Bod tání | N / A | ||
| Bod varu | 74 až 75 ° C (165 až 167 ° F; 347 až 348 K) při 12 mmHg | ||
| Nerozpustný | |||
| Struktura | |||
| Pyramidový | |||
| Nebezpečí | |||
| Bezpečnostní list | [1] | ||
| R-věty (zastaralý) | R10 R36 R37 R38 | ||
| S-věty (zastaralý) | S26 S36 | ||
| Bod vzplanutí | 49 ° C (120 ° F; 322 K) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
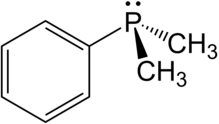
Dimethylfenylfosfin je organofosforová sloučenina se vzorcem P (C6H5) (CH3)2. The fosfor je připojen k a fenyl skupina a dva methyl skupiny, což z něj činí nejjednodušší aromatický alkylfosfin. Tato bezbarvá na vzduch citlivá kapalina se běžně používá jako a ligand v komplexy přechodných kovů. Tyto komplexy jsou často rozpustné v organických rozpouštědlech.
Příprava
Dimethylfenylfosfin se připraví reakcí methylmagnesiumhalogenid s dichlorfenylfosfin.
- (C6H5) Cl2P + 2CH3MgBr → (C.6H5) (CH3)2P + 2MgBrCl
The fosfin se čistí destilací za sníženého tlaku.[1]Řešení (C.6H5) (CH3)2P v CDCI3 ukazuje protonová NMR signály při 5 7,0-7,5 a dublet při 5 1,2. The fosfor-31 NMR spektrum ukazuje singlet při -45,9 ppm v CDCI3.[2]
Struktura a vlastnosti
Dimethylfenylfosfin je a pyramidová molekula Kde fenyl skupina a dva methyl skupiny jsou spojeny s fosforem. The délka vazby a úhly jsou následující: P-CMě: 1,844, P-CPh: 1,845 Á, C-C: 1,401 Á, C-HMě: 1,090 Á, C-HPh: 1,067 Á, C-P-C: 96,9 °, C-P-C (kruh): 103,4 °, P-C-H: 115,2 °.[3]
Když jsou připojeny k chirálním kovovým centrům, jsou to P-methylové skupiny diastereotopický, které se objevují jako samostatné dublety v 1H NMR spektrum.
ΝCO IrCl (CO) (PPh3)2 a IrCl (CO) (PMe2Ph)2 jsou oba na 1960 cm−1, zatímco νCO pro IrCl (CO) (PMe3)2 je na 1938 cm−1.[4][5]
Pokud jde o zásaditost, dimethylfenylfosfin je meziprodukt mezi trialkyl- a trifenylfosfinem:[6][7]
- [HPEt3]+ = 8.7
- [HPMe2Ph]+ = 6.8
- [HPPh3]+ = 2.7
Ligand úhel kužele (θ) je vrcholový úhel válcového kužele, který je vystředěn 2,28 Å od středu atomu P. Úhel kužele nesymetrického ligandu však nelze určit současně. Za účelem stanovení účinného úhlu kužele pro nesymetrický ligand PX1X2X3, je použita následující rovnice:
Kde θi představují poloviční úhel.
Výsledné úhly pro PMe3, PMe2Ph, PPh3 jsou: PMe3 = 118 °, PMe2Ph = 122 °, PPh3 = 145 °. Tak, PMe2Ph má střední velikost vzhledem k PMe3 a PPh3.[8]
Reference
- ^ C. Frajerman; B. Meunier (1983). Příprava dimethylfenylfosfinu. Anorganické syntézy. 22. 133–135. doi:10.1002/9780470132531. ISBN 9780470132531.
- ^ Laszlo T. Mika; Laszlo Orha; Norbert Farkas; Istvan T. Horváth (2009). "Efektivní syntéza ve vodě rozpustných alkyl-bis (m-sulfonovaných-fenyl) - a dialkyl- (m-sulfonovaných-fenyl) -fosfinů a jejich hodnocení při hydrogenaci kyseliny maleinové ve vodě katalyzované rhodiem". Organometallics. 28 (5): 1593. doi:10.1021 / om800570r.
- ^ Novikov, V. P .; Kolomeets, V. I., Syshchikov, Yu. N .; Vilkov, L. V .; Yarkov, A. V .; Tsvetkov, E. N .; Raevskii, O.A. „Výzkum struktury dimethylfenylfosfinu pomocí elektronové difrakce v plynné fázi a vibrační spektroskopie“ Zh. Struktura. Khim. (J. Struc. Chem.) 1984, svazek 25, č. 5 688. doi:10.1007 / BF00747909
- ^ S.A. Cotton, Chemistry of Precious Metals., 1997, 152-157, ISBN 0-7514-0413-6, ISBN 978-0-7514-0413-5
- ^ A. R. Norris; J. A. V. Kessel, „Oxidační přidání 3,5-dinitrobenzoylchloridu do trans-Chlorokarbonylbis (dimethylfenylfosfin) iridium (I) Canadian Journal of Chemistry, 1973, svazek 51, 4145-4151, doi:10.1139 / CJC-51-24-4145.
- ^ Russell C. Bush; Robert J. Angelici (1988). "Fosfinové bazality, jak je stanoveno Prototypy entalpií". Inorg. Chem. 27 (4): 681–686. doi:10.1021 / ic00277a022.
- ^ Tianshu Li; Alan J. Lough; Robert H. Morris (2007). „Stupnice kyselosti tetrafluoroboritanových solí fosfoniových a hydridových sloučenin železa v [D2] dichlormethanu“. Chemistry: A European Journal. 13 (13): 3796–3803. doi:10.1002 / chem.200601484. PMID 17245785..
- ^ C. A. Tolman, Chem. Rev., Steric effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis., 1977, svazek 77, strany 313-348. doi:10.1021 / cr60307a002



