Adiponitril - Adiponitrile
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hexandinitril[1] | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| 1740005 | |
| ChemSpider | |
| Informační karta ECHA | 100.003.543 |
| Číslo ES |
|
| Pletivo | adiponitril |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2205 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H8N2 | |
| Molární hmotnost | 108.144 g · mol−1 |
| Vzhled | Bezbarvá kapalina |
| Hustota | 951 mg ml−1 |
| Bod tání | 1 až 3 ° C; 34 až 37 ° F; 274 až 276 K. |
| Bod varu | 295,1 ° C; 563,1 ° F; 568,2 K. |
| 50 g / l (20 ° C) | |
| Tlak páry | 300 mPa (při 20 ° C) |
Index lomu (nD) | 1.438 |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | 84,5–85,3 kJ mol−1 |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Nebezpečí |
| H301, H315, H319, H330, H335 | |
| P260, P284, P301 + 310, P305 + 351 + 338, P310 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 93 ° C; 199 ° F; 366 K (otevřený kelímek)[2] |
| 550 ° C (1022 ° F; 823 K) | |
| Výbušné limity | 1.7–4.99% |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 155 mg kg−1 (orální, krysa) |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | žádný[2] |
REL (Doporučeno) | TWA 4 ppm (18 mg / m3)[2] |
IDLH (Okamžité nebezpečí) | N.D.[2] |
| Související sloučeniny | |
Související alkanenitrily | Glutaronitril |
Související sloučeniny | kyselina hexandiová hexandihydrazid hexandioyl dichlorid hexandiamid |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
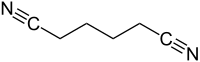
Adiponitril je organická sloučenina s vzorec (CH2)4(CN)2. Tento dinitril, viskózní, bezbarvá kapalina, je důležitým předchůdcem polymer nylon-6,6. V roce 2005 bylo vyrobeno asi jeden milion tun.[4]
Výroba
Časné trasy
Vzhledem k průmyslové hodnotě adiponitrilu bylo vyvinuto mnoho metod pro jeho syntézu. Rané průmyslové trasy začaly od furfural a později chlorování z butadien čímž se získá 1,4-dichlor-2-buten, který se s kyanidem sodným převede na 3-hexendinitril, který se zase může hydrogenovat na adiponitril:[4]
- ClCH2CH = CHCH2Cl + 2 NaCN → NCCH2CH = CHCH2CN + 2 NaCl
- NCCH2CH = CHCH2CN + H2 → NC (CH2)4CN
Adiponitril byl také vyroben z kyselina adipová dehydratací diamidu, ale tato cesta se používá jen zřídka.
Moderní trasy
Většinu adiponitrilu připravuje nikl -katalyzováno kyanovodík z butadien, jak bylo zjištěno na DuPont, průkopníkem Drinkard. Čistá reakce je:
- CH2= CHCH = CH2 + 2 HCN → NC (CH2)4CN

Proces zahrnuje několik stupňů, z nichž první zahrnuje monohydrokyanaci (přidání jedné molekuly HCN), čímž se získají izomery pentennitrilů, jakož i 2- a 3-methylbutennitrilů. Tyto nenasycené nitrily se následně izomerují na 3-a 4-pentennitrily. V závěrečné fázi jsou tyto pentennitrily podrobeny druhé hydrokyanaci, v anti-Markovnikovově smyslu, za vzniku adiponitrilu.[4]
Výzkum ukázal, že 3-pentennitril, který vznikl při první kyanizaci, může podstoupit alkenová metateze za vzniku dikyanobutenů, které se snadno hydrogenují, jak je popsáno výše.
Další hlavní průmyslová cesta zahrnuje hydrodimerizace, začínající od akrylonitril:[5][6]
- 2 CH2= CHCN + 2 e− + 2 H+ → NCCH2CH2CH2CH2CN
Elektrolytická vazba akrylonitrilu byla objevena v Společnost Monsanto.
Aplikace
Téměř veškerý adiponitril je hydrogenovaný na 1,6-diaminohexan pro výrobu nylonu:[7]
- NC (CH2)4CN + 4 H2 → H2N (CH2)6NH2
Stejně jako ostatní nitrily je adiponitril náchylný k hydrolýze. Výsledný kyselina adipová je však levněji připravena jinými cestami.
Bezpečnost
The LD50 pro adiponitril je 300 mg / kg pro orální požití krysami.[4]
V roce 1990 ACGIH přijal časově vážený průměr Prahová hodnota 2 ppm za expozici kůže související s prací.[8]
The NIOSH doporučený limit expozice pokožce pro časově váženou průměrnou koncentraci související s prací je 4 ppm (18 mg / m3).[9]
Je klasifikován jako extrémně nebezpečná látka ve Spojených státech, jak je definováno v oddíle 302 USA Nouzové plánování a zákon o právu na znalost komunity (42 U.S.C. 11002) a podléhá přísným požadavkům na hlášení ze strany zařízení, která je vyrábějí, skladují nebo používají ve významných množstvích.[10]
Reference
- ^ „adiponitril - souhrn sloučenin“. PubChem Compound. USA: Národní centrum pro biotechnologické informace. 26. března 2005. Identifikace. Citováno 15. června 2012.
- ^ A b C d Kapesní průvodce chemickými riziky NIOSH. "#0015". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „Archivovaná kopie“. Archivovány od originál dne 02.04.2015. Citováno 2015-03-26.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ A b C d M. T. Musser, „kyselina adipová“ v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002 / 14356007.a01_269
- ^ Cardoso, D. S .; Šljukić, B .; Santos, D. M .; Sequeira, C. A. (17. července 2017). „Organická elektrosyntéza: Od laboratorní praxe k průmyslovým aplikacím“. Výzkum a vývoj organických procesů. 21 (9): 1213–1226. doi:10.1021 / acs.oprd.7b00004.
- ^ Baizer, Manuel M. (1964). "Elektrolyticky redukční vazba". Journal of the Electrochemical Society. 111 (2): 215. doi:10.1149/1.2426086.
- ^ Robert A. Smiley „Hexamethylenediamine“ v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002 / 14356007.a12_629
- ^ 2009 TLV a BEI, Americká konference vládních průmyslových hygieniků, Publikace podpisu, strana 11 z 254.
- ^ Kapesní průvodce NIOSH Publikace NIOSH 2005-149; Září 2005
- ^ „40 C.F.R .: Dodatek A k části 355 - Seznam extrémně nebezpečných látek a jejich mezní hodnoty pro plánování“ (PDF) (1. července 2008 ed.). Vládní tiskárna. Archivovány od originál (PDF) 25. února 2012. Citováno 29. října 2011. Citovat deník vyžaduje
| deník =(Pomoc)
externí odkazy
- Mezinárodní karta chemické bezpečnosti 0211
- Kapesní průvodce chemickými riziky NIOSH. "#0015". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- www.chemicalland.com
- www.nist.gov

