Protein vyvolávající sestavení aktinu - Actin assembly-inducing protein - Wikipedia
| Protein vyvolávající sestavení aktinu | |||||||
|---|---|---|---|---|---|---|---|
 Komplex peptidů EVH1 doména-ActA | |||||||
| Identifikátory | |||||||
| Symbol | ActA | ||||||
| Gen NCBI | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
The Protein vyvolávající sestavení aktinu (ActA) je protein kódováno a používáno uživatelem Listeria monocytogenes pohánět se savčí hostitelskou buňkou. ActA je bakteriální povrchový protein obsahující oblast překlenující membránu.[1] V savčí buňce bakteriální ActA interaguje s Komplex Arp2 / 3 a aktin monomery k vyvolání polymerace aktinu na bakteriálním povrchu za vzniku ocasu komety aktinu. Gen kódující ActA je pojmenován jednat A. nebo prtB.[2]
Úvod
Jakmile L. monocytogenes bakterie jsou pohlcovány lidmi, dostávají se do nich intestinální epitel buňky a rychle se snaží uniknout jejich internalizační vakuole.[3][4] V cytosolu začínají polymerovat aktin na svém povrchu pomocí proteinu ActA. Ukázalo se, že ActA je nejen nezbytný, ale také dostatečný k indukci motility bakterií při absenci dalších bakteriálních faktorů.[5]
Objev
ActA byl objeven analýzou lecitináza -negativní Tn917-lac Listeria mutanti kvůli fenotypu, že se nemohli šířit z buňky do buňky. Tyto mutantní bakterie stále unikly z fagozomů stejně účinně jako bakterie divokého typu a množily se v infikovaných buňkách, ale nebyly obklopeny aktinem jako bakterie divokého typu. Další analýza ukázala, že Tn917-lac vložil do jednat A., druhý gen operonu. Třetí gen tohoto operonu, plcB, kóduje L. monocytogenes lecitináza. Chcete-li zjistit, zda jednat A. sám, plcB nebo jiné společně transkribované downstream oblasti jsou zapojeny do sestavování aktinu, byly generovány mutace ve vhodných genech. Všichni mutanti kromě jednat A. mutanty byly podobné divokému typu, pokud jde o asociaci s F-aktinem a šíření mezi buňkami. Doplnění s jednat A. obnovený fenotyp divokého typu v jednat A. mutanti.[1]
Funkce

ActA je protein, který působí jako napodobenina Protein Wiskott-Aldrichova syndromu (WASP), faktor podporující nukleaci (NPF) přítomný v hostitelských buňkách. NPF v savčí buňce se rekrutují a váží na již existující komplex 2 a 3 související s aktinem (Komplex Arp2 / 3) a indukují aktivační konformační změnu komplexu Arp2 / 3.[6] Kvůli této konformační změně iniciují NPF polymeraci nového aktinového vlákna pod úhlem 70 °, což vede k charakteristickým aktinovým strukturám s rozvětveným Y v přední hraně pohyblivých buněk. ActA se lokalizuje na starý pól bakterie a překlenuje jak bakteriální buněčnou membránu, tak buněčnou stěnu, je omezena boční difúze; ActA se tedy lokalizuje polarizovaným a ukotveným způsobem na bakteriální povrch. V důsledku toho polymerace aktinu začíná pouze v této oblasti na povrchu bakterie.[7] Exprese ActA je indukována až po vstupu do savčí hostitelské buňky.[8]
Sestava aktinových vláken generuje sílu, která tlačí bakterii v savčí hostitelské cytoplazmě dopředu. Kontinuální polymerace aktinu je dostatečná pro motilitu v cytoplazmě a dokonce i pro infekci sousedních buněk.[9]
Výzkum
Nové údaje naznačují, že ActA hraje roli také při vakuolárním narušení. Deleční mutant ActA byl defektní v permeabilizaci vakuoly. Ukázalo se, že 11 aminokyselinový úsek N-konce kyselé oblasti (32-42) je důležitý pro narušení fagozom.[10]
Struktura
Primární proteinový produkt z jednat A. Gen se skládá z 639 aminokyselin a zahrnuje signální peptid (první N-koncové 29 aminokyseliny) a ActA řetězec (C-koncový 610 aminokyselin). Sekvence zralého proteinu ActA proto sestává z 610 aminokyselin. ActA má molekulovou hmotnost 70 349 Da a je to povrchový protein.[1][2]
ActA je nativně rozložený protein, který lze rozdělit do tří funkčních domén (obr. 2):[1][11][12]
- N-koncová doména, která je vysoce nabitá: aminokyselinové zbytky 1-234
- centrální doména s opakováními bohatými na prolin: aminokyselinové zbytky 235-394
- C-koncová doména s transmembránovou doménou: aminokyselinové zbytky 395-610
N-terminální doména
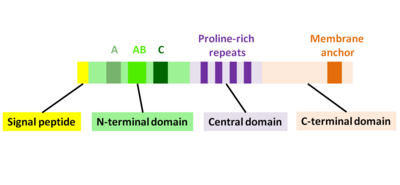
Prvních 156 aminokyselin N-terminální domény sestává ze tří oblastí[10][13] (Obr. 2):
- Oblast A s úsekem kyselých zbytků: 32–45
- AB-oblast, oblast vázající aktinový monomer: 59-102
- C-oblast, sekvence homologie cofilinu: 145-156
N-koncová část ActA hraje důležitou roli v polymeraci aktinu.[14] Doména zobrazuje konsensuální prvky přítomné v NPF rodiny eukaryotických WASP, které zahrnují oblast vázající aktinový monomer a také Arp2 / 3 vázající C (centrální nebo homologie cofilinu) a A (kyselá) oblast.[7] Aktinová monomerní vazebná oblast ActA má funkční vlastnosti jako WASP-homologie-2 (WH2) nebo V doména, ale liší se v sekvenci.[15] U NPF rodiny WASP je tedy pořadí domén WH2 následované C a poté A, což není případ ActA.
Centrální doména
Centrální oblast ActA bohatá na prolin je zásadní pro zajištění účinné bakteriální motility. Existují čtyři opakování bohaté na prolin obsahující motivy FPPPP nebo FPPIP. Tyto oblasti napodobují oblasti cytoskeletálního proteinu hostitelské buňky zyxin, vinkulin a palladin, o kterém je známo, že se sdružuje s fokální adheze nebo stresová vlákna.[16] Vazodilatátorem stimulovaný fosfoprotein (VASP ) se může vázat prostřednictvím své domény homologie 1 Ena / VASP (Doména EVH1 ) do centrálního regionu bohatého na prolin a rekrutuje profilin, protein vázající aktin monomer, který sám podporuje polymeraci na ostnatých koncích aktinových vláken. Navíc se zdá, že VASP interaguje F-aktin prostřednictvím své karboxyterminální domény EVH2, která zajišťuje spojení bakterie s ocasem.[17] Toto tvrzení podporuje skutečnost, že ActA může vázat více proteinů Ena / VASP současně a má vysokou afinitu mezi ActA a Ena / VASP. Bylo prokázáno, že VASP snižuje frekvenci aktin-Y-větví in vitro, a tím zvyšuje podíl vláken, která jsou uspořádána v paralelním uspořádání v ocasech komety.[18][19]
C-koncová doména
C-koncová doména ActA má hydrofobní oblast, která ukotví protein v bakteriální membráně.[20][21][22]
Souhrnně, kromě toho
- absence homologie sekvence v oblasti vázající aktin a
- změna v sekvenci ARP2 / 3 aktivujících domén typických pro NPF rodiny WASP (V (WH2) -C-A),
- hlavní rozdíl mezi ActA a hostitelskými NPF spočívá v tom, že ActA nemá prvky, které se vážou na regulační proteiny, jako jsou GTPasy rodiny Rho. Tento strukturální rozdíl mezi ActA a hostitelskými NPF může být výhodný pro L. monocytogenes a jeho patogenezi, protože aktinová nukleační aktivita L. monocytogenes je nezávislá na regulaci hostitele.[7]
Analogy
WASP / N-WASP, který je funkčně napodobován ActA, je u eukaryot velmi konzervativní. Je důležitým organizátorem aktin-cytoskeletu a je zásadní pro procesy, jako je endocytóza a buněčná motilita. Aktivováno uživatelem Cdc42, malá GTPáza rodiny Rho, WASP / N-WASP aktivuje komplex Arp2 / 3, což vede k rychlé polymeraci aktinu.[23]
Pohyblivost jiných patogenů na základě aktinu
v Shigella aktivuje se protein IcsA N-WASP, který je v neinfikovaných savčích buňkách aktivován GTPázou Cdc42. Aktivní N-WASP / WASP vede k polymeraci aktinu aktivací komplexu Arp2 / 3. Naproti tomu Listeria ActA protein interaguje s komplexem Arp2 / 3 a aktivuje ho přímo.[7]
The Rickettsia RickA protein je také schopen aktivovat komplex Arp2 / 3 způsobem WASP. Na rozdíl od Listeriajsou aktinová vlákna uspořádána do dlouhých, nerozvětvených paralelních svazků. Komplex Arp2 / 3 je lokalizován pouze v blízkosti bakteriálního povrchu, a proto se předpokládá, že dochází k častějšímu prodloužení nezávislému na komplexu Arp2 / 3.[16]
v Burkholderia pseudomallei BimA iniciuje polymeraci aktinů in vitro. Předpokládá se, že intracelulární migrace této bakterie funguje nezávisle na komplexu Arp2 / 3.[16]
Viz také
Reference
- ^ A b C d Kocks C, Gouin E, Tabouret M, Berche P, Ohayon H, Cossart P (únor 1992). „Sestavení aktinu vyvolané L. monocytogenes vyžaduje produkt genu actA, povrchový protein“. Buňka. 68 (3): 521–31. doi:10.1016 / 0092-8674 (92) 90188-I. PMID 1739966.
- ^ A b Uniprot P33379
- ^ Cossart P, Sansonetti PJ (duben 2004). "Bakteriální invaze: paradigmata enteroinvazivních patogenů". Věda. 304 (5668): 242–8. doi:10.1126 / science.1090124. PMID 15073367.
- ^ Cossart P, Pizarro-Cerdá J, Lecuit M (leden 2003). „Invaze do savčích buněk Listeria monocytogenes: funkční mimikry k rozvrácení buněčných funkcí“. Trendy v buněčné biologii. 13 (1): 23–31. doi:10.1016 / S0962-8924 (02) 00006-5. PMID 12480337.
- ^ Zigmond SH (únor 2004). "Forminem indukovaná nukleace aktinových vláken". Současný názor na buněčnou biologii. 16 (1): 99–105. doi:10.1016 / j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (říjen 2004). „Kritické konformační změny v komplexu Arp2 / 3 jsou vyvolávány faktorem podporujícím nukleotidy a nukleaci“. Molekulární buňka. 16 (2): 269–79. doi:10.1016 / j.molcel.2004.09.018. PMID 15494313.
- ^ A b C d Gouin E, MD Welch, Cossart P (únor 2005). "Pohyblivost intracelulárních patogenů na základě aktinu". Současný názor v mikrobiologii. 8 (1): 35–45. doi:10.1016 / j.mib.2004.12.013. PMID 15694855.
- ^ Rafelski SM, Theriot JA (únor 2006). „Mechanismus polarizace povrchového proteinu Acta z Listeria monocytogenes“. Molekulární mikrobiologie. 59 (4): 1262–79. doi:10.1111 / j.1365-2958.2006.05025.x. PMC 1413586. PMID 16430699.
- ^ Goldberg MB (prosinec 2001). „Pohyblivost intracelulárních mikrobiálních patogenů na základě aktinů“. Recenze mikrobiologie a molekulární biologie. 65 (4): 595–626. doi:10.1128 / MMBR.65.4.595-626.2001. PMC 99042. PMID 11729265.
- ^ A b Poussin MA, Goldfine H (leden 2010). „Důkazy o zapojení ActA do zrání fagosomu Listeria monocytogenes“. Cell Research. 20 (1): 109–12. doi:10.1038 / cr.2009.142. PMC 2802179. PMID 20029388.
- ^ Ireton K, Cossart P (1997). „Interakce hostitel-patogen během vstupu a pohybu Listeria monocytogenes na základě aktinu“. Výroční přehled genetiky. 31: 113–38. doi:10.1146 / annurev.genet.31.1.113. PMID 9442892.
- ^ Zápatí, Matthew J .; Lyo, John K .; Theriot, Julie A. (2008-08-29). „Úzké balení Listeria monocytogenes ActA, nativně rozloženého proteinu, zvyšuje F-aktinovou sestavu bez dimerizace“. The Journal of Biological Chemistry. 283 (35): 23852–23862. doi:10,1074 / jbc.M803448200. ISSN 0021-9258. PMC 2527104. PMID 18577520.
- ^ Welch, Matthew D. (2007). „Pohyblivost na základě aktinů a šíření Listeria monocytogenes mezi buňkami“. In Goldfine, Howard; Shen, Hao (eds.). Listeria monocytogenes: Patogeneze a reakce hostitele. New York: Springer. str. 197–223. doi:10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (červenec 1998). "Interakce lidského komplexu Arp2 / 3 a proteinu ActA Listeria monocytogenes v nukleaci aktinových vláken". Věda. 281 (5373): 105–8. doi:10.1126 / science.281.5373.105. PMID 9651243.
- ^ Zalevsky J, Grigorova I, Mullins RD (únor 2001). „Aktivace komplexu Arp2 / 3 proteinem Listeria acta. Acta váže dva aktinové monomery a tři podjednotky komplexu Arp2 / 3“. The Journal of Biological Chemistry. 276 (5): 3468–75. doi:10,1074 / jbc.M006407200. PMID 11029465.
- ^ A b C Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (květen 2008). "Listeria comet tails: the actin-based motility machinery at work". Trendy v buněčné biologii. 18 (5): 220–7. doi:10.1016 / j.tcb.2008.03.001. PMID 18396046.
- ^ Laurent V, Loisel TP, Harbeck B a kol. (Březen 1999). „Role proteinů rodiny Ena / VASP v aktinické motilitě Listeria monocytogenes“. The Journal of Cell Biology. 144 (6): 1245–58. doi:10.1083 / jcb.144.6.1245. PMC 2150578. PMID 10087267.
- ^ Skoble J, Auerbuch V, Goley ED, Welch MD, Portnoy DA (říjen 2001). „Stěžejní role VASP v nukleaci aktinů zprostředkovaných komplexem Arp2 / 3, tvorbě větví aktinu a motilitě Listeria monocytogenes“. The Journal of Cell Biology. 155 (1): 89–100. doi:10.1083 / jcb.200106061. PMC 2150787. PMID 11581288.
- ^ Bear JE, Svitkina TM, Krause M a kol. (Květen 2002). „Antagonismus mezi proteiny Ena / VASP a zakončením aktinových vláken reguluje motilitu fibroblastů“. Buňka. 109 (4): 509–21. doi:10.1016 / S0092-8674 (02) 00731-6. hdl:1721.1/83477. PMID 12086607.
- ^ Vazquez-Boland JA, Kocks C, Dramsi S a kol. (Leden 1992). „Nukleotidová sekvence lecitinázového operonu Listeria monocytogenes a možná role lecitinázy v šíření mezi buňkami“. Infekce a imunita. 60 (1): 219–30. PMC 257526. PMID 1309513.
- ^ Domann E, Wehland J, Rohde M a kol. (Květen 1992). „Nový gen bakteriální virulence v Listeria monocytogenes potřebný pro interakci mikrofilament hostitelských buněk s homologií k oblasti vinculinu bohaté na prolin“. Časopis EMBO. 11 (5): 1981–90. doi:10.1002 / j.1460-2075.1992.tb05252.x. PMC 556658. PMID 1582425.
- ^ Kocks C, Hellio R, Gounon P, Ohayon H, Cossart P (červenec 1993). „Polarizovaná distribuce povrchového proteinu ActA Listeria monocytogenes v místě směrového sestavení aktinu“. Journal of Cell Science. 105 (3): 699–710. PMID 8408297.
- ^ Kurisu S, Takenawa T (2009). „Proteiny rodiny WASP a WAVE“. Genome Biology. 10 (6): 226. doi:10.1186 / gb-2009-10-6-226. PMC 2718491. PMID 19589182.
externí odkazy
- YouTube video z Příroda, Listeria monocytogenes [2:00–4:12]
