Absolutní konfigurace - Absolute configuration

An absolutní konfigurace odkazuje na prostorové uspořádání atomy a chirální molekulární entita (nebo skupina) a jeho stereochemický popis např. R nebo S,[1] s odkazem na Rectusnebo Zlověstný, resp.
Absolutní konfigurace pro chirální molekulu (v čisté formě) jsou nejčastěji získány pomocí Rentgenová krystalografie. Všechny enantiomerně čisté chirální molekuly krystalizují v jedné ze 65 Sohncke skupiny (chirální vesmírné skupiny).
Alternativní techniky jsou optická rotační disperze, vibrační kruhový dichroismus, ultrafialově viditelná spektroskopie, Použití chirální posunová činidla v protonová NMR a Coulombova exploze.[2][3]
Když je získána absolutní konfigurace, přiřazení R nebo S je založen na Cahn – Ingold – Prelogová pravidla priority.
Pro charakterizaci jsou také relevantní absolutní konfigurace krystaly.
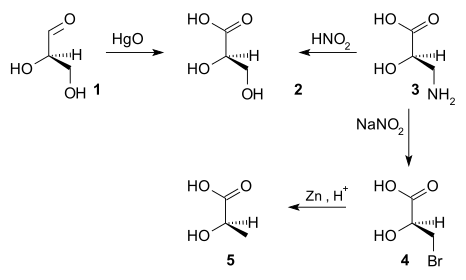
Do roku 1951 nebylo možné získat absolutní konfiguraci chirálních sloučenin.[4] Někdy bylo rozhodnuto, že (+) -glyceraldehyd byl D-enantiomer.[Citace je zapotřebí ] Konfigurace dalších chirálních sloučenin poté souvisela s konfigurací (+) - glyceraldehydu sekvencemi chemické reakce. Například oxidace (+) - glyceraldehydu (1) s oxid rtuťnatý dává (-) -kyselina glycerová (2), reakce, která nemění stereocentrum. Absolutní konfigurace kyseliny (-) - glycerové tedy musí být stejná jako konfigurace (+) - glyceraldehydu. Kyselina dusičná[Citace je zapotřebí ] oxidace (+) -isoserin (3) dává (-) - glycerovou kyselinu, čímž se stanoví, že (+) - isoserin má také stejnou absolutní konfiguraci. (+) - Isoserin lze převést dvoustupňovým procesem bromace[Citace je zapotřebí ] a zinek redukce dát (-) -kyselina mléčná, proto (-) - kyselina mléčná má také stejnou absolutní konfiguraci. Pokud by reakce poskytla enantiomer známé konfigurace, jak je naznačeno opačným znamením optické rotace, znamenalo by to, že absolutní konfigurace je obrácená.
V roce 1951 Johannes Martin Bijvoet poprvé použit v Rentgenová krystalografie účinek anomální disperze, který je nyní označován jako rezonanční rozptyl, k určení absolutní konfigurace.[5] Vyšetřovanou sloučeninou byl (+) - sodná sůl rubidia vínan a z jeho konfigurace (R,R) bylo vyvozeno, že původní odhad pro (+) - glyceraldehyd byl správný.
Konvence
Podle absolutní konfigurace: R- a S-
The R / S Systém je důležitým nomenklaturním systémem pro označení enantiomerů. Tento přístup označuje každé chirální centrum R nebo S podle systému, kterému jsou jeho substituenty přiřazeny a přednost, podle Cahn – Ingold – Prelogová pravidla priority (CIP), na základě atomového čísla. Pokud je střed orientován tak, že nejnižší priorita čtyř je namířena od diváka, uvidí divák dvě možnosti: Pokud se priorita zbývajících tří substituentů sníží ve směru hodinových ručiček, je označena R (pro Rectus, Latinka vpravo), pokud klesá ve směru hodinových ručiček, je S (pro Zlověstný, Latinka vlevo).[6]
(R) (S) je psán kurzívou a závorkami. Pokud existuje více chirálních uhlíků, např. (1R,4S), číslo určuje umístění uhlíku před každou konfigurací.[7]
The R / S systém také nemá žádný pevný vztah k D / L. Systém. Například jeden z bočních řetězců serin obsahuje hydroxylovou skupinu, -OH. Pokud za ni byla vyměněna thiolová skupina, -SH, D / L. označení by podle své definice nebylo nahrazením ovlivněno. Ale tato substituce by invertovala molekulu R / S označení, protože priorita CIP CH2OH je nižší než pro CO2H, ale priorita CIP CH2SH je vyšší než pro CO2H. Z tohoto důvodu D / L. Tento systém se běžně používá v určitých oblastech biochemie, jako je chemie aminokyselin a sacharidů, protože je vhodné mít stejnou chirální značku pro běžně se vyskytující struktury daného typu struktury ve vyšších organismech. V D / L. systému, jsou téměř všechny konzistentní - přirozeně se vyskytující aminokyseliny jsou všechny L, zatímco přirozeně se vyskytující sacharidy jsou téměř všechny D. V R / S systému, většinou jsou S, ale existují některé běžné výjimky.
Optickou rotací: (+) - a (-) - nebo d- a l-
Enantiomer lze pojmenovat podle směru, kterým otáčí rovinu polarizovaného světla. Otáčení světla ve směru hodinových ručiček směrem k divákovi je označeno (+) enantiomer. Jeho zrcadlový obraz je označen (-). Byly také označeny (+) a (-) izomery d- a l- (pro pravotočivý a levotočivý ); Ale pojmenování pomocí d- a l- lze snadno zaměnit D- a L- označování, a proto jej odrazuje IUPAC.[8]
Podle relativní konfigurace: D- a L-
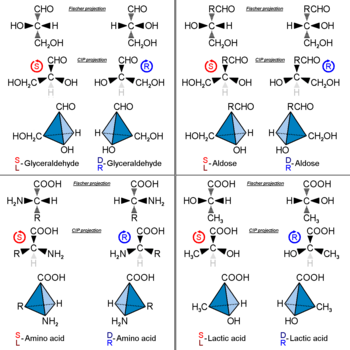
Optický izomer lze pojmenovat podle prostorové konfigurace jeho atomů. The D / L. systém (pojmenovaný podle latiny dexter a laevus, vpravo a vlevo), nezaměňovat s d- a l-Systém, viz výše, dělá to spojením molekuly s glyceraldehyd. Glyceraldehyd je sám o sobě chirální a jeho dva izomery jsou označeny D a L (typicky vysázet v malé čepice v publikované práci). Určité chemické manipulace mohou být provedeny na glyceraldehydu bez ovlivnění jeho konfigurace a jeho historické použití pro tento účel (možná v kombinaci s jeho pohodlím jako jedné z nejmenších běžně používaných chirálních molekul) vedlo k jeho použití pro nomenklaturu. V tomto systému jsou sloučeniny pojmenovány analogicky k glyceraldehydu, který obecně produkuje jednoznačné označení, ale je nejsnáze viditelný v malých biomolekulách podobných glyceraldehydu. Jedním příkladem je chirální aminokyselina alanin, který má dva optické izomery a jsou označeny podle toho, ze kterého izomeru glyceraldehydu pocházejí. Na druhou stranu, glycin Aminokyselina odvozená od glyceraldehydu nemá žádnou optickou aktivitu, protože není chirální (achirální).
The D / L. označení nesouvisí s (+) / (-); neznamená to, který enantiomer je pravotočivý a který levotočivý. Spíše to naznačuje stereochemii sloučeniny ve srovnání se stereochemií sloučeniny pravotočivý nebo levotočivý enantiomer glyceraldehydu. Pravotočivý izomer glyceraldehydu je ve skutečnosti D- izomer. Devět z devatenácti L-aminokyseliny, které se běžně vyskytují v bílkovinách, jsou pravotočivé (na vlnové délce 589 nm) a D-fruktóza se také označuje jako levulóza, protože je levotočivá. Pravidlo pro určení D / L. izomerní forma aminokyseliny je pravidlem „CORN“. Skupiny:
- COACH, R, NH2 a H (kde R je postranní řetězec)
jsou uspořádány kolem chirálního středního atomu uhlíku. S atomem vodíku směrem od diváka, pokud je uspořádání CO→R→N skupiny kolem atomu uhlíku, protože střed je proti směru hodinových ručiček, pak je to L formulář.[9] Pokud je uspořádání ve směru hodinových ručiček, jedná se o D formulář. Jako obvykle, pokud je samotná molekula orientována odlišně, například s H směrem k divákovi, může být vzorec obrácen. The L forma je obvyklá v přírodních bílkovinách. U většiny aminokyselin je to L forma odpovídá S absolutní stereochemie, ale je R místo toho pro určité postranní řetězce.
Viz také
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “absolutní konfigurace ". doi:10.1351 / goldbook.A00020
- ^ http://www.mpg.de/7634710/coulomb-explosion-method
- ^ http://atom.uni-frankfurt.de/research/laser/2_molecules/Stereochemistry/
- ^ Organická chemie (4. vydání) Paula Y. Bruice
- ^ Stanovení absolutní konfigurace opticky aktivních sloučenin pomocí rentgenových paprsků Nature 168, 271-272 J. M. BIJVOET, A. F. PEERDEMAN & A. J. van BOMMEL doi:10.1038 / 168271a0
- ^ Andrew Streitwieser & Clayton H. Heathcock (1985). Úvod do organické chemie (3. vyd.). Macmillan Publishing Company.
- ^ Klein, David R. (2013-12-31). Organická chemie (2. vyd.). Wiley. str. 208. ISBN 978-1118454312.
- ^ G.P. Mech:Základní terminologie stereochemie (Doporučení 1996); Pure Appl. Chem. 1996, sv. 68, č. 12, s. 2205; doi:10.1351 / pac199668122193
- ^ „Nomenklatura a symbolika pro aminokyseliny a peptidy“. Pure Appl Chem. 56 (5): 595–624. 1984. doi:10.1351 / pac198456050595.