Hodnota - A value

Hodnoty A. jsou číselné hodnoty používané při stanovení nejstabilnější orientace atomy v molekula (konformační analýza ), jakož i obecné zastoupení společnosti sterický objem. Hodnoty A jsou odvozeny z energetických měření různých cyklohexanové konformace monosubstituované chemické látky cyklohexanu.[1] Substituenty na cyklohexan prsten raději bydlí v rovníková poloha na axiální. Rozdíl v Gibbsova volná energie (ΔG) mezi vyšší energetickou konformací (axiální substituce) a nižší energetickou konformací (ekvatoriální substituce) je hodnota A pro daný konkrétní substituent.
Užitečnost
Hodnoty A pomáhají předvídat konformace cyklohexanových kruhů. Nejstabilnější konformace bude ta, která má substituent nebo substituenty ekvatoriální. Když se vezme v úvahu více substituentů, upřednostňuje se konformace, kde je substituent s největší hodnotou A ekvatoriální.

Užitečnost hodnot A lze zobecnit pro použití mimo cyklohexanové konformace. Hodnoty A mohou pomoci předpovědět sterický účinek substituentu. Obecně platí, že čím větší je hodnota A substituentu, tím větší je sterický účinek tohoto substituentu. A methylová skupina má hodnotu A 1,74 while tert-butylová skupina má hodnotu A ~ 5. Protože hodnota A. tert-butyl je vyšší, tert-butyl má větší sterický účinek než methyl. Tento rozdíl ve stérických účincích lze použít k předpovědi reaktivity při chemických reakcích.
Úvahy o bezplatné energii
Při přiřazování konfigurací v cyklohexanech hrají hlavní roli sterické efekty. Lze použít sterické zábrany k určení sklonu substituentu k pobytu v axiální nebo rovníkové rovině. Je známo, že axiální vazby brání více než odpovídající rovníkové vazby. Je to proto, že substituenty v axiální poloze jsou relativně blízko dvou dalších axiálních substituentů. Díky tomu je velmi přeplněný, když jsou objemné substituenty orientovány v axiální poloze. Tyto typy sterických interakcí jsou běžně známé jako 1,3 diaxiální interakce.[2] Tyto typy interakcí nejsou přítomny se substituenty v ekvatoriální poloze.
Obecně jsou považovány za tři základní příspěvky do konformačního energie zdarma:[3]
- Baeyerův kmen, definovaná jako deformace vznikající v důsledku deformace vazných úhlů.
- Kmen Pitzer, definovaná jako torzní napětí vznikající při 1,2 interakcích mezi skupinami připojenými k sousedícím uhlíkům,
- Van der Waalsovy interakce, které jsou podobné 1,3 diaxiální interakci.
Entalpické komponenty
Při porovnání relativní stability lze k přiblížení rozdílů použít interakce se 6 a 7 atomy entalpie mezi konformacemi. Každá interakce se 6 atomy má hodnotu 0,9 kcal / mol (3,8 kJ / mol) a každá interakce se 7 atomy má hodnotu 4 kcal / mol (17 kJ / mol).[4]


Entropické komponenty
Entropie také hraje roli v preferenci substituentu pro ekvatoriální polohu. Entropická složka je určena následujícím vzorcem:
Kde σ se rovná počtu microstates k dispozici pro každou konformaci.

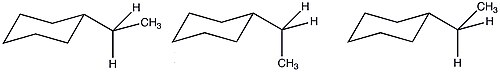
Kvůli většímu počtu možných konformací ethylcyklohexanu je hodnota A snížena z toho, co by bylo předpovídáno na základě čistě entalpických podmínek. Vzhledem k těmto příznivým entropickým podmínkám je sterický význam ethylové skupiny podobný jako u methylového substituentu.
Tabulka A-hodnot
| Substituent | Hodnota | Substituent | Hodnota | Substituent | Hodnota | ||
|---|---|---|---|---|---|---|---|
| D | 0.006 | CH2Br | 1.79 | OSi (CH3)3 | 0.74 | ||
| F | 0.15 | CH (CH3)2 | 2.15 | ACH | 0.87 | ||
| Cl | 0.43 | c-C6H11 | 2.15 | OCH3 | 0.6 | ||
| Br | 0.38 | C (CH3)3 | >4 | OCD3 | 0.56 | ||
| Já | 0.43 | Ph | 3 | OCH2CH3 | 0.9 | ||
| CN | 0.17 | C2H | 1.35 | O-Ac | 0.6 | ||
| NC | 0.21 | CO2− | 1.92 | O-TFA | 0.68 | ||
| Poddůstojník | 0.51 | CO2CH3 | 1.27 | OCHO | 0.27 | ||
| NCS | 0.28 | CO2Et | 1.2 | O-Ts | 0.5 | ||
| N = C = NR | 1 | CO2iPr | 0.96 | ALE NE2 | 0.59 | ||
| CH3 | 1.7 | COCl | 1.25 | NH2 | 1.6 | ||
| CF3 | 2.1 | COCH3 | 1.17 | NHCH3 | 1 | ||
| CH2CH3 | 1.75 | SH | 0.9 | N (CH3)3 | 2.1 | ||
| CH = CH2 | 1.35 | SMe | 0.7 | NH3+ | 1.9 | ||
| CCH | 0.41 | SPh | 0.8 | NE2 | 1.1 | ||
| CH2tBu | 2 | S− | 1.3 | HgBr | ~0 | ||
| CH2OT | 1.75 | SOPh | 1.9 | HgCl | 0.3 | ||
| TAK2Ph | 2.5 | Si (CH3)3 | 2.5 |
Aplikace
Předvídání reaktivity
Jedním z původních experimentů provedených Winstonem a Holnessem bylo měření hodnotit oxidace v trans a cis substituovaných kruzích za použití chromového katalyzátoru. Ten velký tert- použitá butylová skupina blokuje konformaci každé molekuly a umisťuje ji do rovníkové polohy (je zobrazena cis sloučenina).

Bylo pozorováno, že cis sloučenina prošla oxidací mnohem rychlejší rychlostí než trans sloučenina. Těžilo se, že velká hydroxylová skupina v axiální poloze byla znevýhodněna a snadněji vytvořila karbonyl, aby zmírnila tento kmen. Trans sloučenina měla rychlosti identické s rychlostmi zjištěnými v monosubstituovaném cyklohexanolu.

Aproximace síly intramolekulární síly pomocí A-hodnot
Pomocí A-hodnot hydroxylové a isopropylové podjednotky lze vypočítat energetickou hodnotu příznivé intramolekulární vodíkové vazby.[10]

Omezení
Hodnoty A se měří za použití monosubstituovaného cyklohexanového kruhu a jsou indikátorem pouze sterických látek, které konkrétní substituent dodává molekule. To vede k problému, když jsou možné stabilizační elektronické faktory v jiném systému. The karboxylová kyselina substituent zobrazený níže je v základním stavu axiální, navzdory kladné hodnotě A. Z tohoto pozorování je zřejmé, že existují další možné elektronické interakce, které stabilizují axiální konformaci.

Další úvahy
Je důležité si uvědomit, že hodnoty A nepředpovídají fyzickou velikost molekuly, pouze sterický účinek. Například tert-butylová skupina (hodnota A = 4,9) má větší hodnotu A než trimethylsilyl skupina (hodnota A = 2,5), přesto tert-butylová skupina ve skutečnosti zabírá méně místa. Tento rozdíl lze připsat delší délce vazba uhlík-křemík ve srovnání s vazba uhlík-uhlík z tert-butylová skupina. Delší vazba umožňuje menší interakce se sousedními substituenty, což účinně činí trimethylsilylovou skupinu méně stericky omezující, čímž snižuje její hodnotu A.[2] To lze také vidět při porovnání halogeny. Brom, jod a chlor mají podobné hodnoty A, i když se jejich atomové poloměry liší.[4] Hodnoty A pak předpovídají zdánlivou velikost substituentu a relativní zdánlivé velikosti určují rozdíly ve stérických účincích mezi sloučeninami. Hodnoty A jsou tedy užitečnými nástroji pro stanovení reaktivity sloučeniny v chemických reakcích.
Reference
- ^ Muller, P (1994). "Glosář termínů používaných ve fyzikální organické chemii (doporučení IUPAC 1994)". Čistá a aplikovaná chemie. 66 (5): 1077–1184. doi:10.1351 / pac199466051077.
- ^ A b Hoffman, Robert V. (2004). Organická chemie [Přechodný text] (druhé vydání). New Jersey: John Wiley and Sons, Inc. str. 167. ISBN 978-0-471-45024-5.
- ^ Anderson, J. Edgar (1974). Dynamická chemie [Témata ze současné chemie]. Témata současné chemie Fortschritte der Chemischen Forschung. 45. Springer-Verlag. p. 139. doi:10.1007/3-540-06471-0. ISBN 978-3-540-06471-8.
- ^ A b Anslyn, Eric V .; Dougherty, Dennis A. (2006). Moderní fyzikální organická chemie. Sausalito, CA: University Science Books. str.104 –105. ISBN 978-1-891389-31-3.
- ^ Poznámka: měřeno za různých podmínek
- ^ Eliel, E.L .; Wilen, S.H .; Mander, L.N. (1994). Stereochemie organických sloučenin. New York: Wiley. ISBN 81-224-0570-3.
- ^ Eliel, E.L .; Allinger, N.L .; Angyal, S.J .; G.A., Morrison (1965). Konformační analýza. New York: Interscience Publishers.
- ^ Hirsch, J.A. (1967). Témata ve stereochemii (první vydání). New York: John Wiley & Sons, Inc. p. 199.
- ^ Romers, C .; Altona, C .; Buys, H.R .; Havea, E. (1969). Témata ve stereochemii (čtvrté vydání). New York: John Wiley & Sons, Inc. p. 40.
- ^ Huang, C.-Y .; Cabell, L.A .; Anslyn, E.V. (1994). „Molekulární rozpoznávání cyklitolů neutrálními receptory vázajícími polyaza a vodík: síla a vliv intramolekulárních vodíkových vazeb mezi alkoholy z okolí.“ Journal of the American Chemical Society. 116 (7): 2778–2792. doi:10.1021 / ja00086a011.

