Zanubrutinib - Zanubrutinib
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Brukinsa |
| Ostatní jména | BGB-3111 |
| AHFS /Drugs.com | Monografie |
| Licenční údaje |
|
| Těhotenství kategorie |
|
| Trasy z správa | Pusou |
| Třída drog | Brutonova tyrosinkináza (BTK) inhibitor |
| Právní status | |
| Právní status |
|
| Identifikátory | |
| Číslo CAS | |
| PubChem CID | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Chemické a fyzikální údaje | |
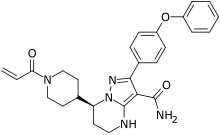
| Vzorec | C27H29N5Ó3 |
| Molární hmotnost | 471,5509 g · mol−1 |
| 3D model (JSmol ) | |
| |
Zanubrutinib, prodávané pod značkou Brukinsa, je určen k léčbě dospělých pacientů s lymfom z plášťových buněk (MCL), kteří podstoupili alespoň jednu předchozí terapii.[3]
To bylo schváleno pro lékařské použití ve Spojených státech v listopadu 2019.[4][3][5][6]
Zanubrutinib je klasifikován jako a Brutonova tyrosinkináza (BTK) inhibitor.[7] Podává se orálně.[7]
Dějiny
Účinnost byla hodnocena v BGB-3111-206 (NCT03206970), otevřené, multicentrické, jednoramenné studii fáze II s 86 pacienty s lymfomem z plášťových buněk (MCL), kteří podstoupili alespoň jednu předchozí terapii.[5] Zanubrutinib byl podáván perorálně v dávce 160 mg dvakrát denně až do progrese onemocnění nebo nepřijatelné toxicity.[5] Účinnost byla rovněž hodnocena v BGB-3111-AU-003 (NCT 02343120), otevřené fázi, eskalaci dávky, globální, multicentrické, jednoramenné studii B-buněčných malignit, včetně 32 dříve léčených MCL pacienti léčení zanubrutinibem podávaným perorálně v dávce 160 mg dvakrát denně nebo 320 mg jednou denně.[5][6]
Primárním měřítkem výsledku účinnosti v obou studiích byla celková míra odpovědi (ORR) hodnocená nezávislou kontrolní komisí.[5] Ve studii BGB-3111-206 byly vyžadovány FDG-PET skeny a ORR byla 84% (95% CI: 74, 91), s úplnou odpovědí 59% (95% CI 48, 70) a mediánem odpovědi trvání 19,5 měsíce (95% CI: 16,6, nelze odhadnout).[5] Ve studii BGB-3111-AU-003 nebyly skenování FDG-PET vyžadovány a ORR byla 84% (95% CI: 67, 95), s úplnou odpovědí 22% (95% CI: 9, 40) a medián trvání odpovědi 18,5 měsíce (95% CI: 12,6, nelze odhadnout).[5] Zkouška 1 byla provedena na 13 místech v Číně a zkouška 2 byla provedena na 25 místech ve Spojených státech, Velké Británii, Austrálii, Novém Zélandu, Itálii a Jižní Koreji.[6]
Spojené státy. Úřad pro kontrolu potravin a léčiv (FDA) udělil zanubrutinib prioritní kontrola, zrychlené schválení, průlomová terapie označení a lék na vzácná onemocnění označení.[3][5][8]
FDA schválila zanubrutinib v listopadu 2019 a schválila žádost o společnost Brukinsa společnosti BeiGene USA Inc.[3][5][9]
Reference
- ^ "Zanubrutinib (Brukinsa) užívání během těhotenství". Drugs.com. 3. ledna 2020. Citováno 26. ledna 2020.
- ^ "Zanubrutinib". DrugBank. Citováno 15. listopadu 2019.
- ^ A b C d „FDA schvaluje terapii k léčbě pacientů s relabujícím a refrakterním lymfomem z plášťových buněk podporovanou výsledky klinických studií, které ukazují vysokou míru odpovědi na zmenšení nádoru“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 14. listopadu 2019. Citováno 15. listopadu 2019.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Balíček pro schválení léků: Brukinsa“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 27. listopadu 2019. Citováno 28. března 2020.
- ^ A b C d E F G h i „FDA uděluje urychlené schválení zanubrutinibu pro lymfom z plášťových buněk“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 15. listopadu 2019. Archivováno z původního dne 28. listopadu 2019. Citováno 27. listopadu 2019.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b C „Snapshots of Drug Trials Brukinsa“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 14. listopadu 2019. Citováno 26. ledna 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b "BRUKINSA - tobolka zanubrutinibu, potažená želatinou". DailyMed. 18. listopadu 2019. Citováno 28. března 2020.
- ^ „Označení a schválení léčivého přípravku pro vzácná onemocnění zanubrutinibu“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 28. listopadu 2019. Archivováno z původního dne 28. listopadu 2019. Citováno 27. listopadu 2019.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Balíček pro schválení léků: Brukinsa“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 27. listopadu 2019. Archivováno z původního dne 28. listopadu 2019. Citováno 27. listopadu 2019.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
externí odkazy
- "Zanubrutinib". Informační portál o drogách. Americká národní lékařská knihovna.
| Tento farmakologie související článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
