Trans-Dichlorobis (ethylendiamin) chlorid kobaltnatý - Trans-Dichlorobis(ethylenediamine)cobalt(III) chloride
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| C4H16Cl3Ošidit4 | |
| Molární hmotnost | 285.48 g · mol−1 |
| Vzhled | zelená pevná látka |
| Bod tání | rozkládá se |
| dobrý | |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H315, H319, H335 | |
| P261, P305 + 351 + 338 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
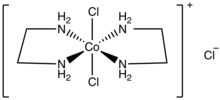
trans-Dichlorobis (ethylendiamin) chlorid kobaltnatý je sůl vzorce [CoCl2(cs)2] Cl (en = ethylendiamin ). Je to zelená diamagnetická pevná látka, která je rozpustná ve vodě. Je to chloridová sůl kationtové koordinační komplex [CoCl2(cs)2]+. Jeden chloridový iont v této soli snadno podléhá iontové výměně, ale dva další chloridy jsou méně reaktivní a jsou vázány na kovové centrum. Čím stabilnější cis-chlorid kobaltnatý (ethylendiamin) kobaltnatý je také známo.
Syntéza
Sloučenina se syntetizuje reakcí chlorid kobaltnatý a ethylendiamin v kyselině chlorovodíkové v přítomnosti kyslíku:
- 4 CoCl2 + 8 en + 4 HCl + O2 → 4 trans- [CoCl2(cs)2] Cl + 2 H2Ó
Počáteční produkt obsahuje HCl, který se odstraní zahřátím. Alternativně chlorid (karbonato) bis (ethylendiamin) kobaltnatý reaguje s kyselinou chlorovodíkovou při 10 ° C za vzniku stejného druhu.[1]
- [Kokos3) (en)2] Cl + 2 HCl → trans- [CoCl2(cs)2] Cl + CO2 + H2Ó

Srovnání cis a trans izomery
Tato sůl je rozpustnější než cis izomer. Tato dvojice izomerů byla významná pro rozvoj oblasti koordinační chemie.[2]
Trans-izomerový kation idealizoval D.2h bodová skupinová symetrie, zatímco cis izomerní kation má C2 symetrie.
Reference
- ^ Springbørg, J .; Schaffer, C.E. "Dianionobis (ethylendiamin) kobalt (III) komplexy" Anorganické syntézy 1973; svazek 14, strany 63-77. doi:10.1002 / 9780470132456.ch14
- ^ Jörgensen, S.M. „Ueber Metalldiaminverbindungen“ Journal für praktische Chemie (v němčině), 1889, svazek 39, strana 8. doi:10.1002 / prac.18890390101
