Psaní tkání - Tissue typing
Psaní tkání je postup, při kterém jsou tkáně potenciálního dárce a příjemce testovány na kompatibilitu před transplantace. Neshodující se tkáně dárce a příjemce mohou vést k odmítnutí tkání. Existuje několik metod typování tkání.
Přehled

Během psaní tkáně, jednotlivce lidské leukocytové antigeny (HLA) jsou identifikovány.[1] HLA molekuly jsou prezentovány na povrchu buněk a usnadňují interakce mezi imunitními buňkami (např dendritické buňky a T buňky ) které vedou k adaptivní imunitní odpovědi.[2] Pokud je HLA od dárce rozpoznána imunitním systémem příjemce jako odlišná od HLA vlastního příjemce, může být spuštěna imunitní odpověď proti dárcovským tkáním.[3] Přesněji řečeno, nesoulady HLA mezi dárci orgánů a příjemci mohou vést k vývoji anti-HLA protilátky specifické pro dárce (DSA).[4] DSA jsou silně spojeny s odmítnutím dárcovských tkání u příjemce a jejich přítomnost je považována za indikátor odmítnutí zprostředkovaného protilátkami.[5] Když se shodují HLA mezi dárcem a příjemcem, je pravděpodobnější, že dárcovské tkáně budou přijaty imunitním systémem příjemce.[3] Během typování tkáně by měla být typována řada genů HLA u dárce i příjemce, včetně HLA třída I A, B, a C geny, stejně jako HLA třída II DRB1, DRB3, DRB4, DRB5, DQA1, DQB1, DPA1, a DPB1 geny.[6] Typizace HLA je ztížena skutečností, že oblast HLA je geneticky nejvíce variabilní oblastí v lidském genomu.[7]
Metody psaní tkáně
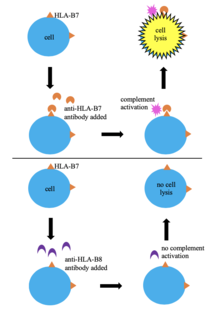
Jednou z prvních metod typizace tkání byla sérologická typizace. V této technice jsou krevní buňky dárce HLA napsané smícháním s sérum obsahující anti-HLA protilátky. Pokud protilátky rozpoznají své epitop na HLA dárce doplněk dojde k aktivaci vede k buňce lýza a smrt, umožňující buňkám absorbovat barvivo (trypanová modrá ). To umožňuje identifikaci HLA buněk na základě nepřímo na základě specificity známých protilátek v séru. Tato metoda byla široce používána, protože je jednoduchá, rychlá a nízkonákladová; obrovská variabilita v HLA alely znamená, že sérum obsahující protilátky specifické pro HLA testovaných buněk nemusí být k dispozici.[6][8] Sérologická typizace neposkytuje jasný obraz o oblasti HLA a ne vždy vede k úspěšné typizaci HLA, takže mnoho laboratoří ji přestalo používat ve prospěch efektivnějších metod.[6][9]
V poslední době se objevily další účinnější přístupy, včetně použití polymerázové řetězové reakce (PCR ) na základě sekvenčně specifických primerů (SSP) nebo sekvenčně specifických oligonukleotid sondy (SSOP).[3][6] SSP-PCR však může být časově i zdrojově náročná.[9] SSOP-PCR je lepší pro HLA typizující velký počet jedinců, například velký počet dárců pro registry kostní dřeně.[9] RT-PCR je další přístup k psaní HLA, který je rychlý a všestranný, ale je drahý.[6]
Konformační analýza zprostředkovaná referenčním vláknem (RSCA) je další metodou používanou pro typizaci HLA. V této metodě je neznámý HLA vzorek smíchán s referenční alelou a zpracován v gelu elektroforéza.[9] RSCA je omezen počtem dostupných alel HLA, protože oblast HLA je tak různorodá.[9]
Přímo Sekvenování DNA je v současné době považována za nejlepší metodu psaní HLA, buď Sangerovo sekvenování nebo sekvenování nové generace, i když to může být také časově náročné a je to jedna z dražších metod.[6][9] Sekvenování RNA lze také použít, ale mnoho laboratoří ne, protože RNA je nestabilní a náchylná k degradaci.[9]
Reference
- ^ Mulley, William R .; Hudson, Fiona; Lee, Darren; Holdsworth, Rhonda F. (2019). „Typizace tkání pro transplantaci ledvin pro hlavního nefrologa“. Nefrologie. 24 (10): 997–1000. doi:10.1111 / nep.13637. ISSN 1440-1797. PMID 31335997.
- ^ Nazahah, M .; Koh, M. B. C. (2015). "Typování tkáně a její role při transplantaci". Vědecká řada ISBT. 10 (S1): 115–123. doi:10.1111 / voxs.12168. ISSN 1751-2824.
- ^ A b C Mahdi, Batool Mutar (2013-02-23). „Záře psaní HLA při transplantaci orgánů“. Klinická a translační medicína. 2 (1): 6. doi:10.1186/2001-1326-2-6. ISSN 2001-1326. PMC 3598844. PMID 23432791.
- ^ Argani, Hassan (leden 2019). „Protilátka proti HLA: role epitopů při transplantaci orgánů“. Experimentální a klinická transplantace. 17 (Suppl 1): 38–42. doi:10 6002 / atd. MEZOT2018.L41. PMID 30777521.
- ^ Zhang, Rubin (01.01.2018). „Protilátky specifické pro dárce u příjemců transplantace ledvin“. Klinický časopis Americké nefrologické společnosti. 13 (1): 182–192. doi:10,2215 / CJN.00700117. ISSN 1555-9041. PMC 5753302. PMID 28446536.
- ^ A b C d E F Deaglio, Silvia; Amoroso, Antonio; Rinaldi, Mauro; Boffini, Massimo (2020-02-13). „Typizace HLA při transplantaci plic: vyhovuje vysoké rozlišení všem?“. Annals of Translational Medicine. 8 (3): 45. doi:10,21037 / atm.2020.01.45. ISSN 2305-5847. PMC 7036624. PMID 32154803.
- ^ Kishore, Amit; Petrek, Martin (2018). „Psaní HLA sekvenováním nové generace: dešifrování imunogenetických aspektů sarkoidózy“. Frontiers in Genetics. 9: 503. doi:10.3389 / fgene.2018.00503. ISSN 1664-8021. PMC 6210504. PMID 30410504.
- ^ Mahdi, Batool Mutar (2013-02-23). „Záře psaní HLA při transplantaci orgánů“. Klinická a translační medicína. 2 (1): 6. doi:10.1186/2001-1326-2-6. ISSN 2001-1326. PMC 3598844. PMID 23432791.
- ^ A b C d E F G Dunn, P. P. J. (2011). "Typizace lidského leukocytového antigenu: techniky a technologie, kritické hodnocení". International Journal of Imunogenetics. 38 (6): 463–473. doi:10.1111 / j.1744-313X.2011.01040.x. ISSN 1744-313X. PMID 22059555.
