Termochemický cyklus - Thermochemical cycle
Termochemické cykly kombinovat pouze zdroje tepla (termo) s chemikálie reakce na rozdělení voda do jeho vodík a kyslík komponenty.[1] Termín cyklus se používá, protože kromě vody, vodíku a kyslíku se chemické sloučeniny používané v těchto procesech kontinuálně recyklují.
Li práce je částečně použit jako vstup, výsledný termochemický cyklus je definován jako hybridní.
Dějiny
Tento koncept poprvé navrhli Funk a Reinstrom (1966) jako maximálně efektivní způsob výroby paliva (např. vodík, amoniak ) ze stabilních a hojných druhů (např. voda, dusík ) a zdroje tepla.[2] Ačkoli se o dostupnosti paliva sotva uvažovalo ropná krize efektivní výroba paliva byla důležitým problémem specializované trhy. Jako příklad lze uvést v vojenská logistika pole, poskytování paliv pro vozidla na vzdálených bojištích je klíčovým úkolem. Proto je mobilní výrobní systém založený na přenosném zdroji tepla (a nukleární reaktor Po ropné krizi bylo vytvořeno několik programů (Evropa, Japonsko, USA), které navrhují, testují a kvalifikují tyto procesy pro účely, jako je energetická nezávislost. Vysokoteplotní (1 000 K) jaderné reaktory byly stále považovány za pravděpodobné zdroje tepla. Optimistická očekávání založená na počátečních studiích termodynamiky však byla rychle zmírněna pragmatickými analýzami porovnávajícími standardní technologie (termodynamické cykly pro výrobu elektřiny ve spojení s elektrolýza vody ) a četnými praktickými problémy (nedostatečné teploty dokonce i jaderných reaktorů, pomalá reaktivita, koroze reaktoru, významné ztráty meziproduktů v čase ...).[3] Zájem o tuto technologii tedy během následujících desetiletí opadl,[4] nebo se uvažovalo alespoň o některých kompromisech (hybridní verze) s použitím elektřiny jako částečného energetického vstupu namísto pouze tepla pro reakce (např. Hybridní sírový cyklus ). Znovuzrození v roce 2000 lze vysvětlit jak novou energetickou krizí, poptávkou po elektřině, tak rychlým tempem vývoje koncentrovaná solární energie technologie, jejichž potenciálně velmi vysoké teploty jsou ideální pro termochemické procesy,[5] zatímco přátelský k životnímu prostředí strana termochemických cyklů přilákala financování v období, které se týkalo potenciálu špičkový olej výsledek.
Zásady
Štěpení vody jedinou reakcí
Zvažte systém složený z chemických látek (např. Štěpení vodou) v termodynamická rovnováha při stálém tlaku a termodynamická teplota T:
- H2Ó(l) H2(G) + 1/2 O2(G) (1)
Rovnováha je posunuta doprava, pouze pokud je energie (entalpie změna ΔH pro štěpení vody) je systému poskytována za přísných podmínek stanovených termodynamika:
- jedna část musí být uvedena jako práce, jmenovitě Gibbsova volná energie změna ΔG reakce: skládá se z „ušlechtilé“ energie, tj. za organizovaného stavu, kdy lze hmotu ovládat, jako je elektřina v případě elektrolýza vody. Ve skutečnosti generovaný tok elektronů může snížit protony (H+) na katodě a oxidují anionty (O2−) na anodě (ionty existují kvůli chemická polarita vody), čímž se získá požadovaný druh.
- druhý musí být dodán jako teplo, tj. zvýšením tepelného míchání druhu, a je stejný z definice entropie na absolutní teplotu T krát změna entropie ΔS reakce.
- (2)
Proto pro okolní teplotu T ° 298 K (kelvin ) a tlak 1 atm (atmosféra (jednotka) ) (ΔG ° a ΔS ° se rovnají 237 kJ / mol a 163 J / mol / K, vzhledem k počátečnímu množství vody), více než 80% požadované energie ΔH musí být poskytnuto jako práce, aby voda - rozdělování pokračovat.
Li fázové přechody jsou pro jednoduchost zanedbávány (např. elektrolýza vody pod tlakem k udržení vody v kapalném stavu), lze předpokládat, že ΔH et ΔS se pro danou změnu teploty významně nemění. Tyto parametry se tedy berou stejně jako jejich standardní hodnoty ΔH ° et ΔS ° při teplotě T °. V důsledku toho je práce potřebná při teplotě T
- (3)
Jelikož ΔS ° je kladný, vede zvýšení teploty ke snížení požadované práce. To je základ vysokoteplotní elektrolýza. To lze také intuitivně vysvětlit graficky. Chemické druhy mohou mít různé úrovně excitace v závislosti na absolutní teplotě T, což je míra tepelného míchání. Ten způsobí otřesy mezi atomy nebo molekulami uvnitř uzavřeného systému, takže energie šířící se mezi úrovněmi excitace se s časem zvyšuje, a zastaví se (rovnováha) pouze tehdy, když většina druhů má podobné úrovně excitace (molekula ve vysoce vzrušené úrovni se rychle vrátí do stavu nižší energie srážkami) (Entropie (statistická termodynamika) ).
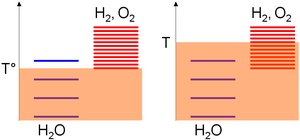
Ve vztahu k absolutní teplotní stupnici se úrovně excitace druhů shromažďují na základě standardní entalpie změna formace úvahy; tj. jejich stability. Protože tato hodnota je pro vodu nulová, ale přísně pozitivní pro kyslík a vodík, většina úrovní excitace těchto posledních druhů je nad hladinami vody. Potom se hustota úrovní excitace pro daný teplotní rozsah monotónně zvyšuje s druhovou entropií. Pozitivní změna entropie pro štěpení vody znamená mnohem více úrovní excitace v produktech. Tudíž,
- Nízká teplota (T °), tepelné míchání umožňuje převážně excitovat molekuly vody, protože hladiny vodíku a kyslíku vyžadovaly, aby bylo významně osídleno vyšší tepelné míchání (na libovolném diagramu lze naplnit 3 úrovně pro vodu vs. 1 pro kyslík / vodíkový subsystém),
- Při vysoké teplotě (T) postačuje tepelné míchání, aby byly excitovány úrovně excitace subsystému kyslík / vodík (na libovolném diagramu lze naplnit 4 úrovně pro vodu oproti 8 pro subsystém kyslík / vodík). Podle předchozích tvrzení se systém bude vyvíjet směrem ke složení, kde je většina jeho úrovní excitace podobná, tj. Většina druhů kyslíku a vodíku.
Lze si představit, že pokud by T byly dostatečně vysoké v rovnici (3), ΔG by mohlo být zrušeno, což znamená, že k rozštěpení vody by došlo i bez práce (termolýza z vody). I když je to možné, vyžadovalo by to nesmírně vysoké teploty: uvažování stejného systému přirozeně s párou místo kapalné vody (ΔH ° = 242 kJ / mol; ΔS ° = 44 J / mol / K) by tedy poskytlo požadované teploty nad 3000 K, což konstrukce a provoz reaktoru jsou mimořádně náročné.[6]
Jedna reakce tedy nabízí pouze jeden stupeň volnosti (T) k výrobě vodíku a kyslíku pouze z tepla (i když za použití Le Chatelierův princip by také umožnilo mírné snížení teploty termolýzy, je v tomto případě nutné zajistit odtah plynných produktů ze systému)
Rozštěpení vody s několika reakcemi
Naopak, jak ukazují Funk a Reinstrom, několik reakcí (např. k kroky) poskytují další prostředky umožňující spontánní štěpení vody bez práce díky různým změnám entropie ΔS °i pro každou reakci i. Další výhodou ve srovnání s termolýzou vody je to, že kyslík a vodík se vyrábějí samostatně, čímž se zabrání složitému dělení při vysokých teplotách.[7]
První předpoklady (Rovnice (4) a (5)), aby více reakcí i bylo ekvivalentem štěpení vodou, jsou triviální (srov. Hessův zákon ):
- (4)
- (5)
Podobně je práce ΔG požadovaná procesem součtem každé reakční práce ΔGi:
- (6)
Jako ekv. (3) je obecný zákon, lze jej znovu použít k vývoji každé ΔGi období. Pokud jsou reakce s pozitivními (index p) a negativními (n index) změny entropie vyjádřeny jako samostatné součty, dává to,
- (7)
Pomocí ekv. (6) pro standardní podmínky umožňuje faktorizaci ΔG °i podmínky, poddajné,
- (8)
Nyní zvažte příspěvek každého součtu v rovnici. (8): aby se minimalizovalo ΔG, musí být co nejvíce negativní:
- : -ΔS °i jsou záporné, takže (T-T °) musí být co nejvyšší: proto je třeba zvolit provoz při maximální procesní teplotě TH
- : -ΔS °i jsou pozitivní, (T-T °) by měly být v ideálním případě negativní, aby se snížila ΔG. V praxi lze pouze nastavit T se rovná T ° jako minimální procesní teplota, abychom se zbavili tohoto nepříjemného termínu (proces vyžadující nižší než standardní teplotu pro výrobu energie je fyzická absurdita, protože by vyžadoval ledničky, a tedy vyšší pracovní vstup než výstup). V důsledku toho se rovnice (8) stává,
- (9)
Nakonec lze z této poslední rovnice odvodit vztah požadovaný pro požadavek nulové práce (ΔG ≤ 0)
- (10)
V důsledku toho lze termochemický cyklus s kroky i definovat jako sekvenci i reakcí ekvivalentní štěpení vodou a splňující rovnice (4), (5) a (10). Klíčovým bodem, který si v tomto případě pamatujte, je teplota procesu TH může být teoreticky libovolně zvolen (1 000 K jako reference ve většině minulých studií, pro vysokoteplotní jaderné reaktory), hluboko pod termolýzou vody.
Tuto rovnici lze alternativně (a přirozeně) odvodit pomocí Carnotova věta, které musí respektovat systém složený z termochemického procesu spojeného s jednotkou produkující dílo (chemické látky jsou tedy v uzavřené smyčce):

- pro cyklický provoz jsou zapotřebí alespoň dva zdroje tepla různých teplot, jinak věčný pohyb by bylo možné. To je v případě termolýzy triviální, protože palivo je spotřebováno inverzní reakcí. V důsledku toho, pokud existuje pouze jedna teplota (termolýza), maximální zotavení práce v palivovém článku se rovná opaku Gibbsovy volné energie reakce štěpící vodu při stejné teplotě, tj. Nulové podle definice termolýzy. Nebo jinak řečeno, palivo je definováno jeho nestabilitou, takže pokud systém voda / vodík / kyslík existuje pouze jako vodík a kyslík (rovnovážný stav), spalování (motor) nebo použití v palivový článek by nebylo možné.
- endotermické reakce jsou vybírány s pozitivními změnami entropie, aby byly upřednostňovány při zvyšování teploty, a naopak u exotermních reakcí.
- maximální efektivita tepla na práci je ta z a Carnotův tepelný motor se stejnými podmínkami procesu, tj. zdroj horkého tepla v TH a studený při T °,
- (11)
- pracovní výkon W je „ušlechtilá“ energie uložená ve vodíku a kyslíkových produktech (např. uvolněná jako elektřina během spotřeby paliva v a palivový článek ). Odpovídá tedy volné změně Gibbsovy energie rozštěpení vody ΔG a je maximální podle rovnice (3) při nejnižší teplotě procesu (T °), kde se rovná G °.
- tepelný vstup Q je teplo poskytované horkým zdrojem při teplotě TH do i endotermický reakce termochemického cyklu (subsystém spotřeby paliva je exotermické ):
- (12)
- Proto každá potřeba tepla při teplotě TH je,
- (13)
- Nahrazením rovnice (13) v rovnici (12) se získá:
- (14)
V důsledku toho nahrazení W (ΔG °) a Q (rovnice (14)) v rovnici (11) dává po reorganizaci rovnici (10) (za předpokladu, že ΔSi se významně nemění s teplotou, tj. jsou rovny ΔS °i)
Rovnice (10) má praktické důsledky ohledně minimálního počtu reakcí pro takový proces podle maximální teploty procesu TH.[8] Číselná aplikace (ΔG ° se rovná 229 kJ / K pro vodu považovanou za páru) v případě původně zvolených podmínek (vysokoteplotní jaderný reaktor s TH a T ° respektive 1000 K a 298 K) dává minimální hodnotu kolem 330 J / mol / K. pro součet změn pozitivní entropie ΔS °i reakcí procesu.
Tato poslední hodnota je velmi vysoká, protože většina reakcí má hodnoty změny entropie pod 50 J / mol / K a dokonce i zvýšená (např. Štěpení vody z kapalné vody: 163 J / mol / K) je dvakrát nižší. V důsledku toho jsou termochemické cykly složené z méně než tří kroků u původně plánovaných zdrojů tepla (pod 1000 K) prakticky nemožné nebo vyžadují „hybridní“ verze
Hybridní termochemické cykly
V tomto případě je přidán další stupeň volnosti pomocí relativně malého pracovního vstupu Wpřidat (maximální pracovní spotřeba, rovnice (9) s ΔG ≤ Wpřidat) a Rovnice (10) se stává,
- (15)
Pokud Wpřidat je vyjádřen jako zlomek F procesního tepla Q (rovnice (14)), rovnice (15) se stane po reorganizaci,
- (16)
Použití pracovního vstupu se rovná zlomku f tepelného vstupu je ekvivalentní s výběrem reakcí k provedení čistě podobného termochemického cyklu, ale s horkým zdrojem se teplotou zvýšenou o stejný podíl f.
Přirozeně to ve stejném poměru snižuje účinnost tepla na práci F. Pokud tedy chcete proces podobný termochemickému cyklu, který pracuje se zdrojem tepla 2 000 K (místo 1 000 K), je maximální účinnost tepla na práci dvakrát nižší. Jelikož skutečná účinnost je často výrazně nižší než ideální, je takový proces silně omezen.
Prakticky je použití práce omezeno na klíčové kroky, jako je separace produktů, kde techniky spoléhající se na práci (např. Elektrolýza) mohou mít někdy méně problémů než ty, které používají pouze teplo (např. destilace )
Zvláštní případ: Dvoukrokové termochemické cykly
Podle rovnice (10) se minimální požadovaná změna entropie (pravý člen) pro součet pozitivních změn entropie sníží, když TH zvyšuje. Jako příklad lze uvést provedení stejné numerické aplikace, ale s TH rovné 2 000 K by poskytlo dvakrát nižší hodnotu (kolem 140 kJ / mol), což umožňuje termochemické cykly pouze se dvěma reakcemi. S takovými procesy lze realisticky spojit koncentrovaná solární energie technologie jako Solar Updraft Tower. Jako příklad v Evropě je to cíl Hydrosol-2 projekt (Řecko, Německo (Německé letecké středisko ), Španělsko, Dánsko, Anglie) [9] a výzkumů solárního oddělení ETH Curych a Paul Scherrer Institute (Švýcarsko).[10]
Příklady reakcí uspokojujících vysoké změny entropie jsou oxid kovu disociace, protože produkty mají více úrovní excitace kvůli jejich plynnému stavu (kovové páry a kyslík) než reaktant (pevná látka s krystalickou strukturou, takže symetrie dramaticky snižuje počet různých úrovní excitace). V důsledku toho mohou být tyto změny entropie často větší než změny štěpící vodu, a proto je v termochemickém procesu nutná reakce se zápornou změnou entropie, takže je splněn rovnice (5). Dále, za předpokladu podobných stabilit reaktantu (ΔH °) jak pro termolýzu, tak pro disociaci oxidů, větší změna entropie ve druhém případě vysvětlila opět nižší reakční teplotu (Rov. (3)).
Předpokládejme dvě reakce s pozitivními (1 dolní index, u TH) a negativní (2 dolní index, při T °) změny entropie. Lze odvodit další vlastnost, aby měl TH přísně nižší než teplota termolýzy: Standardní termodynamické hodnoty musí být nerovnoměrně rozloženy mezi reakce .[11]
Podle obecných rovnic (2) (spontánní reakce), (4) a (5) musí člověk skutečně uspokojit,
- (17)
Proto pokud ΔH °1 je úměrná ΔH °2 o daný faktor, a pokud ΔS °1 a ΔS °2 následovat podobný zákon (stejný faktor proporcionality), nerovnost (17) je porušena (rovnost místo, takže TH se rovná teplotě termolýzy vody).
Příklady
Byly navrženy a prozkoumány stovky takových cyklů. Tento úkol byl usnadněn dostupností počítačů, což umožňuje systematické prověřování sekvencí chemických reakcí na základě termodynamických databází.[12] V tomto článku budou popsány pouze hlavní „rodiny“.[13]
cykly s více než 3 kroky nebo hybridní
Cykly založené na chemii síry
Výhodou síra chemický prvek je jeho vysoká kovalence. Ve skutečnosti může tvořit až 6 chemické vazby s dalšími prvky, jako je kyslík (např. sírany), tj. široká škála oxidační stavy. Proto jich existuje několik redox reakce zahrnující takové sloučeniny. Tato svoboda umožňuje četné chemické kroky s různými změnami entropie, a nabízí tak větší šanci na splnění kritérií požadovaných pro termochemický cyklus (srov. Zásady). Většina prvních studií byla provedena v USA, například na Kentucky University pro cykly sulfidových bází.[14] Cykly založené na síranu byly studovány ve stejné laboratoři [15] a také na Národní laboratoř Los Alamos [16] a v Obecná atomika. Významné výzkumy založené na síranech (např. FeSO4 a CuSO4) byly provedeny také v Německu [17] a v Japonsku.[18][19] Cyklus, který vedl k nejvyšším zájmům, je však pravděpodobně (Cyklus síra-jod ) jeden (zkratka: S-I) objevený General Atomics.[20]
Cykly založené na obráceném diakonském procesu
Nad 973 K je diakonská reakce obrácena, čímž se získá chlorovodík a kyslík z vody a chlór:
- H2O + Cl2 → 2 HCl + 1/2 O2
Viz také
- Cyklus oxidu železa
- Cyklus oxidu ceričitého a oxidu ceričitého
- Cyklus měď-chlor
- Hybridní sírový cyklus
- Hydrosol-2
- Cyklus síra-jod
- Cyklus zinku a oxidu zinečnatého
- Cyklus UT-3
Reference
- ^ Produkce vodíku: termochemické cykly - Idaho National Laboratory (INL)
- ^ Funk, J.E., Reinstrom, R.M., 1966. Energetické požadavky při výrobě vodíku z vody. Návrh a vývoj procesu I&EC 5 (3): 336-342.
- ^ Shinnar, R., Shapira, D., Zakai, S., 1981. Termochemické a hybridní cykly pro výrobu vodíku. Diferenciální ekonomické srovnání s elektrolýzou. Návrh a vývoj procesu I&EC 20 (4): 581-593.
- ^ Funk, J.E., 2001. Termochemická výroba vodíku: minulost a současnost. International Journal of Hydrogen Energy 26 (3): 185: 190.
- ^ Steinfeld, A., 2005. Solární termochemická výroba vodíku - přehled. Solární energie 78 (5): 603-615
- ^ Lédé, J., Lapicque, F., Villermaux, J., Cales, B., Ounalli, A., Baumard, J.F., Anthony, A.M., 1982. Výroba vodíku přímým tepelným rozkladem vody: předběžná šetření. International Journal of Hydrogen Energy 7 (12): 939-950.
- ^ Kogan, A., 1998. Přímé solární termické štěpení vody a separace produktů na místě - II. Experimentální studie proveditelnosti. International Journal of Hydrogen Energy 23 (9): 89-98.
- ^ Abraham, B.M., Schreiner, F., 1974. Obecné principy základních chemických cyklů, které tepelně rozkládají vodu na prvky. I&EC Fundamentals 13 (4): 305-310.
- ^ Roeb, M., Neises, M., Säck, J.P., Rietbrock, P., Monnerie, N .; Dersch, J., Schmitz, S., Sattler, C., 2009. Operační strategie dvoustupňového termochemického procesu pro výrobu solárního vodíku. International Journal of Hydrogen Energy 34 (10): 4537-4545.
- ^ Schunk, L.O., Lipinski, W., Steinfeld, A., 2009. Model přenosu tepla solárního přijímače-reaktoru pro tepelnou disociaci ZnO - experimentální validace při 10 kW a měřítku do 1 MW. Chemical Engineering Journal 150 (2-3): 502-508.
- ^ Glandt, E.D., Myers, A.L., 1976. Produkce vodíku z vody pomocí chemických cyklů. Návrh a vývoj procesů I&EC 15 (1): 100-108.
- ^ Russel, J.L., Porter, J.T., 1975. Hledání termochemických cyklů štěpení vody. Verziroglu, T.N., Hydrogen Energy, 517-529, Plenum
- ^ Chao, R.E., 1974. Termochemické procesy rozkladu vody. I&EC Product Research Development 13 (2): 94-101.
- ^ Ota K., Conger, W.L., 1977. Termochemická výroba vodíku cyklem za použití baria a síry: reakce mezi sirníkem barnatým a vodou. International Journal of Hydrogen Energy 2 (2): 101: 106.
- ^ Soliman, M.A., Conger, W.L., Carty, R.H., Funk, J.E., Cox, K.E., 1976. Výroba vodíku pomocí termochemických cyklů na základě chemie síry. International Journal of Hydrogen Energy 1 (3): 265-270.
- ^ Mason, C.F.m 1977. Redukce bromovodíku za použití sloučenin přechodných kovů. International Journal of hydrogen energy 1 (4): 427-434.
- ^ Schulten, R.m Knoche, K.F., Erzeugung von Wasserstoff und Sauerstoff aus Wasser mit Hilfe von Wärme. Německý patent č. 2 257 103, 26. prosince 1974
- ^ Yoshida, K., Kameyama, H., Toguchi, K., 1975. Proceedings of the US Japan Joint Seminar Publication Office Ohta's Laboratory Yokohama National University, Tokio, 20. – 23. Června
- ^ Kameyama, H., Yoshida, K., Kunii, D., 1976. Metoda screeningu možných procesů termochemického rozkladu vody pomocí diagramů deltaG-T. The Chemical Engineering Journal 11 (3): 223-229.
- ^ Besenbruch, G. 1982. Obecný proces atomové síry a jodu termochemický proces štěpení vody. Proceedings of the American Chemical Society, Div. Mazlíček Chem., 27 (1): 48-53.



















