Redukce s kovovými alkoxyaluminiumhydridy - Reductions with metal alkoxyaluminium hydrides
Redukce s kovovými alkoxyaluminiumhydridy jsou chemické reakce, které zahrnují buď čistou hydrogenaci nenasycené sloučeniny nebo nahrazení redukovatelné funkční skupina s vodíkem kovovými alkoxyaluminiumhydridovými činidly.[1][2]
Úvod
Borohydrid sodný a lithiumaluminiumhydrid se běžně používají k redukci organických sloučenin.[3][4] Tato dvě činidla jsou v extrémních reaktivitách - zatímco lithiumaluminiumhydrid reaguje s téměř všemi redukovatelnými funkčními skupinami, borohydrid sodný reaguje s mnohem omezenějším rozsahem funkční skupiny. Sníženou nebo zvýšenou reaktivitu lze dosáhnout nahrazením jednoho nebo více vodíků v těchto reakčních činidlech alkoxyskupinami.
Kromě toho substituce chirálních alkoxyskupin vodíkem v těchto činidlech umožňuje asymetrické redukce.[5] Ačkoli metody zahrnující stechiometrický množství chirálních hydridů kovů bylo v moderní době nahrazeno enantioselektivní katalytické redukce, jsou historicky zajímavé jako časné příklady stereoselektivních reakcí.
Tabulka níže shrnuje redukce, které lze provést s různými hydridy a borohydridy kovů. Symbol „+“ označuje, že ke snížení nedochází, „-“ označuje, že ke snížení nedochází, „±“ označuje, že snížení závisí na struktuře podkladu, a „0“ označuje nedostatek informací z literatury.

(1)
Mechanismus a stereochemie
Převládající mechanismus
Redukce pomocí alkoxyaluminiumhydridů se ve většině případů předpokládá, že bude probíhat polárním mechanismem.[6] Přenos hydridů na organický substrát generuje organický aniont, který je neutralizován buď protickým rozpouštědlem, nebo po kyselém zpracování.

(2)
Snížení α, β-nenasycených karbonylových sloučenin se může objevit v 1,2 smyslu (přímé přidání) nebo 1,4 smyslu (přidání konjugátu). Tendence přidávat v 1,4 smyslu koreluje s měkkostí hydridového činidla podle Pearsonovy tvrdě měkké acidobazické teorie.[7] Výsledky experimentu souhlasí s teorií - měkčí hydridová činidla poskytují vyšší výtěžky produktu redukce konjugátu.[8]

(3)
Několik substrátů, včetně diarylketonů,[9] diarylalkeny,[10] a anthracen,[11] je známo, že procházejí redukcí pomocí přenosů s jedním elektronem pomocí lithiumaluminiumhydridu.
Činidla na bázi alkoxylaluminiumhydridu jsou dobře charakterizována v omezeném počtu případů.[12] Přesná charakterizace je v některých případech komplikována disproporcionací, při které se alkyoxyaluminiumhydridy přeměňují na alkoxyalumináty a hydrid hlinitý na kov:[13]
- LiAlHn(NEBO)4-n ⇌ (4-n) LiAlH4 + n LiAlH (NEBO)4
(4)
Stereochemie
Původ diastereoselektivita Redukce chirálních ketonů byla rozsáhle analyzována a modelována.[14][15] Podle modelu, který vyvinul Felkin,[16] diastereoselektivita je řízena relativní energií tří přechodových stavů Já, II, a III. Přechodový stav Já je preferován v nepřítomnosti polárních skupin na a uhlíku a stereoselektivita se zvyšuje s rostoucí velikostí achirálního ketonového substituentu (R). Přechodový stav III je výhodné pro redukci alkylketonů, ve kterých RM je skupina přitahující elektrony, protože nukleofil a substituent přitahující elektrony jsou raději co nejdále od sebe.

(5)
Rovněž byla studována diastereoselektivita při redukci cyklických ketonů. Konformačně flexibilní ketony procházejí axiálním útokem hydridového činidla, což vede k rovníkovému alkoholu. Tuhé cyklické ketony, na druhé straně, procházejí primárně rovníkovým útokem, aby poskytly axiální alkohol. Preferenční ekvatoriální útok na tuhé ketony byl racionalizován vyvoláním „kontroly sterického přístupu“ - ekvatoriální přístup hydridového činidla je méně stéricky bráněn než axiální přístup.[17] Preference axiálního útoku na konformačně flexibilní cyklické ketony byla řešena modelem navrženým Felkinem a Anhem.[18][19] Přechodový stav pro axiální útok (IV) trpí stérickým kmenem mezi jakýmikoli axiálními substituenty a přicházejícím hydridovým činidlem. Přechodný stav pro rovníkový útok (PROTI) trpí torzní deformací mezi přicházejícím hydridovým činidlem a sousedními rovníkovými vodíky. Rozdíl mezi těmito dvěma deformačními energiemi určuje, který směr útoku je upřednostňován, a když R je malý, dojde k torzní deformaci PROTI dominuje a upřednostňuje se rovníkový alkoholový produkt.

(6)
Rozsah a omezení
Alkoxyaluminium a blízce příbuzná hydridová činidla snižují širokou škálu funkční skupiny, často s dobrou selektivitou. Tato část, uspořádaná podle funkční skupiny, zahrnuje nejběžnější nebo synteticky nejužitečnější způsoby redukce alkoxyaluminiumhydridu organické sloučeniny.
Mnoho selektivních redukcí karbonylové sloučeniny lze dosáhnout využitím jedinečných profilů reaktivity kovových alkoxylaluminiumhydridů. Například lithium tri-tert-butoxy) hydrid hlinitý (LTBA) redukuje aldehydy a ketony selektivně v přítomnosti esterů, se kterými reaguje extrémně pomalu.[20]

(8)
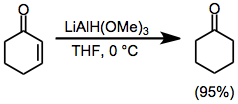
a, β-Nenasycené ketony mohou být selektivně redukovány v 1,2 nebo 1,4 smyslu uvážlivým výběrem redukčního činidla. Použití relativně neomezeného trimethoxyaluminiumhydridu lithného vede k téměř kvantitativnímu přímému přidání do karbonylové skupiny (Rov. (9)).[21] Na druhou stranu použití objemného činidla LTBA vede k vysokému výtěžku konjugovaného adičního produktu (Rov. (10)).[22]

(9)
(10)
Štěpení etherem je u většiny hydridových reagencií obtížné. Debenzylaci benzylaryletherů však lze provést pomocí SMEAH.[23] Tento protokol je užitečnou alternativou k metodám vyžadujícím kyselou nebo hydrogenolýzu (např. Pd / C a plynný vodík).

(11)
Epoxidy jsou obecně atakovány alkoxyaluminiumhydridy v méně substituované poloze. Blízká hydroxylová skupina může usnadnit intramolekulární dodávku hydridového činidla, což umožňuje selektivní otevření 1,2-disubstituovaných epoxidů v poloze blíže k hydroxylové skupině.[24] Konfigurace na nedotčeném epoxidovém uhlíku je zachována.

(12)
Nenasycené karbonylové sloučeniny mohou být redukovány buď na nasycené nebo nenasycené alkoholy reagenty alkoxyaluminiumhydridu. Přidáním nenasyceného aldehydu k roztoku Red-Al se získá nasycený alkohol; inverzní přidání poskytlo produkt nenasyceného alkoholu.[25]

(13)
Alkeny procházejí hydroaluminací v přítomnosti některých alkoxyaluminiumhydridů.[26] V související aplikaci NaAlH2(OCH2CH2OCH3)2 (bis (methoxyethoxy) aluminiumdihydrid sodný, SMEAH nebo Red-Al) reaguje s zirkonocen dichloridem, čímž se získá hydrid zirkonocen chloridu (Schwartzovo činidlo). Alkeny procházejí hydrozirkonací v přítomnosti tohoto činidla a po kalení elektrofilem poskytují funkcionalizované produkty.[27]

(14)
Funkční skupiny obsahující jiné heteroatomy než kyslík lze také redukovat na odpovídající uhlovodíky v přítomnosti činidla obsahujícího alkoxyaluminiumhydrid. Primární alkylhalogenidy podléhají redukci na odpovídající alkany v přítomnosti NaAlH (OH) (OCH2CH2OCH3)2. Sekundární halogenidy jsou méně reaktivní, ale poskytují alkany v rozumném výtěžku.[28]

(15)
Sulfoxidy se redukují na odpovídající sulfidy v dobrém výtěžku v přítomnosti SMEAH.[29]

(16)
Iminy jsou redukovány kovovými alkoxyaluminiumhydridy na odpovídající aminy. V níže uvedeném příkladu použití exo aminové formy s vysokou diastereoselektivitou. Selektivita redukce hydridu je v tomto případě vyšší než selektivita katalytické hydrogenace.[30]

(16)
Experimentální podmínky a postup
Příprava hydridových reagencií
Alkoxyaluminiumhydridy se typicky připravují zpracováním lithiumaluminiumhydridu s odpovídajícím alkoholem.[31] Vývoj vodíku naznačuje tvorbu produktů alkoxyaluminium hydridu. Omezené hydridy, jako je lithium tri- (tert-butoxy) aluminiumhydrid (LTBA) jsou stabilní po dlouhou dobu v inertní atmosféře, ale trimethoxyaluminiumhydrid lithný (LTMA) podléhá disproporcionaci a měl by být použit ihned po přípravě. Čistý, pevný Red-Al je stabilní několik hodin v inertní atmosféře a je komerčně dostupný jako 70% roztok v toluenu pod obchodním názvem Vitride nebo Synhydrid.
Podmínky redukce
Redukce se obvykle provádí v baňce s kulatým dnem vybavené zpětným chladičem uzavřeným sušicí trubicí, rtuťovým utěsněným míchadlem, teploměrem, přívodem dusíku a přídavnou nálevkou s postranním ramenem vyrovnávajícím tlak. Nejběžnější používaná rozpouštědla jsou tetrahydrofuran a diethylether. Jakékoli použité rozpouštědlo by mělo být bezvodé a čisté. Alkoxyaluminiumhydridy by měly být udržovány co nejsušší a představovat významné nebezpečí požáru, zejména při použití nadbytku hydridu (během zpracování se uvolňuje vodík).
Příklad postupu[32]
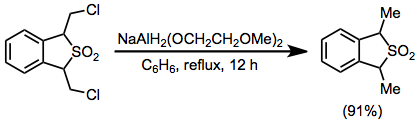
(17)
K roztoku 1,3-dihydro-1,3-bis (chlormethyl) benzo [c] thiofenu 2,2-dioxidu (0,584 g, 2,2 mmol) v 50 ml suchého benzen bylo přidáno 0,80 ml (2,8 mmol) 70% benzenového roztoku NaAlH2(OCH2CH2OCH2)2 pomocí injekční stříkačky a roztok byl refluxován po dobu 12 hodin. Směs byla ochlazena na 0 ° a rozložena 20% kyselina sírová. Benzenová vrstva byla oddělena, promyta 10 ml vody, sušena nad Uhličitan draselný a zahuštěním se získá produkt ve formě žlutého oleje v 91% výtěžku (0,480 g); IR (film) 770, 1140 a 1320 cm – 1; NMR (CDCI3) 5 4,22 (q, 2 H), 1,61 a 1,59 (2 d, 6 H, J = 7 Hz), 7,3 (s, 4 H); m / e (rel. intenzita) 196 (M +) (14), 132 (M-SO2) (100); MS analýza 196,055796 (vypočítaná), 196,057587 (obs.).
Reference
- ^ Málek, J. Org. Reagovat. 1985, 34, 1. doi:10.1002 / 0471264180.nebo034.01
- ^ Málek, J. Org. Reagovat. 1988, 36, 249. doi:10.1002 / 0471264180.nebo036.03
- ^ Brown, G. Org. Reagovat. 1951, 6, 469.
- ^ Schenker, E. v Novější metody preparativní organické chemie, Sv. IV., W. Foerst, ed., Academic Press, New York, 1968, s. 163–335.
- ^ Itsuno, S. Org. Reagovat. 1998, 52, 395.
- ^ House, O. Moderní syntetické reakce, 2. vyd., W. A. Benjamin, Menlo Park, Kalifornie, 1972.
- ^ Pearson, G. J. Chem. Educ. 1968, 45, 581.
- ^ Bottin, J .; Eisenstein, O .; Minot, C .; Anh, T. Tetrahedron Lett., 1972, 3015.
- ^ Cerný, M .; Málek, J. Sbírat. Čeština. Chem. Commun.. 41, 119 (1976).
- ^ Málek, J .; Cerný, M. J. Organomet. Chem. 1975, 84, 139.
- ^ Málek, J .; Cerný, M .; Rericha, R. Sbírat. Čeština. Chem. Commun. 1974, 39, 2656.
- ^ Bec, M .; Huet, J. Býk. Soc. Chim. Fr., 1972, 1636.
- ^ Brown, C .; Shoaf, J. J. Am. Chem. Soc. 1964, 86, 1079.
- ^ Cram, J .; Abd Elhafez, A. J. Am. Chem. Soc. 1952, 74, 5828.
- ^ Chérest, M .; Prudent, N. Čtyřstěn 1980, 36, 1599.
- ^ Chérest, M .; Felkin, H .; Prudent, N. Tetrahedron Lett., 1968, 2199.
- ^ Dauben, W. G .; Fonken, G. J .; Noyce, D. S. J. Am. Chem. Soc. 1956, 78, 2579.
- ^ Chérest, M .; Felkin, H. Tetrahedron Lett., 1971, 383.
- ^ Huet, J .; Maroni-Barnaud, Y .; Anh, N. T .; Seyden-Penne, J. Tetrahedron Lett., 1976, 159.
- ^ Torii, S .; Tanaka, H .; Inokuchi, T .; Tomozane, K. Býk. Chem. Soc. Jpn. 1982, 55, 3947.
- ^ Danh, N. C .; Arnaud, C .; Huet, J. Býk. Soc. Chim. Fr. 1974, 1071.
- ^ Durand, J .; Anh, N. T .; Huet, J. Tetrahedron Lett. 1974, 2397.
- ^ Kametani, T .; Huang, S. P .; Ihara, M .; Fukumoto, K. J. Org. Chem. 1976, 41, 2545.
- ^ Finan, M .; Kishi, Y. Tetrahedron Lett. 1982, 23, 2719.
- ^ Bazant, V .; Capka, M .; Černý, M .; Chvalovský, V .; Kochloefl, K .; Kraus, M .; Málek, J. Tetrahedron Lett., 1968, 3303.
- ^ Ashby, C .; Přikývnutí, A. J. Org. Chem. 1980, 45, 1035.
- ^ Hart, W .; Schwartz, J. J. Am. Chem. Soc. 1974, 96, 8115.
- ^ Capka, M .; Chvalovský, V. Sbírat. Čeština. Chem. Commun. 1969, 34, 3110.
- ^ Weber, L. Chem. Ber. 1983, 116, 2022.
- ^ Law, J .; Lewis, H .; Borne, F. J. Heterocycl. Chem. 1978, 15, 273.
- ^ Véle, I .; Fusek, J .; Štrouf, O. Sbírat. Čeština. Chem. Commun. 1972, 37, 3063.
- ^ Barton, T. J .; Kippenhan, R. C. J. Org. Chem. 1972, 37, 4194.
















