Dimer primeru - Primer dimer
A dimer primeru (PD) je potenciální vedlejší produkt v polymerázová řetězová reakce (PCR), běžná biotechnologická metoda. Jak název napovídá, PD se skládá ze dvou primer molekuly, které se připojily (hybridizováno ) navzájem kvůli řetězcům komplementární základny v primerech. V důsledku toho DNA polymeráza amplifikuje PD, což vede ke kompetici o reagenty PCR, čímž potenciálně inhibuje amplifikaci DNA sekvence zaměřená na amplifikaci PCR. v kvantitativní PCR, PD mohou interferovat s přesnou kvantifikací.
Mechanismus formování
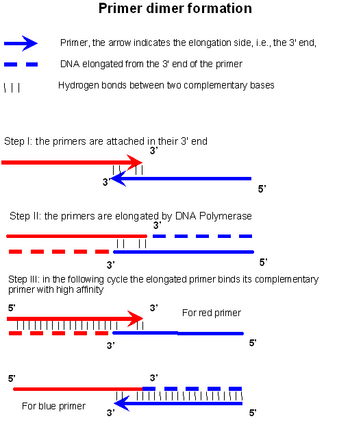
Vytvoří se dimer primeru a amplifikuje se ve třech krocích. V prvním kroku žíhají dva primery na svých příslušných 3 'koncích (krok I na obrázku). Pokud je tento konstrukt dostatečně stabilní, DNA polymeráza naváže a rozšíří primery podle komplementární sekvence (krok II na obrázku). Důležitým faktorem přispívajícím ke stabilitě konstruktu v kroku I je vysoký Obsah GC na 3 'koncích a délce překrytí. Ke třetímu kroku dochází v dalším cyklu, kdy se jako vlákno použije jedno vlákno produktu z kroku II, ke kterému nasedají čerstvé primery, což vede k syntéze více PD produktu.[1]
Detekce
Poté mohou být viditelné dimery primeru Gelová elektroforéza produktu PCR. PD v ethidiumbromid -barvené gely jsou obvykle považovány za pás 30-50 párů bází (bp) nebo nátěr střední až vysoké intenzity a odlišitelný od pásu cílové sekvence, který je obvykle delší než 50 bp.
v kvantitativní PCR, PD mohou být detekovány pomocí analýza křivky tání s interkalačními barvivy, jako je např SYBR Green I, nespecifické barvivo pro detekci dvouvláknové DNA. Protože se obvykle skládají z krátkých sekvencí, PD se denaturují při nižší teplotě než cílová sekvence, a proto je lze odlišit podle jejich charakteristik křivky tání.
Zabránění tvorbě primeru-dimeru
Jeden přístup k prevenci PD spočívá ve fyzikálně-chemické optimalizaci systému PCR, tj. Změně koncentrací primerů, chlorid hořečnatý, nukleotidy, iontová síla a teplota reakce. Tato metoda je poněkud omezena fyzikálně-chemickými charakteristikami, které také určují účinnost amplifikace cílové sekvence v PCR. Proto může snížení tvorby PD také vést ke snížení účinnosti PCR. K překonání tohoto omezení mají jiné metody za cíl omezit pouze tvorbu PD, včetně designu primerů a použití různých enzymových systémů nebo reagencií PCR.[Citace je zapotřebí ]
Software pro návrh základního nátěru
Software pro návrh primeru používá algoritmy, které kontrolují potenciál DNA sekundární struktura tvorba a nasedání primerů na sebe nebo do párů primerů. Fyzické parametry, které software bere v úvahu, jsou potenciální autokomplementarita a obsah GC primerů; podobné teploty tání primerů; a absence sekundárních struktur, jako např kmenové smyčky v cílové sekvenci DNA.[2]
Hot-start PCR
Protože primery jsou navrženy tak, aby se navzájem vzájemně málo komplementovaly, mohou žíhat (krok I na obrázku) pouze při nízké teplotě, např. teplota místnosti, jako například během přípravy reakční směsi. Ačkoli DNA polymerázy používané v PCR jsou nejaktivnější kolem 70 ° C, mají určitou polymerační aktivitu také při nižších teplotách, což může způsobit vzájemnou syntézu DNA z primerů.[3] Bylo vyvinuto několik metod, které zabraňují tvorbě PD, dokud reakce nedosáhne pracovní teploty (60-70 ° C), a zahrnují počáteční inhibici DNA polymerázy nebo fyzickou separaci reakce reakčních složek, dokud reakční směs nedosáhne vyšších teplot. Tyto metody se označují jako hot-start PCR.
Vosk: v této metodě je enzym prostorově oddělen od reakční směsi voskem, který se roztaví, když reakce dosáhne vysoké teploty.[4]
Pomalé uvolňování hořčíku: DNA polymeráza vyžaduje pro svoji aktivitu ionty hořčíku,[5] takže hořčík je chemicky oddělen od reakce vazbou na chemickou sloučeninu a do roztoku se uvolňuje pouze při vysoké teplotě [6]
Nekovalentní vazba inhibitoru: v této metodě a peptid, protilátka[7] nebo aptamer[8] jsou nekovalentně váže se na enzym při nízké teplotě a inhibuje jeho aktivitu. Po inkubaci 1–5 minut při 95 ° C se inhibitor uvolní a začne reakce.
Taq polymeráza citlivá na chlad: je modifikovaná DNA polymeráza s téměř žádnou aktivitou při nízké teplotě.[9]
Chemická modifikace: v této metodě je malá molekula kovalentně vázán do boční řetěz z aminokyselina v Aktivní stránky DNA polymerázy. Malá molekula se uvolňuje z enzymu inkubací reakční směsi po dobu 10–15 minut při 95 ° C. Jakmile se malá molekula uvolní, aktivuje se enzym.[10]
Strukturální modifikace primerů
Dalším přístupem k prevenci nebo snížení tvorby PD je modifikace primerů tak, aby hybridizace se sebou navzájem nezpůsobila prodloužení.
RUCE (Homo-tag Apomáhal Nna-Dimer System[11]): nukleotidový ocas, komplementární ke 3 'konci primeru, je přidán na 5' konec primeru. Vzhledem k těsné blízkosti 5 'ocasu žíhá ke 3' konci primeru. Výsledkem je a kmenová smyčka primer, který vylučuje nasedání zahrnující kratší překrytí, ale umožňuje nasednutí primeru na jeho plně komplementární sekvenci v cíli.
Chimérické primery: některé báze DNA v primeru jsou nahrazeny bázemi RNA, čímž se vytvoří a chimérická sekvence. Teplota tání chimérické sekvence s jinou chimérickou sekvencí je nižší než teplota tání chimérické sekvence s DNA. Tento rozdíl umožňuje nastavení teploty nasedání tak, že primer bude nasedat na svou cílovou sekvenci, ale ne na jiné chimérické primery.[12]
Blokované štěpitelné primery: metoda známá jako PCR závislá na RNáze H (rhPCR)[13], využívá termostabilní RNázu HII k odstranění blokující skupiny z PCR primerů při vysoké teplotě. Tento enzym RNáza HII nevykazuje téměř žádnou aktivitu při nízké teplotě, takže k odstranění bloku dochází pouze při vysoké teplotě. Enzym také vlastní inherentní diskriminaci primeru: templátu, což vede k další selekci proti primer-dimerům.
Zabránění získávání signálu z dimerů primerů
Zatímco výše uvedené metody jsou navrženy tak, aby se snížila tvorba PD, dalším přístupem je minimalizace signálu generovaného z PD v kvantitativní PCR. Tento přístup je užitečný, pokud je vytvořeno několik PD a jejich inhibiční účinek na akumulaci produktu je malý.
Čtyři kroky PCR: používá se při práci s nespecifickými barvivy, jako je SYBR Green I. Je založen na různé délce, a tedy na různé teplotě tání PD a cílové sekvence. V této metodě je signál získáván pod teplotou tání cílové sekvence, ale nad teplotou tání PD.[14]
Sekvenčně specifické sondy: TaqMan a molekulární maják sondy generují signál pouze v přítomnosti své cílové (komplementární) sekvence a tato vylepšená specificita vylučuje získávání signálu (ale ne možné inhibiční účinky na akumulaci produktu) z PD.
Reference
- ^ Alberts; et al. (2017). Molekulární biologie buňky (6. vydání). Věnec věnec. 708–711.
- ^ Stránka návrhu primeru Leiden University Medical Center
- ^ Patel, Ewing (2008). Polymerázová řetězová reakce: Techniky a aplikace. Vědecký tisk. str. 595–599.
- ^ Chou, Quin; Russell, Marion; Birch, David E .; Raymond, Jonathan; Bloch, Will (1992). „Prevence chybného primingu před a PCR a dimerizace primeru zlepšuje amplifikace s nízkým počtem kopií“. Výzkum nukleových kyselin. 20 (7): 1717–23. doi:10.1093 / nar / 20.7.1717. PMC 312262. PMID 1579465.
- ^ Yang, Linjing; Arora, Karunesh; Beard, William A .; Wilson, Samuel H .; Schlick, Tamar (2004). „Kritická role iontů hořčíku při uzavírání a sestavování aktivního místa DNA polymerázy beta“. Journal of the American Chemical Society. 126 (27): 8441–53. doi:10.1021 / ja049412o. PMID 15238001.
- ^ Americká patentová přihláška číslo 2007/0254327
- ^ Americké patentové číslo 5338671
- ^ Americké patentové číslo 6183967
- ^ Americké patentové číslo 6214557
- ^ Americké patentové číslo 5677152
- ^ Brownie, Jannine; Shawcross, Susan; Theaker, Jane; Whitcombe, David; Ferrie, Richard; Newton, Clive; Malý, Stephen (1997). „Odstranění akumulace primeru-dimeru v PCR“. Výzkum nukleových kyselin. 25 (16): 3235–41. doi:10.1093 / nar / 25.16.3235. PMC 146890. PMID 9241236.
- ^ „Chimérické primery pro lepší reakce amplifikace nukleové kyseliny“. Patentní čočka.
- ^ Dobosy JR, Rose SD, Beltz KR, Rupp SM, Powers KM, Behlke MA, Walder JA (srpen 2011). „RNáza H-dependentní PCR (rhPCR): zlepšená specificita a detekce polymorfismu jednoho nukleotidu pomocí blokovaných štěpitelných primerů“. BMC biotechnologie. 11: 80. doi:10.1186/1472-6750-11-80. PMC 3224242. PMID 21831278.
- ^ Čtyři kroky PCR
externí odkazy
„Online software pro predikci dimeru primeru“. OligoAnalyzer 3.1. Integrované technologie DNA.
„Návrh primeru. Co je dimer primeru?“. Youtube video.
