Předklinické SPECT - Preclinical SPECT

Preklinická počítačová tomografie s jedním fotonovým emisím s jedním fotonem nebo s malými zvířaty (SPECT ) je založený na radionuklidu molekulární zobrazování modalita pro malá laboratorní zvířata[1] (např. myši a krysy). Ačkoli SPECT je dobře zavedená zobrazovací technika, která se již po desetiletí používá pro klinické aplikace, omezené rozlišení klinického SPECT (~ 10 mm) stimulovalo vývoj specializovaných systémů SPECT malých zvířat s rozlišením pod mm. Na rozdíl od klinik předklinické SPECT překonává preklinickou náhodu PET z hlediska rozlišení (nejlepší prostorové rozlišení SPECT - 0,25 mm,[2] PET ≈ 1 mm[3][4] ) a zároveň umožňuje provádět rychlé dynamické zobrazování zvířat (méně než 15 s časové rámce)[5]).
Zobrazování SPECT vyžaduje podávání malého množství radioaktivně značených molekul emitujících y (běžně nazývaných „stopovací látky ") do zvířete před pořízením obrazu. Tyto stopovací látky jsou biochemicky navrženy tak, že se hromadí na cílových místech v těle. Záření emitované sledovacími molekulami (jednotlivé γ-fotony ) lze zjistit pomocí detektory gama a po rekonstrukci obrazu vede k trojrozměrnému obrazu distribuce stopovací látky ve zvířeti. Některé klíčové radioaktivní izotopy používané v preklinickém SPECTu jsou 99mTc, 123Já, 125Já, 131Já, 111v, 67Ga a 201Tl.
Preclinical SPECT hraje důležitou roli ve více oblastech translační výzkum[6] kde SPECT lze použít pro neinvazivní zobrazování radioaktivně značených molekul, včetně protilátek, peptidů a nanočástic. Mezi hlavní oblasti jeho aplikací patří onkologie, neurologie, psychiatrie, kardiologie, ortopedie, farmakologie a interní medicína.
Základní zobrazovací princip předklinického SPECTu
Vzhledem k malé velikosti zobrazených zvířat (myš je asi 3000krát menší než člověk měřený podle hmotnosti a objemu), je nezbytné mít pro předklinický skener vysoké prostorové rozlišení a účinnost detekce.
Prostorové rozlišení
Podíváme-li se nejprve na prostorové rozlišení, chceme-li vidět stejnou úroveň detailů relativně k např. velikost orgánů u myši, jak vidíme u člověka, je třeba zlepšit prostorové rozlišení klinického SPECT faktorem ∛3 000 ≈15 nebo vyšším. Taková překážka přinutila vědce hledat nový zobrazovací přístup pro preklinický SPECT, který byl nalezen při využívání principu dírkové zobrazovací metody.[7]

A kolimátor s dírkami sestává z kusu hustého materiálu obsahujícího pouze jednu díru, která má obvykle tvar dvojitého kužele. První pokusy o získání SPECT snímků hlodavců s vysokým rozlišením byly založeny na použití dírkových kolimátorů připojených ke konvekčním gama kamerám.[8][9] Tímto způsobem lze dosáhnout předmětu (např. Hlodavce) blízko otvoru dírky zvětšení jeho projekce na povrch detektoru a účinně kompenzovat omezené vnitřní rozlišení detektoru.
Kombinované účinky velikosti konečné clony a omezeného vnitřního rozlišení jsou popsány:
dE - efektivní průměr dírky, Ri - vnitřní rozlišení detektoru, M - faktor zvětšení projekce.
Rozlišení systému SPECT založeného na principu zobrazování dírkovou dírkou lze zlepšit jedním ze tří způsobů:
- zmenšením účinného průměru dírkové dírky
- zvětšením faktoru zvětšení
- pomocí detektorů s vyšším vnitřním rozlišením
Přesná velikost, tvar a materiál dírky jsou důležité pro získání dobrých zobrazovacích charakteristik a je předmětem studií optimalizace návrhu kolimátoru např. Použití Simulace Monte Carlo Moderní předklinické skenery SPECT založené na zobrazování dírkami mohou dosáhnout až 0,25 mm prostorového nebo 0,015 μL objemového rozlišení pro in vivo zobrazování myší.
Účinnost detekce
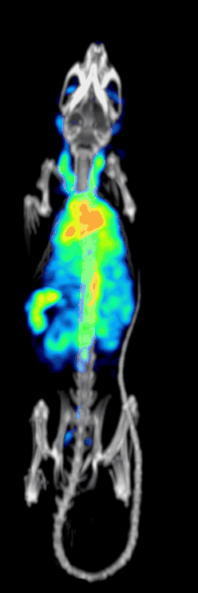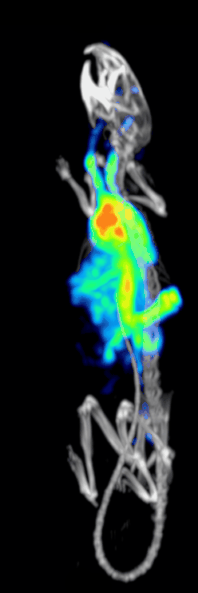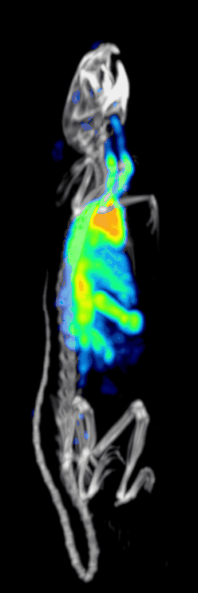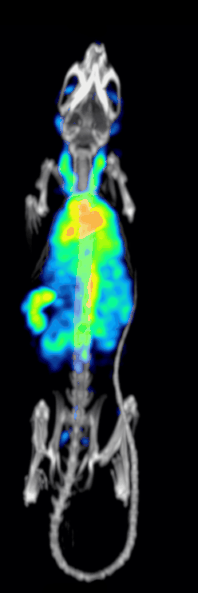
Účinnost detekce nebo citlivost předklinického systému SPECT s dírkami je dána:[10][11]
S - účinnost detekce (citlivost), dE-efektivní průměr dírky s penetrací, N - celkový počet dírek, rC - poloměr kolimátoru (např. Vzdálenost mezi dírkami).
Citlivost lze zlepšit:
- zvětšení průměru dírky
Možné nevýhody: degradace prostorového rozlišení
- zmenšení vzdálenosti mezi dírkami (např. umístění zvířete co nejblíže k otvoru dírky)
- pomocí více dírek, které současně zachycují projekce z více úhlů
Možné nevýhody: Pokud se na jeden povrch detektoru promítá více projekcí dírky, mohou se navzájem překrývat (multiplexní projekce) nebo být zcela oddělené (nepřekrývající se projekce). Ačkoli kolimátory dírkových děr s multiplexními projekcemi umožňují dosáhnout vyšší citlivosti (tím, že umožňují použít větší počet dírkových děr) ve srovnání s nepřekrývajícími se designy, trpí také více artefakty v rekonstruovaných obrazech SPECT.[12][13][14][15] Artefakty jsou způsobeny nejednoznačností ohledně původu y-fotonů detekovaných v oblastech překrytí.
- zmenšování velikosti „zorné pole "
Umístění zvířete blízko otvoru pro dírkovou dírku stojí za cenu zmenšení velikosti oblasti, kterou lze v daném čase zobrazit („zorné pole“), ve srovnání se zobrazením při menším zvětšení. V kombinaci s pohybem zvířete (tzv. „Metoda skenovacího zaostření“) [16]) větší oblast zájmu lze stále zobrazovat s dobrým rozlišením a citlivostí.
Typická účinnost detekce předklinického skeneru SPECT se pohybuje v rozmezí 0,1–0,2% (1 000–2 000 cps / MBq), což je více než desetinásobek vyšší než průměrná citlivost klinických skenerů.[17] Současně mohou vysoce citlivé kolimátory umožnit> 1% účinnost detekce a udržovat rozlišení obrazu pod mm.[18]
Návrh systému
Bylo navrženo několik návrhů systému SPECT s dírkami, včetně rotující gama kamery, stacionárního detektoru, ale rotujícího kolimátoru nebo zcela stacionární kamery[19][20] ve kterém zvíře obklopuje velké množství dírek a současně získávají projekce z dostatečného počtu úhlů pro tomografickou rekonstrukci obrazu. Stacionární systémy mají oproti nestacionárním systémům několik výhod:
- není třeba opakovanou kalibraci geometrie systému
Proč: kvůli stabilní poloze detektoru (detektorů) a kolimátoru
- na rozdíl od nestacionárních systémů jsou stacionární systémy velmi vhodné pro dynamické zobrazování SPECT
Proč: protože všechny požadované úhlové informace jsou získávány současně několika dírkami.
Moderní stacionární předklinické systémy SPECT mohou provádět dynamické zobrazování SPECT s časovými rámci až 15 s během celého těla [5] a až 1 s časové rámce během „zaostření“ (např. zaměření na srdce) [16] akvizice obrazu.

Multimodální zobrazování

Lékařské zobrazování zahrnuje mnoho různých zobrazovacích modalit, které lze zhruba rozdělit na anatomické a funkční zobrazování. Anatomické modality (např. CT, MRI ) odhalují hlavně strukturu tkání a orgánů, zatímco funkční modality (SPECT, PET a optické zobrazování ) hlavně vizualizují fyziologii a funkci tkáně. Protože žádná ze stávajících zobrazovacích modalit nemůže poskytnout informace o všech aspektech struktury a funkce, je zřejmým přístupem buď změnit jednu zobrazovací modalitu úkolu (např. Speciální zobrazovací sekvence v MRI), nebo se pokusit zobrazit subjekt pomocí více zobrazovacích modalit . V návaznosti na multimodální přístup se v posledních letech kombinace systému SPECT / CT stala standardní kombinací modality molekulárního zobrazování v preklinické i klinické oblasti, kde strukturální informace CT doplňují funkční informace z SPECT. Integrace SPCECT s dalšími zobrazovacími modalitami (např.SPECT / MR, SPECT / PET / CT)[6][21]) není neobvyklé.
Rekonstrukce
Měření SPECT se skládá z 2-dimenzionálních projekcí distribuce radioaktivního zdroje, které jsou získány s kolimátorem a gama detektorem. Cílem algoritmu rekonstrukce obrazu je přesně rekonstruovat neznámé trojrozměrné rozložení radioaktivity.[22]
Algoritmus maximalizace pravděpodobnosti očekávání[23][24] (MLEM ) je důležitým „zlatým standardem“ v iterační rekonstrukci obrazů SPECT, ale je to také výpočetně nákladná metoda. Populární řešení této překážky je založeno na použití takzvaných metod blokové iterativní rekonstrukce. U blokových iterativních metod je každá iterace algoritmu rozdělena do mnoha následujících dílčích iterací, z nichž každá používá jinou podmnožinu dat projekce. Příkladem široce používané blokové iterativní verze MLEM je algoritmus Ordered Subsets Expectation Maximization[25] (OSEM). Zrychlení rekonstrukce úplného iteračního OSEM nad jedinou iterací MLEM je přibližně stejné jako počet podmnožin.
Kvantifikace
Preklinický SPECT je kvantitativní zobrazovací modalita. Příjem indikátorů SPECT v příslušných orgánech (oblastech) lze vypočítat z rekonstruovaných obrazů. Malá velikost laboratorních zvířat snižuje útlum fotonu v těle zvířete (ve srovnání s úbytkem fotonů u lidí). Nicméně v závislosti na energii γ-fotonů a velikosti zvířete, které se používá pro zobrazování, může být vyžadována korekce pro útlum fotonu a rozptyl, aby byla zajištěna dobrá přesnost kvantifikace. Podrobnou diskusi o účincích ovlivňujících kvantifikaci snímků SPECT lze nalézt v Hwang et al.[26]
Značky SPECT
Indikátory SPECT emitují jednotlivé γ-fotony s energií emitovaného fotonu v závislosti na izotopu, který byl použit pro radioaktivní značení indikátoru. V případech, kdy jsou různé stopovací látky radioaktivně značeny izotopy různých energií, poskytuje SPECT schopnost zkoumat několik molekulárních drah současně (zobrazení více izotopů). Dva příklady běžných kombinací multi-izotopových stopovacích látek používaných pro zobrazování SPECT jsou 123Já-NaI /99mTc-technecistan (funkce štítné žlázy[27]) nebo 99mTc-MAG3 /111V-DTPA (posouzení renální filtrace ).
Čas, který lze sledovat in vivo silně závisí na poločasu izotopu použitého pro radioaktivní značení sloučeniny. Široká škála izotopů s relativně dlouhým poločasem rozpadu (ve srovnání s izotopy typicky používanými v PET), které lze použít pro zobrazování SPECT, poskytuje jedinečnou možnost zobrazovat pomalé kinetické procesy (dny až týdny).
Další důležitou charakteristikou SPECT je jednoduchost postupu značení radioaktivním značením, kterou lze provést pomocí široké škály komerčně dostupných etiketovacích souprav.
Preklinické SPECT versus PET
Preklinické SPECT a PET jsou dva velmi podobné způsoby molekulárního zobrazování používané pro neinvazivní vizualizaci biodistribuce stopových látek radioaktivních značek, které se injikují zvířeti. Hlavní rozdíl mezi SPECT a PET spočívá v povaze radioaktivního rozpadu jejich stopovacích látek. SPECT tracer emituje jednotlivé γ-fotony s energií fotonů, která závisí na izotopu, který byl použit pro radioaktivní značení. V PET indikátor vyzařuje pozitrony, které po zničení elektrony v subjektu produkují pár 511 keV zničení fotonů emitovaných do opačných směrů. K tvorbě obrazu v PET se používá náhodná detekce těchto anihilačních fotonů. Ve výsledku byly vyvinuty různé principy detekce pro sledovače SPECT a PET, což vedlo k samostatným skenerům SPECT a PET.
Porovnání předklinických SPECT a PET je uvedeno v tabulce níže
| Vlastnosti | SPECT | PET |
|---|---|---|
| Radiační rozpad | jednotlivé γ-fotony | β+ rozklad |
| Základní princip detekce | Kolimace, jednotlivé γ-fotony | Detekce shody, zničující fotony |
| Energie γ-fotonů | Různé pro různé izotopy | 511 keV |
| Nejoblíbenější izotop | 99mTC: poločas 6,03 hodiny, γ-energie 141 keV | 18F: poločas rozpadu 108 minut, γ-energie 511 keV |
| Zobrazování více izotopů | Ano, pro izotopy s jinou energií γ-fotonu | Ne, všechny izotopy emitují fotony s energií 511 keV |
| Zobrazování pomalých dynamických procesů | Ano, pro izotop s delším poločasem rozpadu (např. 99mTc - 6,03 hodiny, 123Já - 13 hodin, 111v - 2,8 dne, 125Já - 60,14 dnů) | Omezeno rozpadem izotopu (poločas rozpadu 18F - 108 minut, 11C - 24 minut, 124Já - 4,18 dne) |
| Zobrazování rychlých dynamických procesů | > 15s snímky (zobrazení celého těla)[5] > 1 s snímky (zaostřené zobrazení) [18] | Ano, sekundy až minuty |
| Rozlišení, nejlepší | 0,25 mm (0,015 µL)[2] | 0,75 mm (0,422 µL)[28] |
| Účinnost detekce | 0.1-1.3% | 1- 10% |
| Značení radioaktivního značení (náklady) | Nízká až vysoká | Vysoký |
Moderní preklinické SPECT
Mezi výrobce předklinických systémů SPECT patří MILabs, Siemens, Bruker a Mediso.[29][30] K dispozici jsou systémy kombinující SPECT s několika dalšími modality počítaje v to PAN, PET a CT.[31][32] Mohou dosáhnout prostorového rozlišení až 0,25 mm (objemové rozlišení 0,015 μL) a až 1 sekundového dynamického neinvazivního SPECT zobrazení hlodavců.[33]
Aplikace v translačním výzkumu
SPECT lze použít pro diagnostické nebo terapeutické zobrazování. Když je radioaktivní indikátor označen primárními izotopy emitujícími gama (např. 99mTc, 123Já, 111V, 125I), získané obrazy poskytují funkční informace o biologické distribuci sloučeniny, kterou lze použít pro různé diagnostické účely. Příklady diagnostických aplikací: zobrazování metabolismu a perfuze, kardiologie, ortopedie.
Když je indikátor SPECT označen kombinovaným izotopem gama a α- nebo β-emitujícím izotopem (např. 213Bi nebo 131I), je možné kombinovat rakovinu radioizotopová terapie s α- nebo β- částice s neinvazivním zobrazením odpovědi na terapii dosaženou pomocí SPECT.
Reference
- ^ Meikle SR a kol. Malé zvíře SPECT a jeho místo v matici molekulárních zobrazovacích technologií. Phys Med Biol. 2005; 50 (22): R45-61.
- ^ A b Ivashchenko a kol. Zobrazování molekulárních myší s rozlišením na čtvrt milimetru s technologií U-SPECT +. Mol Imaging. 2014.
- ^ Walker MD a kol. Posouzení výkonnosti preklinického PET skeneru s kolimací dírky porovnáním s PET skenerem malých zvířat založeným na shodě. J Nucl Med. 2014; 55 (8): 1368-1374.
- ^ Tai Y a kol. Hodnocení výkonu zaměřeného na microPET: Skener microPET třetí generace určený pro zobrazování zvířat. J Nucl Med. 2005; 46 (3): 455-463.
- ^ A b C Vaissier PEB a kol. Rychlá spirála SPECT se stacionárními γ kamerami a zaostřovacími dírkami. J Nucl Med. 2012; 53 (8): 1292-9.
- ^ A b Bernsen MR a kol. Role preklinického SPECTu v onkologickém a neurologickém výzkumu v kombinaci s CT nebo MRI. Eur J Nucl Med Mol Imaging. 2014; 41 (1): 36-49.
- ^ Beekman FJ a kol. Dírka: brána k trojrozměrnému radionuklidovému zobrazování s ultravysokým rozlišením. Eur J Nucl Med Mol Imaging. 2007; 34 (2): 151-61.
- ^ Weber DA a kol. Pinhole SPECT: přístup k in vivo zobrazování SPECT s vysokým rozlišením u malých laboratorních zvířat. J Nucl Med. 1994; 35: 342-8.
- ^ Jaszczak RJ a kol. Kolimace dírkové díry pro SPECT s velmi vysokým rozlišením a malým zorným polem. Phys Med Biol. 1994; 39: 425-37.
- ^ A b Rentmeester MCM a kol. Optimalizace geometrií SPECT s více dírkami pomocí analytického modelu. Phys Med Biol. 2007; 52: 2567-2581.
- ^ Metzler SD a kol. Rozlišení - versus průměr účinný při kolimaci dírkových děr: experimentální ověření. Phys Med Biol. 2005; 50: 5005-5017.
- ^ Rowe RK a kol. Stacionární polokulovitý snímač SPECT pro trojrozměrné zobrazování mozku. J Nucl Med.1993; 34: 474-80.
- ^ Meike SR a kol. Prototypový detektor clony pro malé zvíře SPECT. IEEE Trans Nucl Sci. 2002; 49: 2167-71.
- ^ Van Audenhaege K, et al. Vyhodnocení úplnosti dat a kvality obrazu v multiplexování Multi-Pinhole SPECT. IEEE Trans Med Imag. 2015; 34: 474-86.
- ^ Vunckx K, et al. Vliv překrývajících se projekcí na kvalitu rekonstrukčního obrazu v Multipinhole SPECT. IEEE Trans Med Imag.2008; 27: 972-83.
- ^ A b Branderhorst W a kol. Cílené víceotvorové dírky SPECT. Eur J Nucl Med Mol Imaging. 2001; 38 (3): 552-61.
- ^ Madsen MT. Nedávné pokroky v zobrazování SPECT. J Nucl Med. 2007; 48 (4): 661-673.
- ^ A b Ivashchenko a kol. Vysoce citlivá myš sub-mm SPECT. J Nucl Med. 2015; 56 (3): 470-5.
- ^ Furenlid LR a kol. FastSPECTII: Dynamická kamera SPECT druhé generace s vysokým rozlišením. IEEE Trans Nucl Sci. 2004; 51 (3): 631-635.
- ^ Van der Have F a kol. U-SPECT-II: Zařízení s ultravysokým rozlišením pro molekulární zobrazování malých zvířat. J Nucl Med. 2009; 50 (4): 599-605.
- ^ Cherry SR. Multimodalita zobrazovacích systémů in vivo: Zdvojnásobte výkon nebo zdvojnásobte potíže. Annu Rev Biomed Eng. 2006; 8: 35-62.
- ^ Qi J a kol. Techniky iterační rekonstrukce v emisní výpočetní tomografii. Phys Med Biol. 2006; 51 (15): R541-78.
- ^ Lange K a kol. Algoritmy EM rekonstrukce pro emisní a přenosovou tomografii. J Comput Assist Tomogr. 1984; 8: 306-316.
- ^ Shepp LA a kol. Rekonstrukce maximální pravděpodobnosti pro emisní tomografii. IEEE Trans Med Imag. 1982; 1 (2): 113-22.
- ^ Hudson HM a kol. Zrychlená rekonstrukce obrazu pomocí objednaných podmnožin dat projekce. IEEE Trans Med Imag. 1994; 13 (4): 601-609.
- ^ Hwang AB, et al. Posouzení zdrojů chyb ovlivňujících kvantitativní přesnost zobrazování SPECT u malých zvířat. Phys Med Biol. 2008. 53: 2233-2252.
- ^ Pokyny pro postup společnosti pro nukleární medicínu pro scintigrafii štítné žlázy. V3.0 Scintigrafie štítné žlázy. 10. září 2006. http://snmmi.files.cms-plus.com/docs/Thyroid_Scintigraphy_V3.pdf
- ^ Goorden MC a kol. VECTor: preklinický zobrazovací systém pro simultánní submilimetr SPECT a PET. J Nucl Med. 2013; 54 (2): 306-12.
- ^ Cunha, Lídia; Horvath, Ildiko; Ferreira, Sara; Lemos, Joana; Costa, Pedro; Vieira, Domingos; Veres, Dániel S .; Szigeti, Krisztián; Summavielle, Teresa; Máthé, Domokos; Metello, Luís F. (22. října 2013). „Preclinical Imaging: an Essential Ally in Modern Biosciences“ (PDF). Molekulární diagnostika a terapie. 18 (2): 153–173. doi:10.1007 / s40291-013-0062-3. PMID 24146172.
- ^ Cal-Gonzalez, Jacobo; Rausch, Ivo; Shiyam Sundar, Lalith K .; Lassen, Martin L .; Muzik, Otto; Moser, Ewald; Papp, Laszlo; Beyer, Thomas (18. května 2018). „Hybrid Imaging: Instrumentation and Data Processing“. Hranice ve fyzice. 6. doi:10.3389 / fphy.2018.00047.
- ^ Hutton, Brian F; Occhipinti, Michele; Kuehne, Andre; Máthé, Domokos; Kovács, Noémi; Waiczies, Helmar; Erlandsson, Kjell; Salvado, Debora; Carminati, Marco; Montagnani, Giovanni L; Krátce, Susan C; Ottobrini, Luisa; van Mullekom, Pieter; Piemonte, Claudio; Bukki, Tamas; Nyitrai, Zoltan; Papp, Zoltan; Nagy, Kalman; Niendorf, Thoralf; de Francesco, Irene; Fiorini, Carlo (leden 2018). "Vývoj klinických simultánních SPECT / MRI". British Journal of Radiology. 91 (1081): 20160690. doi:10.1259 / bjr.20160690. PMC 5966197.
- ^ Schober, Otmar; Kiessling, Fabian; Debus, Jürgen (2020). Molekulární zobrazování v onkologii. Springer Nature. p. 127. ISBN 978-3-030-42618-7.
- ^ Azazrm, AhmadReza; Gharapapagh, Esmail; Islámský, JalilPirayesh; Mahmoudian, Babak (2015). „Pokroky v kolimátorech s dírkami a více dírkami pro zobrazování pomocí výpočetní tomografie s jedinou fotonovou emisí“. World Journal of Nuclear Medicine. 14 (1): 3. doi:10.4103/1450-1147.150505. PMC 4337004.


