Ortosilikát - Orthosilicate
V chemii ortosilikát je anion SiO4−
4, nebo některý z jeho soli a estery. Je to jeden z křemičitan anionty. Někdy se tomu říká oxid křemičitý anion nebo skupina.[1]
Ortosilikátové soli, jako ortosilikát sodný, jsou stabilní a v přírodě se vyskytují široce jako silikátové minerály, který je určujícím prvkem nesosilikáty.[2] Olivín, ortosilikát hořečnatý nebo železitý, je nejhojnějším minerálem v horní plášť.
Ortosilikátový anion je silný základna, konjugovaná báze extrémně slabých kyselina ortosilicová H
4SiO
4 (strK.a2 = 13,2 při 25 ° C). Tuto rovnováhu je obtížné studovat, protože kyselina má tendenci se rozkládat na a hydratovaný oxid křemičitý kondenzát.[3]
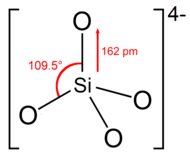
Struktura
Ortosilikátový ion nebo skupina má čtyřboká tvaru, s jedním atomem křemíku obklopeným čtyřmi atomy kyslíku.
V aniontu nese každý kyslík záporný náboj jednotky.[4] Vazba Si – O je 162 pm dlouhá.[5]
V organických sloučeninách jako tetramethyl ortosilikát, každý kyslík je formálně neutrální a je spojen se zbytkem molekuly jediným kovalentní vazba.
Použití
Europium dopovaný barium ortokřemičitan (Ba2SiO4) je běžný fosfor používá se zeleně diody vyzařující světlo (LED). Fosfor pro modré LED lze vyrobit pomocí stroncium dopovaný barium ortokřemičitan.[6] Barium ortokřemičitan je hlavní příčinou otrava katodou v vakuové trubky.[7]
Organická chemie
I když je velmi důležitý v anorganické chemii a geochemii, ortosilikátový iont je zřídka vidět v organické chemii. Dvě silikátové sloučeniny se však používají v organická syntéza: tetraethyl ortosilikát nebo TEOS se používá k propojení polymerů a je zvláště důležitý při výrobě aerogelů. Tetramethylorthosilikát nebo TMOS se používá jako alternativa k TEOS a má také řadu dalších použití jako činidlo. TEOS je upřednostňován před TMOS, protože TMOS se rozkládá za vzniku vysokých koncentrací toxických látek methanolu. Vdechování TMOS může vést k toxickému hromadění oxidu křemičitého v plicích.
Reference
- ^ C. A. Kumins a A. E. Gessler (1953), „Short-Cycle Syntheses of Ultramarine Blue“. Průmyslová a inženýrská chemie, svazek 45, číslo 3, strany 567–572. doi:10.1021 / ie50519a031
- ^ Západní Oregonská univerzita
- ^ Jurkić, Lela Munjas; Cepanec, Ivica; Pavelić, Sandra Kraljević; Pavelić, Krešimir (2013). „Biologické a terapeutické účinky kyseliny ortho-křemičité a některých sloučenin uvolňujících kyselinu orto-křemičitou: Nové perspektivy léčby“. Výživa a metabolismus. 10 (1): 2. doi:10.1186/1743-7075-10-2. ISSN 1743-7075. PMC 3546016.
- ^ Balaram Sahoo; Nayak Nimai Charan; Samantaray Asutosh; Pujapanda Prafulla Kumar. Anorganická chemie. PHI Learning Pvt. Ltd. str. 306. ISBN 978-81-203-4308-5.
- ^ Horacio E. Bergna; William O. Roberts (19. prosince 2005). Koloidní oxid křemičitý: Základy a aplikace. CRC Press. str. 10. ISBN 978-1-4200-2870-6.
- ^ Huayna Cerqueira Streit, Jennifer Kramer, Markus Suta, Claudia Wickleder, „Červená, zelená a modrá fotoluminiscence Ba₂SiO4: M (M = Eu3+, Eu2+, Sr2+) nanofosfory “, Materiály (Basilej), sv. 6, iss. 8, str. 3079–3093, 24. července 2013 doi:10,3390 / ma6083079.
- ^ Jones, Morgan (elektronický inženýr) (2011). Zesilovače ventilů (4. vydání). Oxford: Newnes. str. 301. ISBN 978-0-08-096640-3. OCLC 760157359.
