Nitrilový anion - Nitrile anion
Nitrilové anionty jsou nitrily postrádající proton v poloze α k nitrilové skupině. Podstupují nukleofilní adiční a substituční reakce s různými elektrofily.[1]
Ačkoli nitrilové anionty jsou funkčně podobné enoláty, vícenásobná vazba v nitrilových aniontech jim poskytuje jedinečný keten - jako geometrie. Navíc deprotonován kyanohydriny může působit jako maskované acylové anionty, což dává produktům nemožný přístup pouze s enoláty. Mechanismy adice a substituce nitrilu jsou dobře známy; obvykle se však vyžadují silně zásadité podmínky, které omezují syntetickou užitečnost reakce.
Mechanismus a stereochemie
Tvorba nitrilových aniontů
Nitrilové anionty se nejčastěji vytvářejí působením vhodné báze. Avšak strK.As nitrilů se rozprostírá v širokém rozmezí - nejméně 20 pK.A Jednotky. Správná volba báze tedy obvykle závisí na substrátu. Acetonitrily obsahující extra stabilizující skupinu přitahující elektrony (jako je aromatický kruh) lze obvykle deprotonovat pomocí hydroxidových nebo alkoxidových bází. Nestabilizované nitrily naproti tomu obvykle vyžadují buď báze amidu alkalického kovu (např NaNH2 ) nebo alkyly kovů (např butyllithium ) pro účinnou deprotonaci. V druhém případě dochází ke kompetitivnímu přidání alkylové skupiny k nitrilu.

IR spektroskopie studie prokázaly existenci nejméně dvou tautomerních forem nitrilového aniontu (viz výše).
Polyanionty nitrilů mohou být také generovány vícenásobnými deprotonacemi a tyto druhy produkují polyalkylované produkty v přítomnosti alkyl elektrofilů.[2]
Alternativní způsoby výroby nitrilových aniontů zahrnují přidání konjugátu k α, β-nenasyceným nitrilům,[3] snížení,[4] a transmetalace.[5]
Reakce nitrilových aniontů
Mechanismy reakcí zahrnujících nitrilové anionty závisí především na povaze elektrofil zapojen. Jednoduché alkylace probíhají do SN2 přemístění[6] a podléhají obvyklým stereoelektronickým požadavkům procesu. Katalýza fázovým přenosem se používá při alkylacích arylacetonitrilů.[7][8] Mohou být také zapojeny nitrilové anionty Michaele - přírůstky typu k aktivovaným dvojným vazbám a vinylační reakce s omezeným počtem polarizovaných, nerušených derivátů acetylenu.[9]

Arylace nitrilových aniontů je také možná a může probíhat různými mechanismy v závislosti na substrátech a reakčních podmínkách. Arylhalogenidy postrádající skupiny přitahující elektrony reagují prostřednictvím mechanismu přidání a eliminace benzyně meziprodukty. Arylfosfáty a amonné ionty reagují prostřednictvím SRN1 dráha, která zahrnuje tvorbu arylového radikálového aniontu, fragmentaci a tvorbu vazby s nukleofilem. Přenos elektronů na druhou molekulu arenu nese radikální řetězec.
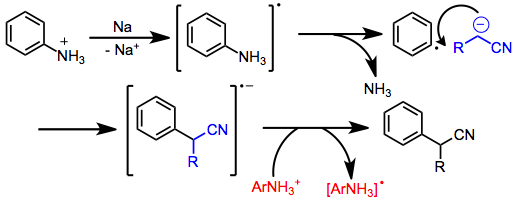
Elektronově chudé aromatické sloučeniny podléhají nukleofilní aromatická substituce v přítomnosti nitrilových aniontů.
Rozsah a omezení
Primární obtížností pro alkylační reakce využívající nitrilové anionty je nadměrná alkylace. Například při alkylaci acetonitrilu jsou výtěžky monoalkylovaného produktu ve většině případů nízké. Dvě výjimky jsou alkylace s epoxidy (blízký záporný náboj otevřeného epoxidu brání další alkylaci) a alkylace s kyanomethyl měďnatými (I) druhy. Vedlejší reakce mohou také představovat problém; koncentrace nitrilového aniontu musí být vysoké, aby se zmírnily procesy zahrnující autokondenzaci, jako je Reakce Thorpe – Ziegler. Další důležité vedlejší reakce zahrnují eliminaci alkylkyanidového produktu nebo alkylhalogenidu jako výchozího materiálu a amidin formace.
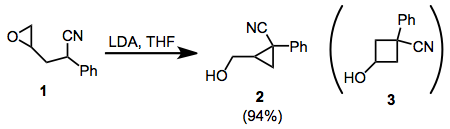
Cyklizace co-epoxy-1-nitrilů poskytuje zajímavý příklad toho, jak mohou stereoelektronické faktory potlačit sterické faktory v intramolekulárních substitučních reakcích. V cyklizaci 1například pouze izomer cyklopropanu 2 je pozorován. To je přičítáno lepšímu orbitálnímu překrytí v S.N2 přechodový stav pro cyklizaci. Této zásady se řídí i 1,1-disubstituované a tetrasubstituované epoxidy.
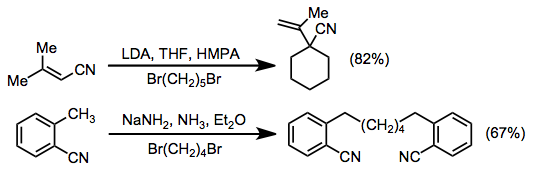
Konjugované nitrily obsahující y vodíky mohou být deprotonovány v poloze y za vzniku aniontů stabilizovaných rezonancí. Tyto meziprodukty téměř vždy reagují s α selektivitou v alkylačních reakcích, výjimkou jsou anionty z pravidla ortho-tolylnitrily.
Tvorba kyanohydrinů z karbonylových sloučenin činí předchozí karbonylovou karbonovou kyselinu. Po ochraně hydroxylové skupiny acylovou nebo silylovou skupinou mohou kyanohydriny fungovat v podstatě jako maskované acylové anionty. Vzhledem k tomu, že chránící skupiny esterů jsou labilní vůči zásadám, musí se s kyanohydriny chráněnými esterem používat mírné báze. V této souvislosti lze také použít α- (dialkylamino) nitrily.[10]
Příklady arylačních a acylačních reakcí jsou uvedeny níže. Ačkoli intermolekulární arylace využívající nitrilové anionty vedou k mírným výtěžkům, intramolekulární postup efektivně poskytuje čtyř-, pět- a šestičlenné benzo-kondenzované kruhy. Acylace může být provedena pomocí široké škály acylových elektrofilů, včetně uhličitanů, chloroformátů, estery, anyhdrides, a chloridy kyselin.[11] V těchto reakcích se používají dva ekvivalenty báze k vedení reakce směrem k acylovanému produktu - acylovaný produkt je kyselější než výchozí materiál.

Syntetické aplikace
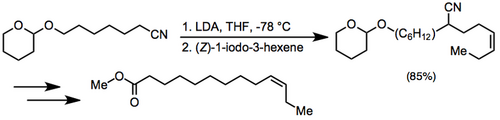
Alkylace nitrilového anionu následovaná redukční dekyanací byla použita při nové syntéze (2) -9-dotlecen-1-ylacetátu, pohlavního feromonu Paralobesia viteana.[12]
Experimentální podmínky a postup
Typické podmínky
Nejběžnějšími bázemi používanými k deprotonaci nitrilů jsou amidy alkalických kovů, substituované amidy a hydridy. Tato činidla vyžadují inertní, bezvodé podmínky a opatrné zacházení. Polyalkylace je významným problémem pro primární nebo sekundární nitrily; existuje však řada řešení tohoto problému. Alkylace kyanoacetátů následovaná dekarboxylací poskytuje jedno řešení.[13] Acylace primárních nebo sekundárních nitrilů poskytuje vhodný vstup do výchozích materiálů pro tuto sekvenci. Destilace a chromatografie jsou praktické pro separaci mono- a di-alkylovaného materiálu, pouze když je rozdíl mezi molekulovou hmotností mezi těmito dvěma velkými.
Acylace je mnohem přímější, protože výsledné a-kyanokarbonylové sloučeniny jsou mnohem kyselější (a méně nukleofilní) než odpovídající výchozí materiály. Monoacylované produkty lze snadno získat.
Příklad postupu[14]
K suspenzi 24,4 g (1,017 mol) hydrid sodný ve 200 ml bezvodého toluen byla přidána směs 122 g (1,043 mol) fenylacetonitrilu a 150 g (1,095 mol) isobutylbromidu. Směs byla zahřívána na 65 ° C, při které byla zahájena reakce. Ohřívací plášť byl odstraněn a baňka byla ochlazena, aby se zabránilo příliš silné reakci během počáteční 0,5hodinové reakční doby. Reakční směs se zahřívá pod zpětným chladičem dalších 5 hodin a nechá se stát přes noc. Ethanol Opatrně bylo po kapkách přidáno (40 ml) a poté po kapkách 200 ml vody. Organická vrstva byla oddělena a vodná vrstva byla extrahována benzen. Spojené organické vrstvy byly postupně promyty zředěnou kyselinou, vodou, uhličitan sodný roztok a vodu. Po filtraci přes vrstvu síran sodný benzen byl odpařen a produkt byl frakčně destilovaný za získání 115 g (66%) 2-fenyl-4-methylvaleronitrilu, bp 130–134 ° C (10 mm) [lit. (540) bp 136–138 ° C (15 mm)].

Reference
- ^ Arseniyadis, S .; Kyler, K. S .; Watt, D. S. (1984). „Adiční a substituční reakce nitrilem stabilizovaných karbanionů“. Org. Reagovat. 31: 1–71. doi:10.1002 / 0471264180.nebo031.01. ISBN 0471264180.
- ^ Marr, G .; Ronayne, J. (1973). "Organokovové deriváty. V. Litiace ferrocenylmethylkyanidu". J. Organomet. Chem. 47: 417. doi:10.1016 / S0022-328X (00) 81753-2.
- ^ Barrett, G. C .; Grattan, T. J. (1979). „Organická elektrosyntéza okolní substituční reaktivita kyano-alkanů: elektrochemicky řízená αC-alkylace brom-alkany“. Tetrahedron Lett. 1979 (43): 4237. doi:10.1016 / S0040-4039 (01) 86554-0.
- ^ Saegusa, T .; Ito, Y .; Kinoshita, H .; Tomita, S. (1970). „Syntetické reakce komplexních katalyzátorů. XVI. Dimerizace akrylonitrilu a akrylátu pomocí komplexu kov-isokyanid“. Býk. Chem. Soc. Jpn. 43 (3): 877. doi:10,1246 / bcsj.43.877.
- ^ Pereyre, M .; Odic, Y. (1969). "Alkylations en α de fonctions organiques par l'intermédiaire de compostés organostanniques". Tetrahedron Lett. 1969 (2): 505. doi:10.1016 / S0022-328X (00) 82070-7.
- ^ Cope, A. C .; Holmes, H.L .; House, H. O. (1957). "Alkylace esterů a nitrilů". Org. Reagovat. 9: 107. doi:10.1002 / 0471264180.nebo009.04. ISBN 0471264180.
- ^ Solaro, R .; D'Antone, S .; Chiellini, E. (1980). "Heterogenní ethylace fenylacetonitrilu". J. Org. Chem. 45 (21): 4179. doi:10.1021 / jo01309a023.
- ^ Makosza, M .; Jonczyk, A. (1976). „Alkylace nitrilů fázovým přenosem: 2-fenylbutyronitril“. Organické syntézy. 55: 91. doi:10.15227 / orgsyn.055.0091.
- ^ Makosza, M. (1966). "Reakce organických aniontů. XII. Vinylace derivátů fenylacetonitrilu". Tetrahedron Lett. 1966 (45): 5489. doi:10.1016 / S0040-4039 (00) 70128-6.
- ^ Stork, G .; Ozorio, A. A .; Leong, A. Y. W. (1978). "N,N-diethylaminoacetonitril: obecně užitečný latentní acylkarbanion ". Tetrahedron Lett. 1978 (52): 5175. doi:10.1016 / S0040-4039 (01) 85842-1.
- ^ Smith, P. A. S .; Breen, G. J. W .; Hájek, M. K .; Awang, D. V. C. (1970). „Izolace primárních produktů rozkladu azidů. II. Azidopyrazoly“. J. Org. Chem. 35 (7): 2215. doi:10.1021 / jo00832a024.
- ^ Savoia, D .; Tagliavini, E .; Trombini, C .; Umani-Ronchi, A. (1980). „Draslík na oxidu hlinitém jako činidlo pro redukční dekyanaci alkylnitrilů“. J. Org. Chem. 45 (16): 3227. doi:10.1021 / jo01304a016.
- ^ Kaiser, E. M .; Hauser, C. R. (1966). „Nepřímé metody přípravy čistých monoalkylfenylacetonitrilů“. J. Org. Chem. 31 (11): 3873. doi:10.1021 / jo01349a525.
- ^ Goerner, G. L .; Muller, H.L .; Corbin, J.L. (1959). "Poznámky. Vybrané fenyl-2-methylhexany". J. Org. Chem. 24 (10): 1561. doi:10.1021 / jo01092a044.
