NGLY1 - NGLY1
PNGase také známý jako N-glykanáza 1 (EC 3.5.1.52) nebo peptid-N (4) - (N-acetyl-beta-glukosaminyl) asparagin amidáza je enzym že u lidí je kódován NGLY1 gen. PNGase je de-N-glykosylační enzym, který odstraňuje N-spojené nebo asparagin - propojené glykany (N-glykany) z glykoproteiny.[5][6][7] Konkrétněji, NGLY1 katalyzuje hydrolýzu amidové vazby mezi nejvnitřnější N-acetylglukosamin (GlcNAc) a zbytek Asn na an N-glykoprotein, generující de-N-glykosylovaný protein, ve kterém N-glykoylovaný zbytek Asn se převede na asp a volný oligosacharid obsahující 1-amino-GlcNAc. Amoniak se poté spontánně uvolní z 1-amino GlcNAc při fyziologickém pH (<8), čímž vznikne volný oligosacharid s N, N’-struktura diacetylchitobiosy na redukčním konci.
Objev
Výskyt cytoplazmatické aktivity PNGázy v savčích buňkách byl poprvé hlášen v kultivovaných buňkách.[8] Tento enzym se liší od ostatních „reagens“ PNGáz z mandlí (glykoamidáza / PNGáza A),[9] nebo bakterie (N-glykanáza / PNGáza F),[10] který se často používá pro strukturální / funkční studie N-glykany, v několika enzymatických vlastnostech, včetně požadavku redukčního činidla pro aktivitu a neutrálního pH pro optimální aktivitu.[8][11][12]
Gen kódující cytoplazmatickou PNGázu byl poprvé identifikován u začínajících kvasinek, Saccharomyces cerevisiae a genové ortology se od té doby nacházejí v široké škále eukaryot, včetně savců.[13] Z hlediska tkáňové distribuce myši Ngly1 gen, enzymové aktivity i transkripty byly detekovány ve všech vyšetřovaných tkáních / orgánech.[12][14]
Struktura
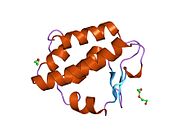
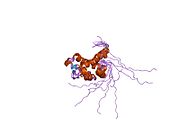
Katalytické zbytky z cytoplazmatický Je známo, že PNGase sídlí v doméně s názvem transglutamináza doména.[15][16] NGLY1 má ve srovnání s ortology kvasinek prodloužené N-terminál a C-terminál sekvence navíc k doméně transglutaminázy. Mezi dalšími doménami nalezenými v NGLY1 byla nejprve identifikována doména PUB (související s PNGase a ubikvitinem) bioinformatickou analýzou.[17][18] I když se původně předpokládalo, že by to mohlo sloužit jako interakční doména protein-protein,[17] experimentální důkazy podporující tuto hypotézu se nyní hromadí.[19][20][21] Na druhé straně je to C-koncová PAW doména (doména přítomná v PNGase a jiných červích proteinech).[18] nyní bylo prokázáno, že se účastní vazby oligosacharidů na PNGázu.[22]
Pokud jde o krystalové struktury myší Ngly1, doména katalytického jádra,[23] C-koncová doména včetně PAW domény[22] a N-terminální doména včetně PUB domény.[24] byly získány.
Funkce
Pokud jde o funkci NGLY1, ukázalo se, že se enzym účastní degradace spojené s ER (ERAD), jednoho ze systémů kontroly kvality / homeostázy ER pro nově syntetizované glykoproteiny.[25][26][27][28] Funkční význam NGLY1 v procesu ERAD však není jasně pochopen. Rovněž bylo navrženo, že NGLY1 je úzce zapojen do prezentace antigenu zprostředkovaného MHC třídou I.[29][30][31] Ngly1-zprostředkovaná (glykosylovaná) Asn-to-Asp deamidace představuje společně s dalšími reakcemi, jako je transpeptidace, nekonvenční posttranslační modifikace pro antigenní peptidy, které jsou prezentovány molekulami MHC třídy I.[32]
Proteiny vázající NGLY1
Prostřednictvím dvouhybridního screeningu kvasinek bylo prokázáno, že proteiny NGLY1 se mohou vázat na několik proteinů, většinou prostřednictvím N-terminální domény včetně PUB domény.[33] In vivo a in vitro byly hlášeny interakce mezi NGLY1 a několika proteiny souvisejícími s ERAD.[20][23][24][33][34][35][36][37][38] I když je třeba vyjasnit význam těchto interakcí protein-protein pro funkce NGLY1, lze předpokládat, že takové interakce mohou být výhodné pro efektivní proces ERAD.[39]
Klinický význam
V roce 2012, Nedostatek NGLY1 zahrnující mutace v NGLY1 genový lokus byl poprvé identifikován analýzou exome.[40] Od této chvíle byly hlášeny klinické příznaky u 11 pacientů.[41][42][43] Jeden pacient s mozkovým postižením (CVI) měl také mutaci NGLY1 gen.[44] Klinické účinky zahrnují neuromotorické poškození, mentální postižení a neuropatii. Bylo také spojováno s amyotrofickou laterální sklerózou a Parkinsonovou chorobou.
Podrobnosti o mechanismu odpovědném za patogenezi NGLY1nedostatek zůstává neznámý, zatímco intracelulární akumulace N-Proteiny GlcNAc v důsledku nadměrného působení cytosolické endo-b-N-acetylglukosaminidázy[45] špatně poskládané glykoproteiny, v Ngly1-deficitní buňky byly předpokládány jako potenciální příčina.[28]
NGLY1 nedostatek přitáhl pozornost veřejnosti.[46][47][48][49]
Byly provedeny studie s cílem objevit malé molekuly, které se mohou vázat na transglutaminázovou doménu proteinu a stabilizovat jej jako potenciální terapeutické aplikace při léčbě poruchy způsobené mutanty NGLY1.[50]
Poznámky
Verze tohoto článku z roku 2015 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Tadashi Suzuki; Chengcheng Huang; Haruhiko Fujihira (20. listopadu 2015), „Cytoplazmatický peptid: N-glykanáza (NGLY1) - struktura, exprese a buněčné funkce“, Gen, 577 (1): 1–7, doi:10.1016 / J.GENE.2015.11.021, ISSN 0378-1119, PMC 4691572, PMID 26611529, Wikidata Q30274598 |
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000151092 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000021785 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Hirayama H, Hosomi A, Suzuki T (květen 2015). "Fyziologické a molekulární funkce cytosolického peptidu: N-glykanáza". Semináře z buněčné a vývojové biologie. 41: 110–20. doi:10.1016 / j.semcdb.2014.11.009. PMID 25475175.
- ^ Suzuki T (leden 2015). „Cytoplazmatický peptid: N-glykanáza (Ngly1) - základní věda naráží na genetickou poruchu člověka“. Journal of Biochemistry. 157 (1): 23–34. doi:10.1093 / jb / mvu068. PMID 25398991.
- ^ Suzuki T, Huang C, Fujihira H (leden 2016). „Cytoplazmatický peptid: N-glykanáza (NGLY1) - struktura, exprese a buněčné funkce“. Gen. 577 (1): 1–7. doi:10.1016 / j.gene.2015.11.021. PMC 4691572. PMID 26611529.
- ^ A b Suzuki T, Seko A, Kitajima K, Inoue Y, Inoue S (srpen 1993). "Identifikace peptidu: aktivita N-glykanázy v kultivovaných buňkách ze savců". Komunikace pro biochemický a biofyzikální výzkum. 194 (3): 1124–30. doi:10.1006 / bbrc.1993.1938. PMID 8352768.
- ^ Takahashi N (červen 1977). "Demonstrace nové amidázy působící na glykopeptidy". Komunikace pro biochemický a biofyzikální výzkum. 76 (4): 1194–201. doi:10.1016 / 0006-291x (77) 90982-2. PMID 901470.
- ^ Plummer TH, Elder JH, Alexander S, Phelan AW, Tarentino AL (září 1984). „Demonstrace peptidu: aktivita N-glykosidázy F v přípravcích endo-beta-N-acetylglukosaminidázy F“. The Journal of Biological Chemistry. 259 (17): 10700–4. PMID 6206060.
- ^ Suzuki T, Seko A, Kitajima K, Inoue Y, Inoue S (červenec 1994). "Čištění a enzymatické vlastnosti peptidu: N-glykanáza z C3H myší odvozených fibroblastových buněk L-929. Možný rozšířený výskyt posttranslační remodifikace proteinů N-deglykosylací". The Journal of Biological Chemistry. 269 (26): 17611–8. PMID 8021270.
- ^ A b Kitajima K, Suzuki T, Kouchi Z, Inoue S, Inoue Y (červen 1995). "Identifikace a distribuce peptidu: N-glykanáza (PNGáza) v myších orgánech". Archivy biochemie a biofyziky. 319 (2): 393–401. doi:10.1006 / abbi.1995.1309. PMID 7786020.
- ^ Suzuki T, Park H, Hollingsworth NM, Sternglanz R, Lennarz WJ (květen 2000). „PNG1, kvasinkový gen kódující vysoce konzervovaný peptid: N-glykanáza“. The Journal of Cell Biology. 149 (5): 1039–52. doi:10.1083 / jcb.149.5.1039. PMC 2174826. PMID 10831608.
- ^ Suzuki T, Kwofie MA, Lennarz WJ (květen 2003). "Ngly1, myší gen kódující deglykosylační enzym podílející se na proteazomální degradaci: exprese, genomová organizace a chromozomální mapování". Komunikace pro biochemický a biofyzikální výzkum. 304 (2): 326–32. doi:10.1016 / s0006-291x (03) 00600-4. PMID 12711318.
- ^ Makarova KS, Aravind L, Koonin EV (srpen 1999). „Nadčeleď archaálních, bakteriálních a eukaryotických proteinů homologních se zvířecími transglutaminázami“. Věda o bílkovinách. 8 (8): 1714–9. doi:10.1110 / ps.8.8.1714. PMC 2144420. PMID 10452618.
- ^ Katiyar S, Suzuki T, Balgobin BJ, Lennarz WJ (duben 2002). "Studie místně zaměřené mutageneze kvasinkového peptidu: N-glykanáza. Pohled na mechanismus reakce deglykosylace". The Journal of Biological Chemistry. 277 (15): 12953–9. doi:10,1074 / jbc.M111383200. PMID 11812789.
- ^ A b Suzuki T, Park H, Do EA, Lennarz WJ (říjen 2001). "PUB doména: domnělá interakční doména protein-protein zapojená do dráhy ubikvitin-proteazom". Komunikace pro biochemický a biofyzikální výzkum. 287 (5): 1083–7. doi:10.1006 / bbrc.2001.5688. PMID 11587532.
- ^ A b Doerks T, Copley RR, Schultz J, Ponting CP, Bork P (leden 2002). „Systematická identifikace nových rodin proteinových domén spojených s jadernými funkcemi“. Výzkum genomu. 12 (1): 47–56. doi:10,1101 / gr.203201. PMC 155265. PMID 11779830.
- ^ Allen MD, Buchberger A, Bycroft M (září 2006). „PUB doména funguje jako vazebný modul p97 v lidské peptidové N-glykanáze“. The Journal of Biological Chemistry. 281 (35): 25502–8. doi:10,1074 / jbc.M601173200. PMID 16807242.
- ^ A b Kamiya Y, Uekusa Y, Sumiyoshi A, Sasakawa H, Hirao T, Suzuki T, Kato K (duben 2012). „NMR charakterizace interakce mezi PUB doménou peptidu: N-glykanáza a ubikvitinovou doménou HR23“. FEBS Dopisy. 586 (8): 1141–6. doi:10.1016 / j.febslet.2012.03.027. PMID 22575648. S2CID 23573555.
- ^ Schaeffer V, Akutsu M, Olma MH, Gomes LC, Kawasaki M, Dikic I (květen 2014). „Vazba OTULINU na PUB doménu HOIP řídí signalizaci NF-κB“. Molekulární buňka. 54 (3): 349–61. doi:10.1016 / j.molcel.2014.03.016. PMID 24726327.
- ^ A b Zhou X, Zhao G, Truglio JJ, Wang L, Li G, Lennarz WJ, Schindelin H (listopad 2006). „Strukturální a biochemické studie C-terminální domény myší peptid-N-glykanázy ji identifikují jako modul vázající manózu“. Sborník Národní akademie věd Spojených států amerických. 103 (46): 17214–9. doi:10.1073 / pnas.0602954103. PMC 1859912. PMID 17088551.
- ^ A b Zhao G, Zhou X, Wang L, Li G, Kisker C, Lennarz WJ, Schindelin H (květen 2006). „Struktura komplexu myší peptid N-glykanáza-HR23 naznačuje společný vývoj degradace asociované s endoplazmatickým retikulem a opravných drah DNA.“. The Journal of Biological Chemistry. 281 (19): 13751–61. doi:10,1074 / jbc.M600137200. PMID 16500903.
- ^ A b Zhao G, Zhou X, Wang L, Li G, Schindelin H, Lennarz WJ (květen 2007). „Studie na interakcích peptid: N-glykanáza-p97 naznačují, že fosforylace p97 moduluje degradaci spojenou s endoplazmatickým retikulem“. Sborník Národní akademie věd Spojených států amerických. 104 (21): 8785–90. doi:10.1073 / pnas.0702966104. PMC 1885580. PMID 17496150.
- ^ Wiertz EJ, Jones TR, Sun L, Bogyo M, Geuze HJ, Ploegh HL (březen 1996). „Produkt lidského genu pro lidský cytomegalovirus US11 dislokuje těžké řetězce MHC třídy I z endoplazmatického retikula do cytosolu.“ Buňka. 84 (5): 769–79. doi:10.1016 / s0092-8674 (00) 81054-5. PMID 8625414. S2CID 5122267.
- ^ Hirsch C, Blom D, Ploegh HL (březen 2003). „Role N-glykanázy v cytosolickém obratu glykoproteinů“. Časopis EMBO. 22 (5): 1036–46. doi:10.1093 / emboj / cdg107. PMC 150340. PMID 12606569.
- ^ Grotzke JE, Lu Q, Cresswell P (únor 2013). „Fluorescenční proteiny závislé na deglykosylaci poskytují jedinečné nástroje pro studium degradace spojené s ER“. Sborník Národní akademie věd Spojených států amerických. 110 (9): 3393–8. doi:10.1073 / pnas.1300328110. PMC 3587246. PMID 23401531.
- ^ A b Huang C, Harada Y, Hosomi A, Masahara-Negishi Y, Seino J, Fujihira H, Funakoshi Y, Suzuki T, Dohmae N, Suzuki T (únor 2015). „Endo-β-N-acetylglukosaminidáza tvoří agregáty proteinů N-GlcNAc během degradace související s ER v buňkách s defektem Ngly1“. Sborník Národní akademie věd Spojených států amerických. 112 (5): 1398–403. doi:10.1073 / pnas.1414593112. PMC 4321286. PMID 25605922.
- ^ Skipper JC, Hendrickson RC, Gulden PH, Brichard V, Van Pel A, Chen Y, Shabanowitz J, Wolfel T, Slingluff CL, Boon T, Hunt DF, Engelhard VH (únor 1996). „Antigen tyrosinázy omezený na HLA-A2 na melanomových buňkách je výsledkem posttranslační modifikace a navrhuje novou cestu pro zpracování membránových proteinů.“. The Journal of Experimental Medicine. 183 (2): 527–34. doi:10.1084 / jem.183.2.527. PMC 2192446. PMID 8627164.
- ^ Altrich-VanLith ML, Ostankovitch M, Polefrone JM, Mosse CA, Shabanowitz J, Hunt DF, Engelhard VH (říjen 2006). „Zpracování epitopu omezeného na třídu I z tyrosinázy vyžaduje peptid N-glykanázu a kooperativní působení endoplazmatického retikula aminopeptidázy 1 a cytosolických proteáz“. Journal of Immunology. 177 (8): 5440–50. doi:10,4049 / jimmunol.177.8.5440. PMID 17015730.
- ^ Kario E, Tirosh B, Ploegh HL, Navon A (leden 2008). „N-vázaná glykosylace nezhoršuje proteasomální degradaci, ale ovlivňuje prezentaci hlavního histokompatibilního komplexu I. třídy“. The Journal of Biological Chemistry. 283 (1): 244–54. doi:10,1074 / jbc.M706237200. PMID 17951257.
- ^ Dalet A, Robbins PF, Stroobant V, Vigneron N, Li YF, El-Gamil M, Hanada K, Yang JC, Rosenberg SA, Van den Eynde BJ (červenec 2011). „Antigenový peptid produkovaný reverzním sestřihem a dvojitou asparaginovou deamidací“. Sborník Národní akademie věd Spojených států amerických. 108 (29): E323–31. doi:10.1073 / pnas.1101892108. PMC 3142003. PMID 21670269.
- ^ A b Park H, Suzuki T, Lennarz WJ (září 2001). „Identifikace proteinů, které interagují se savčím peptidem: N-glykanázou a implikují tuto hydrolázu v proteazomově závislé cestě degradace proteinů“. Sborník Národní akademie věd Spojených států amerických. 98 (20): 11163–8. doi:10.1073 / pnas.201393498. PMC 58701. PMID 11562482.
- ^ McNeill H, Knebel A, Arthur JS, Cuenda A, Cohen P (prosinec 2004). „Nový protein domény UBA a UBX, který váže polyubiquitin a VCP a je substrátem pro SAPK“. The Biochemical Journal. 384 (Pt 2): 391–400. doi:10.1042 / BJ20041498. PMC 1134123. PMID 15362974.
- ^ Katiyar S, Li G, Lennarz WJ (září 2004). „Komplex mezi peptidem: N-glykanázou a dvěma proteiny spojenými s proteazomy naznačuje mechanismus degradace nesprávně složených glykoproteinů“. Sborník Národní akademie věd Spojených států amerických. 101 (38): 13774–9. doi:10.1073 / pnas.0405663101. PMC 518832. PMID 15358861.
- ^ Katiyar S, Joshi S, Lennarz WJ (říjen 2005). „Retrotranslokační protein Derlin-1 váže peptid: N-glykanázu na endoplazmatické retikulum“. Molekulární biologie buňky. 16 (10): 4584–94. doi:10,1091 / mbc.E05-04-0345. PMC 1237066. PMID 16055502.
- ^ Li G, Zhou X, Zhao G, Schindelin H, Lennarz WJ (listopad 2005). „Několik způsobů interakce deglykosylačního enzymu, myšího peptidu N-glykanázy, s proteazomem“. Sborník Národní akademie věd Spojených států amerických. 102 (44): 15809–14. doi:10.1073 / pnas.0507155102. PMC 1276080. PMID 16249333.
- ^ Li G, Zhao G, Zhou X, Schindelin H, Lennarz WJ (květen 2006). „AAA ATPáza p97 spojuje peptid N-glykanázu s receptorem autokrinního faktoru motility spojeným s endoplazmatickým retikulem E3 ligázou“. Sborník Národní akademie věd Spojených států amerických. 103 (22): 8348–53. doi:10.1073 / pnas.0602747103. PMC 1482497. PMID 16709668.
- ^ Suzuki T, Lennarz WJ (únor 2003). „Hypotéza: komplex degradace glykoproteinů vytvořený interakcí protein-protein zahrnuje cytoplazmatický peptid: N-glykanáza“. Komunikace pro biochemický a biofyzikální výzkum. 302 (1): 1–5. doi:10.1016 / s0006-291x (03) 00052-4. PMID 12593838.
- ^ Potřebujete AC, Shashi V, Hitomi Y, Schoch K, Shianna KV, McDonald MT, Meisler MH, Goldstein DB (červen 2012). "Klinická aplikace sekvenování exomu za nediagnostikovaných genetických podmínek". Journal of Medical Genetics. 49 (6): 353–61. doi:10.1136 / jmedgenet-2012-100819. PMC 3375064. PMID 22581936.
- ^ Enns GM, Shashi V, Bainbridge M, Gambello MJ, Zahir FR, Bast T, Crimian R, Schoch K, Platt J, Cox R, Bernstein JA, Scavina M, Walter RS, Bibb A, Jones M, Hegde M, Graham BH , Need AC, Oviedo A, Schaaf CP, Boyle S, Butte AJ, Chen R, Clark MJ, Haraksingh R, Cowan TM, He P, Langlois S, Zoghbi HY, Snyder M, Gibbs RA, Freeze HH, Goldstein DB (Oct 2014). „Mutace v NGLY1 způsobují dědičnou poruchu cesty degradace spojené s endoplazmatickým retikulem“. Genetika v medicíně. 16 (10): 751–8. doi:10.1038 / gim.2014.22. PMC 4243708. PMID 24651605.
- ^ Caglayan AO, Comu S, Baranoski JF, Parman Y, Kaymakçalan H, Akgumus GT, Caglar C, Dolen D, Erson-Omay EZ, Harmanci AS, Mishra-Gorur K, Freeze HH, Yasuno K, Bilguvar K, Gunel M (Jan 2015). „Mutace NGLY1 způsobuje neuromotorické poškození, mentální postižení a neuropatii“. European Journal of Medical Genetics. 58 (1): 39–43. doi:10.1016 / j.ejmg.2014.08.008. PMC 4804755. PMID 25220016.
- ^ Heeley J, Shinawi M (duben 2015). „Multisystémové zapojení do poruchy související s NGLY1 způsobené dvěma novými mutacemi“. American Journal of Medical Genetics Part A. 167A (4): 816–20. doi:10,1002 / ajmg.a.36889. PMID 25707956. S2CID 7959186.
- ^ Bosch DG, Boonstra FN, de Leeuw N, Pfundt R, Nillesen WM, de Ligt J, Gilissen C, Jhangiani S, Lupski JR, Cremers FP, de Vries BB (září 2015). „Nové genetické příčiny poškození zraku mozku“. European Journal of Human Genetics. 24 (5): 660–5. doi:10.1038 / ejhg.2015.186. PMC 4930090. PMID 26350515.
- ^ Suzuki T, Yano K, Sugimoto S, Kitajima K, Lennarz WJ, Inoue S, Inoue Y, Emori Y (červenec 2002). „Endo-beta-N-acetylglukosaminidáza, enzym podílející se na zpracování volných oligosacharidů v cytosolu“. Sborník Národní akademie věd Spojených států amerických. 99 (15): 9691–6. doi:10.1073 / pnas.152333599. PMC 124980. PMID 12114544.
- ^ „Děti, které neplačou: objevena nová genetická porucha“.
- ^ "Jediný svého druhu".
- ^ „Pronásledování vraha mého syna“.
- ^ Might M, Wilsey M (říjen 2014). „Model posunu v klinické diagnostice: jak sekvenování a rodiny nové generace mění způsob objevování, studia a léčby vzácných onemocnění“. Genetika v medicíně. 16 (10): 736–7. doi:10.1038 / gim.2014.23. PMID 24651604. S2CID 27270375.
- ^ Srinivasan B, Zhou H, Mitra S, Skolnick J (říjen 2016). „Nová malá molekula vázající lidskou N-glykanázu 1, klíčový hráč v cestě degradace spojené s endoplazmatickým retikulem“. Bioorganická a léčivá chemie. 24 (19): 4750–4758. doi:10.1016 / j.bmc.2016.08.019. PMC 5015769. PMID 27567076.
Tento článek včlení text z United States National Library of Medicine, který je v veřejná doména.