Ketoacyl syntáza - Ketoacyl synthase
Ketoacyl syntázy (KS) katalyzují kondenzační reakce acyl-CoA nebo acyl-acyl ACP s malonyl-CoA za vzniku 3-ketoacyl-CoA nebo s malonyl-ACP za vzniku 3-ketoacyl-ACP. Tato reakce je klíčovým krokem v cyklu syntézy mastných kyselin, protože výsledný acylový řetězec je o dva atomy uhlíku delší než dříve. KS existují jako jednotlivé enzymy, stejně jako při syntéze mastných kyselin typu II a syntéze polyketidů typu II, nebo jako domény ve velkých vícedoménových enzymech, jako jsou syntázy mastných kyselin typu I (FAS) a polyketidové syntázy (PKS). KS jsou rozděleny do pěti rodin: KS1, KS2, KS3, KS4 a KS5.[1]
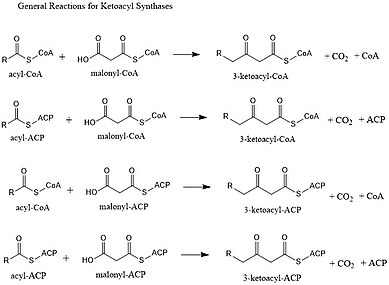
Vícedoménové enzymové systémy
Syntáza mastných kyselin
Syntáza mastných kyselin (FAS) je enzymový systém zapojený do syntézy mastných kyselin de novo. FAS je iterativní multienzym skládající se z několika složkových enzymů, z nichž jeden je ketoacyl syntáza. Existují dva typy FAS: typ I a typ II. FAS typu I jsou vysoce integrované vícedoménové enzymy. Obsahují diskrétní funkční domény odpovědné za specifické katalytické aktivity reakční sekvence, a to buď na jednom polypeptidovém řetězci, nebo na dvou různých multifunkčních proteinech. FAS typu II jsou disociované systémy, což znamená, že složkové enzymy jsou nezávislé proteiny kódované řadou samostatných genů.[2]
Polyketid syntáza
Polyketidové syntázy (PKS) strukturálně a funkčně souvisí s FAS, což jsou enzymy, které katalyzují kondenzaci aktivovaných primárních metabolitů, jako je acetyl-CoA a malonyl-CoA.
Hlavní reakce, kterou katalyzují, je:[3]
- CO2-CH2-CO-S-CoA + CH3-CO-S-PKS → CH3-CO-CH2-CO-S-PKS + CoA-H + CO2
Stejně jako FAS budou PKS používat β-ketoacylsyntházu (KS), volitelnou (malonyl) acyltransferázu (MAT / AT) a fosfopantethienylovaný acylový nosný protein (ACP) nebo koenzymA (CoA). Oba také použili ketoreduktázu, dehydratázu a enoylreduktázu k vytvoření plně nasycené acylové kostry. Na rozdíl od FAS však PKS obvykle používají větší počet biosyntetických stavebních bloků a tvoří rozmanitější počet délek ocasu. Redukční kroky, které FAS používají, jsou pro PKS také volitelné. Tím, že je potenciálně vynecháte, existuje potenciál pro složitější model funkcionalizace.[4]
Existují tři hlavní typy polyketidů: typ I, typ II a typ III. Typ I je velmi podobný FAS typu I, protože obsahuje lineárně uspořádané a kovalentně kondenzované katalytické domény ve velkých multifunkčních enzymech. Typ II má tendenci být více disociovatelným komplexem s monofunkčními doménami enzymů. Dalším způsobem, jak se PKS liší, je to, že mají jeden další typ, typ III. PKS typu III jsou multifunkční při výběru spouštěcí jednotky, sestavení řetězu a podpoře skládání.[4]
Rodina ketoacylsyntázy 1
Téměř všichni členové KS1 jsou produkováni bakteriemi, několik tvoří eukaryota a pouze jeden archeon. Existuje 12 podskupin. Dominantním enzymem v rodině KS1 je 3-ketoacyl-ACP syntáza III (KAS III), známá také jako 3-oxoacyl-ACP syntáza III a β-ketoacyl-ACP syntáza III, a je definována jako EC 2.3.1.180.[5][1]
p-Ketoacyl-ACP syntáza III
Charakteristická reakce β-ketoacyl-ACP syntáza III je malonyl-ACP + acetyl-CoA => acetoacyl-ACP + CO2 + CoA. Cystein, histidin a asparagin tvoří katalytickou triádu v KAS III, která využívá kinetický mechanismus ping-pong.[1]
v Escherichia coli, jeden organismus KAS III se obvykle nachází v, KASIII je slabě inhibován thiolaktomycinem.[6] Ve stejném organismu bude mít KAS III optimální pH 7 a optimální teplotu 30-37 ° C.[7] Inhibitory každého organismu, optimální pH a optimální teploty se budou mírně lišit. Tato čísla však obecně svědčí o ideálním prostředí enzymu.
Rodina ketoacylsyntázy 2
Všechny enzymy KS2 produkuje eukaryota, téměř všechny z rostlin. Nejběžnějšími enzymy v této rodině jsou 3-ketoacyl-CoA syntázy, elongázy mastných kyselin a enzymy kondenzující mastné kyseliny s velmi dlouhým řetězcem. Nejběžnější obecnou charakteristikou pro tyto enzymy je E.C. 2.3.1.-; některé jsou však definovány jako 2.3.1.119. Většina enzymů z rodiny KS2 katalyzuje reakce za vzniku mastných kyselin s velmi dlouhým řetězcem. KS2 lze rozdělit do 10 podskupin.[1]
3-Ketoacyl-CoA syntáza I
3-Ketoacyl-CoA syntáza I in Arabidopsis thaliana se podílí na syntéze mastných kyselin s velmi dlouhým řetězcem, která hraje roli v biosyntéze vosku.[8] Enzym katalyzuje následující reakci:
acyl-CoA s velmi dlouhým řetězcem + malonyl-CoA ⇒ 3-oxoacyl-CoA s velmi dlouhým řetězcem + CoA + CO2[9]
Jedná se o elongázu, která se podílí na produkci mastných kyselin s velmi dlouhým řetězcem, které mají 26 uhlíků a déle.[10] Mefluidid a perfluidon jsou selektivní inhibitory tohoto enzymu.[11]
Rodina ketoacylsyntázy 3
Rodina KS3 je největší rodinou v systému KS se 14 podskupinami. Enzymy KS3 se primárně produkují v bakteriích s malým počtem eukaryot a archea. KS v této rodině obsahují KS domény přítomné jak v FAS typu I, tak v modulárním typu I PKS. I když v této rodině existuje mnoho mírně odlišných enzymů, dvě nejběžnější 3-ketoacyl-ACP syntáza I a syntáza II.[1]
3-Ketoacyl-ACP syntáza I
3-Ketoacyl-ACP syntáza I (ES 2.3.1.41 ) se podílí na procesu prodloužení řetězce u FAS typu II. Důsledkem nedostatku tohoto enzymu bude nedostatek nenasycených mastných kyselin. Jako substráty používá mastné acylthioestery ACP a CoA a má specificitu blízkou specifičnosti beta-ketoacyl-ACP syntázy II.[12]
Typicky se tento enzym používá při kondenzačních reakcích i při dekarboxylaci a přenosu acylových skupin.
Reakce probíhá jako taková:
- acyl- [protein acylového nosiče] + malonyl- [protein acylového nosiče] → 3-oxoacyl- [protein acylového nosiče] + CO2 + [protein acylového nosiče]
v Escherichia colinapříklad se tento enzym používá ke konstrukci mastných acylových řetězců třístupňovou Claisenovou kondenzační reakcí. Reakce bude zahájena trans thioesterfikací substrátu acylového primeru. Donorový substrát je poté dekarboxylován za vzniku meziproduktu karbaniontu, který napadne C1 substrátu primeru a vytvoří podlouhlý acylový řetězec.[13]
Existuje celá řada molekul, o nichž je známo, že jsou inhibitory syntázy I. Například v některých případech samotný acyl-CoA inhibuje enzym ve vysokých koncentracích Escherichia coli. Je známo, že cerulenin inhibuje syntázu I v Carthamus tinctorius, Spinacia oleracea, Brassica napus, Allium ampeloprasu, Streptococcus pneumoniae, Escherichia coli, Mycobacterium tuberculosis, a mnoho dalších. v Mycobacterium tuberculosis, palmitoyl-CoA je inhibitor a thiolaktomycin je také v řadě organismů.[12]
Optimální rozmezí pH se velmi liší od organismu k organismu, ale celkově se pohybuje mezi 5,5-8,5. Optimální teplota je stejná, s 20 ° C na jednom konci spektra, ale 37 ° C na druhém konci.
3-Ketoacyl-ACP syntáza II
3-Ketoacyl-ACP syntáza II[14] podílí se na FAS typu II, který se vyskytuje v rostlinách a bakteriích. I když je velmi podobný beta-ketoacyl-ACP syntáze I, je mezi nimi malý rozdíl. Jedním z hlavních rozdílů je, že syntáza II je schopna snadno použít palmitoleoyl-ACP jako substrát, zatímco syntáza I nemůže. To umožňuje řízení teplotně závislé regulace složení mastných kyselin.[15]

Reakce probíhá jako taková:
- (Z) -hexadec-11-enoyl- [acylový nosný protein] + malonyl- [acylový nosný protein] → (Z) -3-oxooktadec-13-enoyl- [acylový nosičový protein] + CO2 + [protein nosiče acylu
v Streptococcus pneumoniae například se jako prodloužení kondenzující enzym používá syntáza II. Obsahuje katalytickou triádu Cys134, His337 a His303, stejně jako Phe396 a molekulu vody navázanou na aktivní místo. Nukleofilní cystein je nutný pro tvorbu acyl-enzymu a používá se při celkové kondenzační aktivitě. Jeho 337 se také používá pro kondenzační aktivitu, konkrétně pro stabilizaci záporného náboje na malonyl thioester karbonylu v přechodném stavu. His303 se používá k urychlení katalýzy deprotonací molekuly vody, aby se umožnil nukleofilní útok na malonát, čímž se uvolní hydrogenuhličitan. Phe396 funguje jako vrátný, který řídí pořadí přidávání substrátu.[16]
Existuje celá řada molekul, o nichž je známo, že tento enzym inhibují. Například cerulenin inhibuje syntázu II v Spinacia oleracea, Allium ampelprasum, Escherichia coli, a Streptoccoccus pneumonia. v Escherichia coli, platensimycin, thiolaktomycin a jodacetamid jsou také známé inhibitory.[15]
Optimální rozmezí pH se bude lišit v závislosti na organismu. v Escherichia coli, rozsah je 5,5–6,1. v Streptoccoccus pneumonia, 6,8–7, v Plasmodium falciparum 7.5 a dovnitř Spinacia oleracea, 8,1–8,5. Optimální teplota se bude lišit, ale z větší části zůstane v rozmezí 30–37 ° C.[15]
Rodina ketoacylsyntázy 4
Většina enzymů KS4 existuje v eukaryotických organismech, zatímco zbytek pochází z bakterií. Tyto enzymy jsou obvykle klasifikovány jako chalkonsyntázy, stilben-syntetázy nebo PKS typu III. Celkově v KS4 existuje 10 různých podskupin. Členové KS4 budou mít typicky katalytickou triádu Cys-His-Asn. Jak chalkonové syntázy, tak stilben-syntetázy budou katalyzovat stejný acylový přenos, dekarboxylaci a kondenzační kroky jako v KS1. Budou však také dále cyklizovat a aromatizovat reakce před vytvořením konečného chalkonového produktu.[1]
Chalkonsyntáza
Chalkonsyntáza (ES 2.3.1.74 ), známý také jako naringenin-chalkon syntáza, je zodpovědný za reakci:
- 3 malonyl-CoA + 4-kumaroyl-CoA → 4 CoA + naringenin chalkon + 3 CO2
v Medicago saticva, například k reakci dochází v průběhu kroku plnění, kroku dekarboxylace a nakonec kroku prodloužení.[17]
Mezi známé inhibitory patří cerulenin Sinapis alba, Daucus carota, a Phaseolus vulgaris, apigenin v Secale cereálie a Avena sativa, a eriodictyol v Decale cereálie, Daucus carota,a Xanthisma gracile.[17]
Optimální pH, při kterém může tento enzym fungovat, se mezi jednotlivými organismy liší, ale obvykle se pohybuje někde mezi 6 a 8. Totéž platí pro optimální teplotu při 30-45 ° C.[17]
Rodina ketoacylsyntázy 5
Členové rodiny KS5 jsou přítomni v eukaryotických buňkách, většinou u zvířat. Většina z těchto enzymů může být klasifikována jako elongázy mastných kyselin. Je známo, že tyto enzymy se používají při prodloužení mastných kyselin s velmi dlouhým řetězcem. KS5 má 11 podskupin. O rodině KS5 je zatím známo jen málo. V současné době žádný ze specifických enzymů nemá čísla E.C. Nebyly potvrzeny žádné zbytky katalytické triády. Byly nalezeny konzervované zbytky histidinu a asparaginu s histidinem v oblasti překlenující membránu. Zatím však nejsou známy konzervované cysteinové zbytky.[1]
Reference
- ^ A b C d E F G Chen, Yingfei; Kelly, Erin E .; Masluk, Ryan P .; Nelson, Charles L .; Cantu, David C .; Reilly, Peter J. (01.10.2011). "Strukturální klasifikace a vlastnosti ketoacyl syntázy". Věda o bílkovinách. 20 (10): 1659–1667. doi:10,1002 / pro.712. ISSN 1469-896X. PMC 3218358. PMID 21830247.
- ^ Schweizer, Eckhart; Hofmann, Jörg (01.09.2004). „Mikrobiální syntázy mastných kyselin typu I (FAS): hlavní hráči v síti buněčných systémů FAS“. Recenze mikrobiologie a molekulární biologie. 68 (3): 501–517. doi:10.1128 / MMBR.68.3.501-517.2004. ISSN 1092-2172. PMC 515254. PMID 15353567.
- ^ „Polyketidové syntázy“. www.rasmusfrandsen.dk. Citováno 2016-05-04.
- ^ A b Hertweck, Christian (2009-06-15). „Biosyntetická logika polyketidové rozmanitosti“. Angewandte Chemie International Edition. 48 (26): 4688–4716. doi:10.1002 / anie.200806121. ISSN 1521-3773. PMID 19514004.
- ^ „ENZYME entry 2.3.1.180“. expasy.org. Citováno 25. února 2017.
- ^ Khandekar, SS; Gentry, DR; Van Aller, GS; Warren, P; Xiang, H; Silverman, C; Doyle, ML; Chambers, PA; Konstantinidis, AK; Brandt, M; Daines, RA; Lonsdale, JT (10. srpna 2001). „Identifikace, substrátová specificita a inhibice Streptococcus pneumoniae beta-ketoacyl-acylový nosičový protein syntáza III (FabH)“. The Journal of Biological Chemistry. 276 (32): 30024–30. doi:10,1074 / jbc.M101769200. PMID 11375394.
- ^ „BRENDA - Informace o EC 2.3.1.180 - beta-ketoacyl- [acyl-nosič-protein] syntáza III“. www.brenda-enzymes.org. Citováno 2016-05-04.
- ^ Todd, J .; Post-Beittenmiller, D .; Jaworski, J. G. (01.01.1999). „KCS1 kóduje 3-ketoacyl-CoA syntázu elongázy mastných kyselin ovlivňující biosyntézu vosku v Arabidopsis thaliana“. The Plant Journal. 17 (2): 119–130. doi:10.1046 / j.1365-313x.1999.00352.x. ISSN 0960-7412. PMID 10074711.
- ^ „KCS1 - 3-ketoacyl-CoA syntáza 1 - Arabidopsis thaliana (řeřicha ušní) - gen a protein KCS1“. www.uniprot.org. Citováno 2016-05-04.
- ^ Blacklock, Brenda J .; Jaworski, Jan G. (2006-07-28). "Substrátová specificita Arabidopsis 3-ketoacyl-CoA syntázy". Sdělení o biochemickém a biofyzikálním výzkumu. 346 (2): 583–590. doi:10.1016 / j.bbrc.2006.05.162. PMID 16765910.
- ^ Tresch, Stefan; Heilmann, Monika; Christiansen, Nicole; Volnější, Ralf; Grossmann, Klaus (01.04.2012). „Inhibice nasycené biosyntézy mastných kyselin s velmi dlouhým řetězcem mefluididem a perfluidonem, selektivní inhibitory 3-ketoacyl-CoA syntázy“. Fytochemie. 76: 162–171. doi:10.1016 / j.phytochem.2011.12.023. ISSN 1873-3700. PMID 22284369.
- ^ A b „BRENDA - Informace o EC 2.3.1.41 - beta-ketoacyl- [acyl-nosič-protein] syntáza I“. www.brenda-enzymes.org. Citováno 2016-05-04.
- ^ von Wettstein-Knowles, Penny; Olsen, Johan G .; McGuire, Kirsten A .; Henriksen, Anette (01.02.2006). "Syntéza mastných kyselin". FEBS Journal. 273 (4): 695–710. doi:10.1111 / j.1742-4658.2005.05101.x. ISSN 1742-4658. PMID 16441657.
- ^ „ENZYME entry 2.3.1.179“. expasy.org. Citováno 25. února 2017.
- ^ A b C „BRENDA - Informace o EC 2.3.1.179 - beta-ketoacyl- [acyl-nosič-protein] syntáza II“. www.brenda-enzymes.org. Citováno 2016-05-04.
- ^ Zhang, Yong-Mei; Hurlbert, Jason; White, Stephen W .; Rock, Charles O. (2006-06-23). „Role vody aktivního místa, histidinu 303 a fenylalaninu 396 v katalytickém mechanismu kondenzačního enzymu prodloužení Streptococcus pneumoniae“. Journal of Biological Chemistry. 281 (25): 17390–17399. doi:10,1074 / jbc.M513199200. ISSN 0021-9258. PMID 16618705.
- ^ A b C "BRENDA - Informace o EC 2.3.1.74 - naringenin-chalkonsyntáza". www.brenda-enzymes.org. Citováno 2016-05-04.
