Gyrifikace - Gyrification

Gyrifikace je proces formování charakteristických záhybů mozková kůra.[1] Vrchol takového záhybu se nazývá a gyrus (množné číslo: gyri) a jeho žlab se nazývá a sulcus (množné číslo: sulci). Neurony mozkové kůry spočívají v tenké vrstvě šedá hmota, jen 2–4 mm silné, na povrchu mozku.[2] Velká část vnitřního prostoru je obsazena bílá hmota, který se skládá z dlouhých axonálních projekcí do a z kortikálních neuronů pobývajících poblíž povrchu. Gyrifikace umožňuje větší kortikální povrchovou plochu a tím i větší kognitivní funkčnost, aby se vešly dovnitř menší lebka. U většiny savců začíná gyrifikace během vývoj plodu. Primáti, kytovci, a kopytníci mají rozsáhlé kortikální gyri, až na několik druhů výjimek hlodavci obecně nemají. Gyrifikace u některých zvířat, například u fretky, pokračuje až do postnatálního života.[3]
Gyrifikace během vývoje lidského mozku
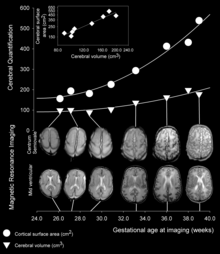
Jak vývoj plodu pokračuje, gyri a sulci se začínají formovat se vznikem prohlubujících se zářezů na povrchu kůry. Ne všechny gyri se začínají vyvíjet současně. Místo toho se nejprve vytvoří primární kortikální gyri (u lidí začíná již v gestačním týdnu 10), poté později ve vývoji sekundární a terciární gyri.[4] Jedním z prvních a nejvýznamnějších sulků je laterální sulcus (také známý jako boční trhlina nebo Sylvianova trhlina), následovaný dalšími, jako je centrální sulcus, který odděluje motorickou kůru (precentrální gyrus ) ze somatosenzorické kůry (postcentrální gyrus ).[5] Většina kortikálních gyri a sulků se začíná formovat mezi 24. a 38. týdnem těhotenství, a po narození se nadále zvětšovat a dospívat.
Evoluční výhody
Jednou z výhod gyrifikace je myšlenka být zvýšená rychlost komunikace mozkových buněk, protože kortikální záhyby umožňují, aby buňky byly blíže k sobě navzájem, což vyžaduje méně času a energie pro přenos neuronových elektrických impulsů, nazývaných akční potenciály.[6] Existují důkazy, které naznačují pozitivní vztah mezi gyrifikací a rychlostí zpracování kognitivních informací a také lepší verbální pracovní paměť.[7] Navíc proto, že velká lebka vyžaduje během porod, se implicitními obtížemi v bipedalismus, menší lebka se snáze dodává.[8][9]
Teorie kauzality v gyrifikaci
Mechanická vzpěr
Mechanismy kortikální gyrifikace nejsou dobře známy a ve vědecké literatuře se diskutuje o několika hypotézách. Populární hypotéza sahající až do doby Retzius na konci 19. století tvrdí, že mechanické vzpěrné síly způsobené rozšiřující se mozkovou tkání způsobují, že se kortikální povrch ohne.[10] Mnoho teorií od té doby bylo volně spojeno s touto hypotézou.
Vnější omezení růstu lebka se nepovažuje za způsobující gyrifikaci. Je to hlavně proto, že primordium lebky v období vývoje mozku plodu ještě není zkostnatělý (vytvrzený na kost kalcifikace ). Tkáň pokrývající embryonální mozková kůra je několik tenkých vrstev ektoderm (budoucí kůže) a mezenchymu (budoucnost sval a pojivová tkáň, včetně budoucí lebky). Tyto tenké vrstvy snadno rostou spolu s kortikální expanzí, ale nakonec se lebeční mezenchym diferencuje chrupavka; osifikace lebečních desek nastává až později ve vývoji. Lidská lebka po narození pokračuje v podstatném růstu spolu s mozkem, dokud se lebeční dlahy po několika letech konečně neroztaví. Experimentální studie na zvířatech dále ukázaly, že kortikální skládání může nastat bez vnějších omezení.[11] Kraniální růst je tedy považován za růst mozku; mechanické a genetické faktory vlastní mozku jsou nyní považovány za primární hnací síly gyrifikace.[6] Jedinou pozorovanou rolí, kterou může lebka hrát při gyrifikaci, je zploštění gyri, jak mozek dospívá po pojistce lebečních desek.[11]
Axonální napětí
Alternativní teorie naznačuje, že axonální napínací síly mezi vysoce propojenými kortikálními oblastmi přitahují místní kortikální oblasti k sobě a vyvolávají záhyby.[12] Tento model byl kritizován: Numerická počítačová simulace nemohla vytvořit biologicky realistický vzor skládání.[13] Jedna studie ukázala, že gyrifikace může být experimentálně indukována u embryonální myši, ale v raných fázích při absenci axonálních spojení.[14]
Diferenciální tangenciální expanze
V poslední době byla navržena teorie diferenciální tangenciální expanze s tím, že skládací vzorce mozku jsou výsledkem různých rychlostí tangenciální expanze mezi různými kortikálními oblastmi.[15] Navrhuje se, že to je způsobeno plošnými rozdíly v počátečních rychlostech dělení předků.
Mechanické faktory
Kortikální tloušťka
Rané podmínky mozku mají silný vliv na jeho konečnou úroveň gyrifikace. Zejména existuje inverzní vztah mezi kortikální tloušťkou a gyrifikací. Bylo zjištěno, že oblasti mozku s nízkými hodnotami tloušťky mají vyšší úroveň gyrifikace. Opak je také pravdou, že oblasti mozku s vysokými hodnotami tloušťky mají nižší úroveň gyrifikace.[6]
Rychlost růstu
Existují určité spory o rychlosti růstu, kterými se vyvíjejí kortikální a subkortikální vrstvy mozku. Čistě izotropní růst naznačuje, že každá vrstva šedé (vnější skořápky) a bílé hmoty (vnitřní jádro) rostou odděleně, a to rovnoměrně ve všech dimenzích. Tangenciální růst naznačuje, že šedá hmota roste rychleji než vnitřní bílá hmota a že rychlost růstu šedé hmoty určuje rychlost růstu bílé hmoty. Ačkoli jsou obě metody rozdílné, přičemž kůra roste rychleji než subkortex, byl jako pravděpodobnější model navržen tangenciální růst.[6]
Záhyby na povrchu mozku se tvoří v důsledku nestability a modely tangenciálního růstu dosahují úrovní nestability, které způsobují záhyby častěji než izotropní modely. Tato úroveň se nazývá kritický bod, ve kterém modely dávají přednost vydání potenciální energie destabilizací a formováním záhybů, aby se staly stabilnějšími.[6]
Genetické faktory
Vzor kortikálních gyri a sulků není náhodný; většina hlavních závinů je mezi jednotlivci zachována a vyskytuje se také u různých druhů. Tato reprodukovatelnost může naznačovat, že genetické mechanismy mohou určit umístění hlavních gyri. Studie z monozygotní a dizygotický dvojčata z konce 90. let tuto myšlenku podporují,[16] zejména pokud jde o primární gyri a sulci, zatímco existuje větší variabilita mezi sekundárními a terciárními gyri.[17] Lze proto předpokládat, že sekundární a terciární záhyby mohou být citlivější na genetické a environmentální faktory.[18] První gen údajně ovlivňující gyrifikaci byl Trnp1.[19] Místní úrovně exprese Trnp1 mohou určovat budoucí pozici vývoje záhybů / gyri v lidských mozcích.[19][20][21] Geny, které ovlivňují kortikální progenitorovou dynamiku, neurogenezi a migraci neuronů, stejně jako geny, které ovlivňují vývoj kortikálních obvodů a axonální projekce, mohou přispívat ke gyrifikaci. Trnp1 je faktor vázající DNA, u kterého bylo prokázáno, že reguluje jiné geny, které regulují proliferaci kortikálních progenitorových buněk - a tím slouží jako hlavní regulátor genů.[6][19] Kromě toho fibroblastový růstový faktor (FGF) - a zvukový ježek Nedávno byly popsány signální dráhy (SHH), které jsou schopné vyvolat kortikální záhyby u myší, které se dožijí dospělosti, s úplným doplňkem kortikálních vrstev.[14][22] Tyto FGF a Shh faktory regulují proliferaci kortikálních kmenových buněk a dynamiku neurogeneze. Role pro beta-katenin (část Wnt cesta ) a byly také nalezeny vhodné úrovně buněčné smrti kortikálních předků.[23][24]
Buněčné biologické determinanty
Kortikální kmenové buňky, známé jako radiální gliové buňky (RGC) s, bydlí v komorová zóna a generovat excitační glutamatergické neurony mozkové kůry.[25][26] Tyto buňky rychle proliferují prostřednictvím samoobnovy v raných vývojových stádiích, rozšiřují zásoby předků a zvětšují kortikální povrchovou plochu. V této fázi je vzor kortikálních oblastí geneticky naprogramován systémem signalizačních center procesem kortikální vzorování a prvotní mapa kortikálních funkčních oblastí se v této fázi nazýváprotomapa '.[27] Kortikální neurogeneze začíná vyčerpávat zásobu progenitorových buněk, pod vlivem mnoha genetických podnětů, jako je růstové faktory fibroblastů (FGF) sa Zářez.[28] RGC generují přechodné neuronové prekurzory, které se dále dělí na subventrikulární zóna (SVZ), zesilující počet produkovaných kortikálních neuronů.[29] Dlouhá vlákna RGC promítají celou cestu skrz vyvíjející se kůru až na povrch mozku v mozku a tato vlákna slouží jako fyzický vodítka pro migraci neuronů.[30] Druhá třída RGC, nazývaná bazální RGC (bRGC), tvoří třetí skupinu předků ve vnější SVZ.[31] Bazální RGC jsou obecně mnohem hojnější u vyšších savců. Klasické RGC i nedávno popsané bRGC představují vodítka, která vedou novorozené neurony k cíli v kůře. Zvýšený počet bRGC zvyšuje hustotu vodících vláken v jinak rozvětveném poli, které by ztratilo hustotu vláken.[32] Vědecká literatura poukazuje na rozdíly v dynamice proliferace a neuronální diferenciace v každé z těchto progenitorových zón napříč druhy savců, a tyto rozdíly mohou vysvětlovat velké rozdíly v kortikální velikosti a gyrifikaci mezi savci. Jedna hypotéza naznačuje, že určité progenitorové buňky generují hojné neurony určené pro vnější kortikální vrstvy, což způsobuje větší zvětšení povrchu vnějších vrstev ve srovnání s vnitřními kortikálními vrstvami.[32] Zůstává nejasné, jak to může fungovat bez dalších mechanistických prvků.[33][34]
Variace mezi druhy
Jako měřítko velikosti kortikálních konvolucí na povrchu mozku savců byl použit „gyrifikační index“ (GI).[6][35] Plaz a pták mozek nevykazuje gyrifikaci. Savci s vysokým GI jsou obecně větší než savci s nízkým GI; například pilotní velryba a delfín skákavý vykazují nejvyšší hodnoty GI. Lidský mozek, i když je větší než mozek koně, vykazuje podobný GI. Hlodavci obecně vykazují nejnižší GI. Někteří hlodavci však vykazují gyrencefalii a několik druhů primátů je docela lissencefalických.[36]
Lineární vztah mezi savci vyjádřený v gyrifikačních termínech našel Mota & Herculano-Houzel, 2015.[37] Navrhují model, který kombinuje morfometrická měření (kortikální tloušťka, exponovaná oblast a celková plocha), což by mohl být způsob, jak popsat gyrifikaci.
Neurologické poruchy gyrifikace
Lissencephaly
Mozková kůra postrádající povrchové spletitosti je považována za lissencefalickou, což znamená „hladký mozek“.[38] Během embryonálního vývoje začínají všechny mozky savců jako lissencefalické struktury odvozené z neurální trubice. Některé, jako mozek myši, zůstávají po celou dospělost lissencefalické. Ukázalo se, že lissencefalické druhy mají mnoho molekulárních podnětů potřebných k dosažení gyrencefalie, ale na regulaci proliferace nervových progenitorů a neurogenních procesů, které jsou základem gyrifikace, je zapojena celá řada genů. Předpokládá se, že časoprostorové rozdíly v těchto molekulárních drahách, včetně FGF, Shh a Trnp1 a pravděpodobně mnoho dalších, určují načasování a rozsah gyrifikace u různých druhů.[19][22]
Lissencephaly je chorobný stav člověka. Pro lidi s lissencephaly velká část neuronů nedosáhne během migrace neuronů do vnější kůry a zůstane pod kortikální deskou.[39] Toto přemístění vede nejen k defektům v kortikálních spojeních, ale také k zesílení mozkové kůry, což odpovídá myšlence, že mozek se silnější kůrou bude mít nižší stupeň gyrifikace.[40]
Polymicrogyria
Polymicrogyria je stav, při kterém má mozek příliš spletitou kůru. Ačkoli na povrchu vypadá mozek hladce s několika sulci, pohled na vnitřek mozku odhaluje spletitou strukturu s velkým počtem sekundárních a terciárních záhybů.[40] Zobrazování mozku pomocí MRI odhaluje mozek s polymikrogýrií, který má tenkou kůru, což odpovídá myšlence, že mozek s tenkou kůrou bude mít vysokou úroveň gyrifikace.[39][40] Ukázalo se, že široká škála genů způsobuje mutaci Polymicrogyria u lidí, od mTORopathies (např. AKT3) po channelopathies (sodíkové kanály, "SCN3A ").[41]
Autismus
Pacienti s autismus mít celkově vyšší úroveň kortikální gyrifikace,[42] ale pouze v temporálním, parietálním a okcipitálním laloku, stejně jako v části cingulární kůry.[43] Zjistilo se, že vyšší úrovně gyrifikace souvisí s větší místní konektivitou v autistických mozcích, což naznačuje hyperkonektivitu.
Trnp1, který byl schopen vyvolat gyrifikaci na zvířecích modelech, byla vyslovena hypotéza, že je spojena s poruchami gyrifikace v některých případech autismu, ale recenze v roce 2012 zjistila pouze jeden hlášený případ mutace u pacienta s Rettovým syndromem (ne ASD ).[44]
Zjistilo se, že záhyby autistických lidských mozků pociťují mírné posuny v místě, na počátku vývoje mozku. Konkrétně se různé vzory objevují v horním čelním sulku, Sylvianově puklině, horním čelním gyru, horním temporálním gyru a čichových sulcích.[45] Tyto oblasti se týkají pracovní paměti, emočního zpracování, jazyka a očního pohledu,[46] a jejich rozdíl v umístění a úrovni gyrifikace ve srovnání s neurotypickým lidským mozkem by mohl vysvětlit některá změněná chování u autistických pacientů.
Schizofrenie
Častější stav, schizofrenie, byl také spojován se strukturálními abnormalitami v mozku. Stejně jako autistické mozky, schizofrenní mozky vykazují sníženou kortikální tloušťku a zvýšenou gyrifikaci ve srovnání se zdravými mozky.[39][47]
Malformace viru Zika
Kortikální malformace vyvolané Virus Zika jsou způsobeny infekcí během těhotenství a jsou obecně klasifikovány jako mikrocefalie nebo „malý mozek“. Vzhledem k velkému zmenšení objemu mozkové kůry v mikrocefalii nejsou změny v gyrifikaci neočekávané. Nedávné studie mechanismu malformací Zika však naznačují, že hlavní defekt je způsoben infekcí RGC a následnou smrtí buněk.[48][49] Smrt kortikálních kmenových buněk způsobuje ztrátu všech očekávaných dceřiných buněk a rozsah malformace tedy závisí na načasování infekce a také na její závažnosti během plánu proliferace nervových kmenových buněk a neurogeneze. Očekávalo by se, že dřívější infekce způsobí závažnější malformaci.[50][51] Mikrocefalie a malformace gyrifikace jsou trvalé a nejsou známy žádné léčby.
Měření gyrifikace
Kortikální gyrifikaci lze měřit pomocí indexu gyrifikace (GI),[52] Fraktální rozměrnost[53] a kombinace morfometrických výrazů (plocha, tloušťka, objem).[37]GI je definován jako poměr mezi celkovou oblastí a exponovanou oblastí („obvod mozku vymezený na dvourozměrných koronálních úsecích“)[54]). FreeSurfer, Software pro rekonstrukci povrchu je jedním z nástrojů dostupných pro měření GI.[55]
Další obrázky

Různé mozky. Ve směru hodinových ručiček zleva nahoře: Dospělý rhesus; Dospělá myš; Midgestation člověk; Novorozený člověk; Dospělý člověk.

Normální lidský dospělý mozek (vlevo), polymicrogyria (uprostřed) a lissencephaly (že jo).
Viz také
Reference
- ^ Rakic, P (říjen 2009). „Evoluce neokortexu: perspektiva z vývojové biologie“. Recenze přírody Neurovědy. 10 (10): 724–35. doi:10.1038 / nrn2719. PMC 2913577. PMID 19763105.
- ^ Kandel, Eric R .; Schwartz, James H .; Jessell, Thomas M .; Siegelbaum, Steven A .; Hudspeth, A.J., eds. (2012) [1981]. Principy neurální vědy (5. vydání). New York: McGraw Hill. ISBN 978-0-07-139011-8.
- ^ Smart, IH; McSherry, GM (červen 1986). „Tvorba gyru v mozkové kůře u fretky. I. Popis vnějších změn“. Anatomy Journal. 146: 141–52. PMC 1166530. PMID 3693054.
- ^ Rajagopalan, V; Scott, J; Habas, PA; Kim, K; Corbett-Detig, J; Rousseau, F; Barkovich, AJ; Glenn, OA; Studholme, C (23. února 2011). „Lokální vzorce růstu tkání, které jsou základem normální gyrifikace lidského mozku plodu, kvantifikovány in utero. The Journal of Neuroscience. 31 (8): 2878–87. doi:10.1523 / jneurosci.5458-10.2011. PMC 3093305. PMID 21414909.
- ^ Bayer, Shirley A; Altman, Joseph (2005). Lidský mozek během druhého trimestru. Boca Raton, FL USA: CRC Press. ISBN 978-0-8493-1422-3.
- ^ A b C d E F G Striedter, Georg F .; Srinivasan, Shyam; Monuki, Edwin S. (01.01.2015). „Kortikální skládání: kdy, kde, jak a proč?“. Roční přehled neurovědy. 38 (1): 291–307. doi:10.1146 / annurev-neuro-071714-034128. PMID 25897870.
- ^ Gautam, Prapti; Anstey, Kaarin J .; Wen, Wei; Sachdev, Perminder S .; Cherbuin, Nicolas (01.07.2015). "Kortikální gyrifikace a její vztahy s kortikálním objemem, kortikální tloušťkou a kognitivním výkonem u zdravých dospělých v polovině života". Behaviorální výzkum mozku. 287: 331–339. doi:10.1016 / j.bbr.2015.03.018. PMID 25804360.
- ^ Jordaan, HV (březen 1976). "Poměry mozku novorozence: dospělého v evoluci hominidů". American Journal of Physical Anthropology. 44 (2): 271–8. doi:10.1002 / ajpa.1330440209. PMID 816206.
- ^ Weiner, S; Monge, J; Mann, A (září 2008). „Bipedalismus a porod: evoluční imperativ pro porod císařským řezem?“. Kliniky v perinatologii. 35 (3): 469–78, ix. doi:10.1016 / j.clp.2008.06.003. PMID 18952015.
- ^ Ronan, L; Voets, N; Rua, C; Alexander-Bloch, A; Hough, M; Mackay, C; Crow, TJ; James, A; Giedd, JN; Fletcher, PC (srpen 2014). „Diferenciální tangenciální expanze jako mechanismus kortikální gyrifikace“. Mozková kůra. 24 (8): 2219–28. doi:10.1093 / cercor / bht082. PMC 4089386. PMID 23542881.
- ^ A b Tallinen, Tuomas; Chung, Jun Young; Biggins, John S .; Mahadevan, L. (02.09.2014). „Gyrifikace z omezené kortikální expanze“. Sborník Národní akademie věd. 111 (35): 12667–12672. arXiv:1503.03853. Bibcode:2014PNAS..11112667T. doi:10.1073 / pnas.1406015111. ISSN 0027-8424. PMC 4156754. PMID 25136099.
- ^ Van Essen, DC (23. ledna 1997). „Teorie morfogeneze založená na napětí a kompaktní zapojení v centrální nervové soustavě“. Příroda. 385 (6614): 313–8. Bibcode:1997 Natur.385..313E. doi:10.1038 / 385313a0. PMID 9002514.
- ^ Xu, G; Knutsen, AK; Dikranian, K; Kroenke, Cd; Bayly, P V; Taber, L A (2010). „Axony přitahují mozek, ale napětí nezpůsobuje kortikální skládání“. J. Biomech. Eng. 132 (7): 071013. doi:10.1115/1.4001683. PMC 3170872.
- ^ A b Vyrážka, BG; Tomasi, S; Lim, HD; Suh, CY; Vaccarino, FM (26. června 2013). "Kortikální gyrifikace vyvolaná fibroblastovým růstovým faktorem 2 v myším mozku". The Journal of Neuroscience. 33 (26): 10802–14. doi:10.1523 / jneurosci.3621-12.2013. PMC 3693057. PMID 23804101.
- ^ Ronan, L; Voets, N; Rua, C; Alexander-Bloch, A; Hough, M; Mackay, C; Crow, TJ; James, A; Giedd, JN; Fletcher, PC (srpen 2014). „Diferenciální tangenciální expanze jako mechanismus kortikální gyrifikace“. Mozková kůra. 24 (8): 2219–28. doi:10.1093 / cercor / bht082. PMC 4089386. PMID 23542881.
- ^ Bartley, AJ; Jones, DW; Weinberger, DR (únor 1997). "Genetická variabilita velikosti lidského mozku a kortikální gyrální vzorce". Mozek. 120 (2): 257–69. doi:10.1093 / mozek / 120.2.257. PMID 9117373.
- ^ White, Tonya; Su, Shu; Schmidt, Marcus; Kao, Chiu-Yen; Sapiro, Guillermo (01.02.2010). „Vývoj gyrifikace v dětství a dospívání“. Mozek a poznání. Vývoj mozku adolescentů: aktuální témata a budoucí směry. 72 (1): 36–45. doi:10.1016 / j.bandc.2009.10.009. PMC 2815169. PMID 19942335.
- ^ Gómez-Robles, Aida; Hopkins, William D .; Sherwood, Chet C. (2013-06-22). „Zvýšená morfologická asymetrie, evolučnost a plasticita v evoluci lidského mozku“. Proc. R. Soc. B. 280 (1761): 20130575. doi:10.1098 / rspb.2013.0575. ISSN 0962-8452. PMC 3652445. PMID 23615289.
- ^ A b C d Stahl, Ronny; Walcher, Tessa; De Juan Romero, Camino; Pilz, Gregor Alexander; Cappello, Silvia; Irmler, Martin; Sanz-Aquela, José Miguel; Beckers, Johannes; Blum, Robert (25.04.2013). „Trnp1 reguluje expanzi a skládání mozkové kůry savců řízením radiálního gliového osudu“. Buňka. 153 (3): 535–549. doi:10.1016 / j.cell.2013.03.027. ISSN 1097-4172. PMID 23622239.
- ^ de Juan Romero, Camino; Bruder, Carl; Tomasello, Ugo; Sanz-Anquela, José Miguel; Borrell, Víctor (2015-07-14). „Diskrétní domény genové exprese v zárodečných vrstvách odlišují vývoj gyrencefalie“. Časopis EMBO. 34 (14): 1859–1874. doi:10.15252 / embj.201591176. ISSN 1460-2075. PMC 4547892. PMID 25916825.
- ^ Fernández, Virginie; Llinares-Benadero, Cristina; Borrell, Víctor (2016-05-17). „Expanze a skládání mozkové kůry: co jsme se naučili?“. Časopis EMBO. 35 (10): 1021–1044. doi:10.15252 / embj.201593701. ISSN 1460-2075. PMC 4868950. PMID 27056680.
- ^ A b Wang, L; Hou, S; Han, YG (23. května 2016). „Ježková signalizace podporuje expanzi bazálního progenitoru a růst a skládání neokortexu“. Přírodní neurovědy. 19 (7): 888–96. doi:10.1038 / č. 4307. PMC 4925239. PMID 27214567.
- ^ Chenn, A; Walsh, CA (19. července 2002). "Regulace velikosti mozkové kůry kontrolou výstupu buněčného cyklu v nervových prekurzorech". Věda. 297 (5580): 365–9. Bibcode:2002Sci ... 297..365C. doi:10.1126 / science.1074192. PMID 12130776.
- ^ Kuida, K; Haydar, TF; Kuan, CY; Gu, Y; Taya, C; Karasuyama, H; Su, MS; Rakic, P; Flavell, RA (7. srpna 1998). „Snížená aktivace kaspázy zprostředkovaná apoptózou a cytochromem c u myší bez kaspázy 9“. Buňka. 94 (3): 325–37. doi:10.1016 / s0092-8674 (00) 81476-2. PMID 9708735.
- ^ Noctor, SC; Flint, AC; Weissman, TA; Dammerman, RS; Kriegstein, AR (8. února 2001). "Neurony odvozené od radiálních gliových buněk vytvářejí radiální jednotky v neokortexu". Příroda. 409 (6821): 714–20. Bibcode:2001Natur.409..714N. doi:10.1038/35055553. PMID 11217860.
- ^ Malatesta, P; Hartfuss, E; Götz, M (prosinec 2000). "Izolace radiálních gliových buněk pomocí fluorescenčně aktivovaného třídění buněk odhaluje neuronovou linii". Rozvoj. 127 (24): 5253–63. PMID 11076748.
- ^ Rakic, P (8. července 1988). "Specifikace mozkových kortikálních oblastí". Věda. 241 (4862): 170–6. Bibcode:1988Sci ... 241..170R. doi:10.1126 / science.3291116. PMID 3291116.
- ^ Vyrážka, BG; Lim, HD; Breunig, JJ; Vaccarino, FM (26. října 2011). „Signalizace FGF rozšiřuje embryonální kortikální povrchovou regulací neurogeneze závislé na zářezu“. The Journal of Neuroscience. 31 (43): 15604–17. doi:10.1523 / jneurosci.4439-11.2011. PMC 3235689. PMID 22031906.
- ^ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (únor 2004). „Kortikální neurony vznikají v zónách symetrického a asymetrického dělení a migrují specifickými fázemi“. Přírodní neurovědy. 7 (2): 136–44. doi:10.1038 / nn1172. PMID 14703572.
- ^ Rakic, P (květen 1972). "Režim buněčné migrace do povrchových vrstev neokortexu plodu opice". The Journal of Comparative Neurology. 145 (1): 61–83. doi:10,1002 / k.901450105. PMID 4624784.
- ^ LaMonica, BE; Lui, JH; Wang, X; Kriegstein, AR (říjen 2012). „Progenitory OSVZ v lidské kůře: aktualizovaný pohled na neurodevelopmentální onemocnění“. Aktuální názor v neurobiologii. 22 (5): 747–53. doi:10.1016 / j.conb.2012.03.006. PMC 3402619. PMID 22487088.
- ^ A b Hansen, DV; Lui, JH; Parker, PR; Kriegstein, AR (25. března 2010). "Neurogenní radiální glia ve vnější subventrikulární zóně lidského neokortexu". Příroda. 464 (7288): 554–561. Bibcode:2010Natur.464..554H. doi:10.1038 / nature08845. PMID 20154730.
- ^ Hevner, RF; Haydar, TF (únor 2012). „(Ne nutně) spletitá role bazálních radiálních glií v kortikální neurogenezi“. Mozková kůra. 22 (2): 465–8. doi:10.1093 / cercor / bhr336. PMC 3256413. PMID 22116731.
- ^ García-Moreno, F; Vasistha, NA; Trevia, N; Bourne, JA; Molnár, Z (únor 2012). "Rozdělení mozkových kortikálních zárodečných zón u lissencefalického primáta a gyrencefalického hlodavce". Mozková kůra. 22 (2): 482–92. doi:10.1093 / cercor / bhr312. PMID 22114081.
- ^ Zilles, K; Armstrong, E; Moser, KH; Schleicher, A; Stephan, H (1989). "Gyrifikace v mozkové kůře primátů". Mozek, chování a evoluce. 34 (3): 143–50. doi:10.1159/000116500. PMID 2512000.
- ^ Hevner, RF; Haydar, TF (únor 2012). „(Ne nutně) spletitá role bazálních radiálních glií v kortikální neurogenezi“. Mozková kůra. 22 (2): 465–8. doi:10.1093 / cercor / bhr336. PMC 3256413. PMID 22116731.
- ^ A b Mota, Bruno; Herculano-Houzel, Suzana (03.07.2015). "Kortikální skládací váhy univerzálně s povrchovou plochou a tloušťkou, ne počtem neuronů". Věda. 349 (6243): 74–77. Bibcode:2015Sci ... 349 ... 74M. doi:10.1126 / science.aaa9101. ISSN 0036-8075. PMID 26138976.
- ^ Armstrong, E; Schleicher, A; Omran, H; Curtis, M; Zilles, K (1991). „Ontogenie lidské gyrifikace“. Mozková kůra. 5 (1): 56–63. doi:10.1093 / cercor / 5.1.56. PMID 7719130.
- ^ A b C Budday, Silvia; Raybaud, Charles; Kuhl, Ellen (10.7.2014). „Mechanický model předpovídá morfologické abnormality ve vyvíjejícím se lidském mozku“. Vědecké zprávy. 4: 5644. Bibcode:2014NatSR ... 4E5644B. doi:10.1038 / srep05644. PMC 4090617. PMID 25008163.
- ^ A b C Ross, M. Elizabeth; Walsh, Christopher A. (01.01.2001). „Malformace lidského mozku a jejich lekce pro migraci neuronů“. Roční přehled neurovědy. 24 (1): 1041–1070. doi:10.1146 / annurev.neuro.24.1.1041. PMID 11520927.
- ^ Smith RS, Kenny CJ, Ganesh V, Jang A, Borges-Monroy R, Partlow JN a kol. (Září 2018). „Sodný kanál SCN3A (NaPROTI1.3) Regulace lidského mozkového kortikálního skládání a vývoj orálního motoru ". Neuron. 99 (5): 905–913.e7. doi:10.1016 / j.neuron.2018.07.052. PMC 6226006. PMID 30146301.
- ^ Wallace, Gregory L .; Robustelli, Briana; Dankner, Nathan; Kenworthy, Lauren; Giedd, Jay N .; Martin, Alex (01.06.2013). „Zvýšená gyrifikace, ale srovnatelný povrch u dospívajících s poruchami autistického spektra“. Mozek. 136 (6): 1956–1967. doi:10.1093 / mozek / awt106. ISSN 0006-8950. PMC 3673467. PMID 23715094.
- ^ Yang, Daniel Y.-J .; Beam, Danielle; Pelphrey, Kevin A .; Abdullahi, Sebiha; Jou, Roger J. (2016-01-25). „Kortikální morfologické markery u dětí s autismem: studie strukturní magnetické rezonance o tloušťce, ploše, objemu a gyrifikaci“. Molekulární autismus. 7 (1): 11. doi:10.1186 / s13229-016-0076-x. PMC 4727390. PMID 26816612.
- ^ Stahl, Ronny (2012). Identifikace a funkční analýza Trnp1: nový protein asociovaný s DNA s klíčovou rolí v neurogenezi. https://edoc.ub.uni-muenchen.de/15432/. str. 86–88.CS1 maint: umístění (odkaz)
- ^ Chen, Jason A .; Peñagarikano, Olga; Belgard, T. Grant; Swarup, Vivek; Geschwind, Daniel H. (01.01.2015). „Vznikající obraz poruchy autistického spektra: genetika a patologie“. Roční přehled patologie: mechanismy nemocí. 10 (1): 111–144. doi:10.1146 / annurev-pathol-012414-040405. PMID 25621659.
- ^ Levitt, Jennifer G .; Blanton, Rebecca E .; Smalley, Susan; Thompson, P. M .; Guthrie, Donald; McCracken, James T .; Sadoun, Tania; Heinichen, Laura; Toga, Arthur W. (07.07.2003). „Kortikální Sulcal mapy v autismu“. Mozková kůra. 13 (7): 728–735. doi:10.1093 / cercor / 13.7.728. ISSN 1047-3211. PMID 12816888.
- ^ Palaniyappan, Lena; Mallikarjun, Pavan; Joseph, Verghese; White, Thomas P .; Liddle, Peter F. (2011). „Složení prefrontální kůry u schizofrenie: regionální rozdíly v gyrifikaci“. Biologická psychiatrie. 69 (10): 974–979. doi:10.1016 / j.biopsych.2010.12.012. PMID 21257157.
- ^ Nowakowski, TJ; Pyl, AA; Di Lullo, E; Sandoval-Espinosa, C; Bershteyn, M; Kriegstein, AR (5. května 2016). „Expresní analýza zdůrazňuje, že AXL je kandidátním receptorem pro vstup virů Zika do nervových kmenových buněk“. Buňková kmenová buňka. 18 (5): 591–6. doi:10.1016 / j.stem.2016.03.012. PMC 4860115. PMID 27038591.
- ^ Li, C; Xu, D; Ye, Q; Hong, S; Jiang, Y; Liu, X; Zhang, N; Shi, L; Qin, CF; Xu, Z (11. května 2016). „Virus Zika narušuje vývoj nervových progenitorů a vede k mikrocefalii u myší“. Buňková kmenová buňka. 19 (1): 120–6. doi:10.1016 / j.stem.2016.04.017. PMID 27179424.
- ^ Wu, Kong-Yan; Zuo, Guo-Long; Li, Xiao-Feng; Ye, Qing; Deng, Yong-Qiang; Huang, Xing-Yao; Cao, Wu-Chun; Qin, Cheng-Feng; Luo, Zhen-Ge (2016-05-13). „Vertikální přenos viru Zika zaměřený na radiální gliové buňky ovlivňuje vývoj kůry u potomků myší“. Cell Research. 26 (6): 645–654. doi:10.1038 / cr.2016.58. ISSN 1748-7838. PMC 4897185. PMID 27174054.
- ^ Tang, Hengli; Hammack, Christy; Ogden, Sarah C .; Wen, Zhexing; Qian, Xuyu; Li, Yujing; Yao, Bing; Shin, Jaehoon; Zhang, Feiran (05.05.2016). „Virus Zika infikuje lidské kortikální nervové předky a oslabuje jejich růst“. Buňková kmenová buňka. 18 (5): 587–590. doi:10.1016 / j.stem.2016.02.016. ISSN 1934-5909. PMC 5299540. PMID 26952870.
- ^ Zilles, Karl; Armstrong, Este; Schleicher, Axel; Kretschmann, Hans-Joachim (01.11.1988). "Lidský vzorec gyrifikace v mozkové kůře". Anatomie a embryologie. 179 (2): 173–179. doi:10.1007 / BF00304699. ISSN 0340-2061. PMID 3232854.
- ^ Madan, Christopher R .; Kensinger, Elizabeth A. (2016-07-01). „Kortikální složitost jako měřítko věkové atrofie mozku“. NeuroImage. 134: 617–629. doi:10.1016 / j.neuroimage.2016.04.029. ISSN 1053-8119. PMC 4945358. PMID 27103141.
- ^ „LGI - Free Surfer Wiki“. surfař.nmr.mgh.harvard.edu. Citováno 2018-05-02.
- ^ Schaer, M .; Cuadra, M.B .; Tamarit, L .; Lazeyras, F .; Eliez, S .; Thiran, J.-P. (Únor 2008). „Povrchový přístup ke kvantifikaci lokální kortikální gyrifikace“. Transakce IEEE na lékařském zobrazování. 27 (2): 161–170. doi:10.1109 / tmi.2007.903576. ISSN 0278-0062. PMID 18334438.
| Scholia má téma profil pro Gyrifikace. |

