Galium halogenidy - Gallium halides
Existují tři sady halogenidy gália, trihalogenidy, kde má gallium oxidační stav +3, interhalogenidy obsahující gallium v oxidační stavy +1, +2 a +3 a některé nestabilní monohalidy, kde má gallium oxidační stav +1.
Trihalogenidy
Všechny čtyři trihalogenidy jsou známy. Všechny obsahují gallium v +3 oxidačním stavu. Jejich vlastní jména jsou fluorid galia (III), chlorid galia (III), bromid galia (III) a jodid galia (III).
- GaF3
- GaF3 je bílá pevná látka, která sublimuje předtím, než se roztaje, s odhadovanou teplotou tání nad 1000 ° C. Obsahuje 6 souřadných atomů gália s trojrozměrnou sítí GaF6 oktaedra sdílení společných rohů.
- GaCl3, GaBr3 a GaI3
- Všechny mají nižší teplotu tání než GaF3, (GaCl3 teplota tání 78 ° C, GaBr3 teplota tání 122 ° C, Gal3 teplota tání 212 ° C), což odráží skutečnost, že všechny jejich struktury obsahují dimery se 4 souřadnicovými atomy gália a 2 můstkovými atomy halogenu. Všichni jsou Lewisovy kyseliny, tvořící hlavně 4 souřadnicové adukty. GaCl3 je nejčastěji používaný trihalogenid.
Meziprodukty halogenidů
Meziprodukty obsahují chloridy, bromidy a jodidy. Obsahují galium v oxidačních stavech +1, +2 a +3.
- Ga3Cl7
- Tato sloučenina obsahuje Ga2Cl7− ion, který má strukturu podobnou dichroman, Cr2Ó72−, iont se dvěma čtyřboká koordinovanými atomy gália sdílejícími roh. Sloučenina může být formulována jako heptalorodigalát gallinatý (I), GaJá GaIII2Cl7.[1]
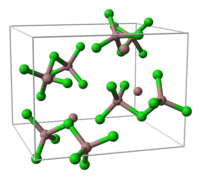


jednotková buňka Ga3Cl7 část Krystalická struktura struktura [Ga2Cl7]−
- GaCl2, GaBr2 a GaI2
- Jedná se o nejznámější a nejvíce studované meziprodukty halogenidů. Obsahují galium v oxidačních stavech +1 a +3 a jsou formulovány GaJáGaIIIX4. Dihalogenidy jsou v přítomnosti vody nestabilní nepřiměřené na kov galia a entity galia (III). Jsou rozpustné v aromatických rozpouštědlech, kde byly izolovány arenové komplexy a aren je η6 koordinováno s Ga+ ion. U některých ligandů, L, např. dioxan, neutrální komplex, Ga2X2L2, s vazbou gália a gália. Tyto sloučeniny byly použity jako cesta k sloučeninám galiového řetězce a shluku.
- Ga2Br3 a Ga2Já3
- Ty jsou formulovány GaJá2 GaII2Br6 a GaJá2 GaII2Já6 resp. Oba anionty obsahují vazbu gália a gália, kde má galium formální oxidační stav +2. Ga2Br62− anion je zastíněn jako In2Br62− anion v In2Br3 zatímco Ga2Já62− anion je isostrukturní se Si2Cl6 s rozloženou konformací.
Monohalidy
Žádný z monohalidů není stabilní při pokojové teplotě. Ukázalo se, že dříve uváděné GaBr a GaI vyrobené z fúzního gália s trihalogenidem jsou směsi kovového gália s Ga2Br3 a Ga2Já3.
- GaCl a GaBr
- GaCl a GaBr byly vyrobeny v plynné formě z reakce HX a roztaveného gália pomocí speciálního reaktoru. Byly izolovány zhášením vysokoteplotního plynu při 77 K. GaCl je označován jako červená pevná látka nepřiměřené nad 0 ° C. Takto vyrobené GaCl a GaBr lze stabilizovat ve vhodných rozpouštědlech. Takto vytvořené metastabilní roztoky byly použity jako prekurzory mnoha shlukových sloučenin gália.
- V HVPE produkce GaN GaCl se vyrábí průchodem plynného HC1 nad roztaveným gáliem, které se potom nechá reagovat s NH3 plyn.[2]
- GaI
- Gal se vyrábí jako reaktivní zelený prášek, který je oslavován jako „univerzální činidlo pro syntetického chemika“.[3] Chemická struktura činidla označovaného jako „GaI“ vyrobeného reakcí kovového gália s jodem v toluenu pomocí ultrazvuku byla zkoumána teprve nedávno pomocí 69/71 Ga pevné fáze v pevné fázi a přiřazené předběžné struktury, která zahrnuje atomy kovového gália, [Ga0]2[Ga]+[GaI4]−.[4]
Aniontové halogenidové komplexy
Soli obsahující GaCl4−, GaBr4− a GaI4− jsou všichni známí. Gallium se velmi liší od indium v tom, že je známo, že tvoří 6 souřadnicových komplexů s fluoridovým iontem. To lze racionalizovat menší velikostí gália (iontové poloměry Ga (III) 62 pm, In (III) 80 pm).
Soli obsahující Ga2Cl62− anion, kde gallium má oxidační stav +2, jsou známy.
Obecné odkazy
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5
Poznámky pod čarou
- ^ Die Kristallstruktur von Ga3Cl7 Frank W., Hönle W., Simon A., Z. Naturforsch. Teil B (1990) 45B 1
- ^ Kuech T.F, Shulin Gu, Ramchandra Wate, Ling Zhang, Jingxi Sun, J.A. Dumesic a J.M. Redwing Mat. Res. Soc. Symp. Proc. Sv. 639 G 1.1.1
- ^ Baker R.J., Jones C. Dalton Trans. 2005 Duben 21; (8): 1341-8
- ^ Widdifield, Cory M .; Jurca, Titel; Richeson, Darrin S .; Bryce, David L. (2012). „Použití 69 / 71Ga polovodičových NMR a 127I NQR jako sond k objasnění složení„ GaI"". Mnohostěn. 35 (1): 96–100. doi:10.1016 / j.poly.2012.01.003. ISSN 0277-5387.



