Fukuyama syntéza indolu - Fukuyama indole synthesis
The Fukuyama syntéza indolu je všestranný zprostředkovaný cínem chemická reakce což má za následek tvorbu 2,3-disubstituovaného indoly.[1] Praktická reakce v jedné nádobě, která může být užitečná pro tvorbu disubstituovaných indolů.[2] Nejčastěji tributylcín hydrid se používá jako redukční činidlo s azobisisobutyronitril (AIBN) jako radikální iniciátor. Triethylboran lze také použít jako radikální iniciátor.[3] Reakce může začít buď an ortho-isokyanostyren nebo 2-alkenylthioanilid derivát, oba tvořící indol Radikální cyklizace přes a-stannoimidoyl radikál.[4] Skupinou R může být řada jak bazických, tak kyselých citlivých funkčních skupin, jako jsou estery, THP ethery a β-laktamy. Kromě toho reakce není stereospecifické, v tom oba cis a trans k získání požadovaného produktu lze použít izoformu.[5]

Mechanismus
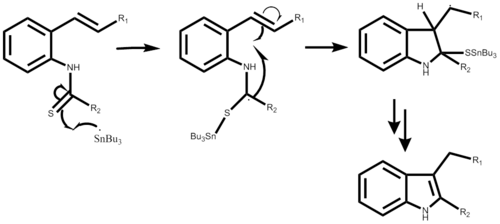
The mechanismus reakce začíná vytvořením tributylcínového radikálu buď s AIBN nebo triethylboranem, což není znázorněno ani v postupném mechanismu. V návaznosti na útoky radikálů o-isokyano uhlík vytváří alfa-stannoimidoyl radikál. Radikální cyklizací se vytvoří pětičlenný kruh následovaný množením nového cínového radikálu. Poslední krok závisí na požadovaném výsledku reakce. Tato reakce je a syntéza v jedné nádobě a vede k výtěžkům v rozmezí od 50% do 98% v závislosti na substituentu.[1]

Mechanismus použití 2-alkenylthioanilidu je velmi podobný, počínaje také tvorbou vazby, nyní mezi radikálem cínu a sírou. Následovala podobná radikální cyklizace, která vedla k pětičlennému kruhu, je vytvořen nový cínový radikál a původní útočící radikál odchází se substituentem síry. Tato část postupného mechanismu musí být ještě podrobná. Výtěžek reakce se může pohybovat od 40% do 93% v závislosti také na požadovaném substituentu.
Deriváty
Syntéza indolu Fukuyama může generovat řadu různých substituentů v poloze 2,3, které byly dříve nedosažitelné bez chránící skupina na dusíku v kruhu. Jedním takovým příkladem je derivát 2-jodindolu, který pak může vést k řadě N-nechráněných 2,3 substituovaných indolů. Před objevením této sloučeniny nebyla vyvinuta chemie zahrnující 2-stannylindoly, protože neexistoval způsob, jak tyto N-nechráněné 2,3-stannylindoly prakticky syntetizovat. Jeden byl omezen na výrobu 2-stannylindolů chráněných N-atomem metalation procesem známým jako Stille spojka.[6] N-nechráněné 2-stannylindoly generované syntézou Fukuyama mohou být snadno oxidovány jodem, což otevírá chemickou oblast, která umožňuje syntézu různých sloučenin využívajících 2-jodindoly jako výchozí činidlo. Tento jodem substituovaný derivát může vést k arylhalogenidům, vinyljodidům, vinyl triflátom, benzylbromidům.

Kromě acetylenů (Sonogashira spojka ) a akryláty (Heck reakce ) na druhé pozici.[5]

Aplikace
Syntéza je jednou z nejjednodušších metod pro vytváření polysubstituovaných indolů, tento postup se již používá v řadě přírodní produkt syntézy, počítaje v to aspidofytin,[7] vinblastin,[8] a strychnin[9]
Níže je uveden čtvrtý krok v syntéze (+) - vinblastinu, aplikace syntézy indolu Fukuyama k vytvoření disubstituovaného indolu.

Kromě toho hraje fukuyamova reakce roli v syntéze indolokarbazolů,[5] biindolyly,[5] a celková syntéza vincadifformin a tabersonin.[10]
Reference
- ^ A b Fukuyama, T .; Chen, X .; Peng, G. (1994). „Nová cínem zprostředkovaná syntéza indolu“. J. Am. Chem. Soc. 116 (7): 3127–8. doi:10.1021 / ja983681v.
- ^ Pindur, U .; Adam, R. (1998). "Synteticky atraktivní indolizační procesy a novější metody pro přípravu selektivně substituovaných indolů". J. Heterocycl. Chem. 25 (1): 1–8. doi:10,1002 / jhet. 5570250101.
- ^ Tokuyama, H .; Yamashita, T .; Reding, M. T .; Kaburagi, Y .; Fukuyama, T. (1999). „Radikální cyklizace 2-alkenylthioanilidů: nová syntéza 2,3-disubstituovaných indolů“. J. Am. Chem. Soc. 121 (15): 3791–2. doi:10.1021 / ja983681v.
- ^ Gribble, G. (2000). "Poslední vývoj v syntéze indolového kruhu - metodologie a aplikace". J. Chem. Soc. Perkin Trans. 1. 2000 (7): 1045–75. doi:10.1039 / a909834h.
- ^ A b C d Kobayashi, T .; Fukuyama, T. (1998). "Vývoj nové syntézy indolu". J. Heterocycl. Chem. 35 (5): 1043–56. doi:10,1002 / jhet. 5570350504.
- ^ Trost, B. M .; Fortunak, J. M. (1982). "Cyklizace zahájená Pd2+-Ag+ smíšený kovový systém “. Organometallics. 1 (7): 7–10. doi:10.1021 / om00061a003.
- ^ Sumi, S .; Matsumoto, K .; Tokuyama, H .; Fukuyama, T. (2003). "Enantioselektivní celková syntéza aspidofytinu". Org. Lett. 5 (11): 1891–3. doi:10.1021 / ol034445e. PMID 12762679.
- ^ Yokoshima, S .; Ueda, T .; Kobayashi, S .; Sato, A .; Kuboyama, T .; Tokuyama, H .; Fukuyama, T. (2002). "Stereo řízená celková syntéza (+) - vinblastinu". J. Am. Chem. Soc. 124 (10): 2137–9. CiteSeerX 10.1.1.414.6638. doi:10.1021 / ja0177049. PMID 11878966.
- ^ Kaburagi, Y .; Tokuyama, H .; Fukuyama, T. (2004). "Celková syntéza (-) - strychninu". J. Am. Chem. Soc. 126 (33): 10246–7. doi:10.1021 / ja046407b. PMID 15315428.
- ^ Kobayashi, S .; Peng, G .; Fukuyama, T. (1999). Msgstr "Efektivní celková syntéza (±) -vincadifforminu a (-) - tabersoninu". Tetrahedron Lett. 40 (8): 1519–22. doi:10.1016 / S0040-4039 (98) 02667-7.
