Fluorace aminosulfurany - Fluorination with aminosulfuranes
Fluorace aminosulfurany je chemická reakce, která transformuje oxidované organické sloučeniny na organofluorové sloučeniny. Aminosulfurany selektivně vyměňují hydroxylové skupiny za fluor, ale jsou také schopné převádět karbonylové skupiny, halogenidy, silylethery a další funkční skupiny na organofluoridy.[1]
Úvod
Před zavedením diethylaminosulfur trifluorid (DAST) v roce 1970 za nahrazení hydroxylových skupin fluoridem, tetrafluorid síry bylo reakčním činidlem nejčastěji používaným k dosažení této transformace. Sírový tetrafluorid však reaguje pouze s nejkyselejšími hydroxylovými skupinami (rozsah jeho substrátu je omezený) a je obtížné s ním manipulovat, je toxický a schopný generovat fluorovodík při hydrolýze. Aminosulfuranová činidla, jako jsou diethylaminosulfur trifluorid do značné míry nahradily SF4 jako reagenty volby pro nahrazení hydroxylových skupin fluoridem.[2]
- HOR FR
(1)
Aminosulfurany se obvykle připravují reakcí odpovídajících dialkylamino (trialkyl) silanů s SF4.[2] Když je aminosulfuran vystaven druhému ekvivalentu aminosilanu, vzniknou difluoridy bis (dialkylamino) síry.[3] Tris (dialkylamino) sulfonium difluorotrimethylsilikáty, jako je tris (diethylamino) sulfonium difluorotrimethylsilikát (ÚLOHA ) dosáhli syntetické užitečnosti jako činidla pro fluoraci halogenidů. Vznikají, když jsou tři ekvivalenty aminosilanu vystaveny tetrafluoridu sírovému.[4]
(2)
Mechanismus a stereochemie
Převládající mechanismus
Mechanismus fluorace pomocí DAST se vyrovná mechanismu fluorace tetrafluorid síry. Útok hydroxylové skupiny substrátu na síru a eliminace fluorovodíku vedou k meziproduktu alkoxyaminosulfur difluoridu. Nukleofilní útok fluoridem, buď SN1[5] nebo S.N2[6] cesta vede k produktu. Ačkoli byla u řady chirálních alkoholů pozorována čistá konfigurační inverze, v některých případech byly pozorovány také karbokationtové přesmyky. Operativní dráha závisí na struktuře podkladu.
(3)
Konverze aldehydů a ketonů na odpovídající geminální difluoridy probíhá podobným mechanismem, přičemž výše popsanému mechanismu nahrazení hydroxylové skupiny předchází přidání fluorovodíku. Důležitým vedlejším produktem při fluoracích enolizovatelných ketonů je odpovídající vinylfluorid, který je výsledkem deprotonace intermediárních fluorovaných karbokationtů.
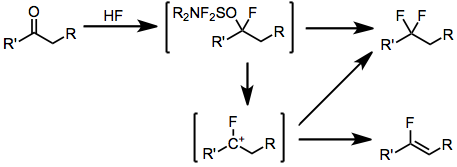
(4)
Halogenidy reagují v podstatě metatetickou výměnou halogenidu za fluorid. Byly izolovány vedlejší produkty obsahující vyměněný halogenid.[7]
Rozsah a omezení
Aminosulfurany jsou vysoce selektivní pro nahrazení hydroxylových skupin fluoridem, ale při absenci alkoholové funkční skupiny mají schopnost transformovat širokou škálu substrátů na odpovídající fluoridy nebo acylfluoridy. Například ketony se převádějí na geminální difluoridy.[8] Avšak na rozdíl od tetrafluoridu síry aminosulfurany nepřevádějí karboxylové kyseliny na trifluormethylové skupiny; reakce se zastaví ve fázi acylfluoridu.[9] Silyl ethery se převádějí na organofluoridy v přítomnosti DAST.[10]
(5)
Aldehydy a ketony reagují s DAST za vzniku odpovídajících drahých difluoridů. Fluorací enolizovatelných ketonů se získá směs difluoralkanu a vinylfluoridu. v glyme s dýmáním kyselina sírová, převládá produkt vinylfluoridu.[11] Karbonylové sloučeniny bohaté na elektrony, jako jsou estery a amidy, nereagují s DAST nebo jinými aminosulfurany.
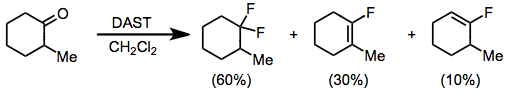
(6)
Epoxidy mohou poskytovat různé produkty v závislosti na jejich struktuře. Obecně platí, že produkty, které se tvoří v nejvyšším výtěžku, jsou vicinální difluoridy a bis (a-fluoralkyl) ethery. Tato reakce však vede k nízkým výtěžkům a není synteticky užitečná.[12]
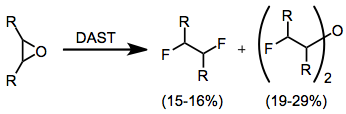
(7)
Polární mechanismus fluorace pomocí DAST znamená, že určité substráty mohou trpět Wagner-Meerweinovy přesmyky. Tento proces byl pozorován při fluoraci pivalaldehydu, která poskytuje směs 1,2-difluor-1,2-dimethylpropanu, 1,1-difluor-2,2-dimethylpropanu a 1-fluor-2,2-dimethylethylenu .[8]
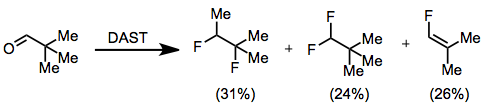
(8)
Dioly mohou za podmínek fluorace projít přeskupením pinakolu.[13]
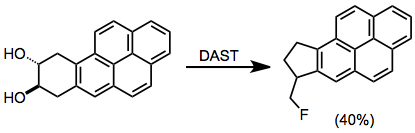
(9)
Když se sulfoxidy zpracují DAST, dojde k zajímavému přeskupení typu Pummerer, aby se získaly a-fluorsulfidy.[14]
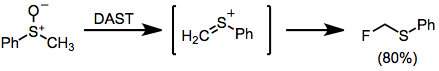
(10)
Srovnání s jinými metodami
Aminosulfurany se příznivě srovnávají s mnoha dalšími dostupnými způsoby fluorace. Manipulace s nimi je snadnější než s tetrafluoridem sírovým; nicméně SF4 nepodporuje kationtové přesmyky.[15] Pokud jde o karboxylové kyseliny, aminosulfurany a SF4 jsou komplementární: první dává kyselé fluoridy, zatímco druhý dává trifluormethylové sloučeniny.
(11)
Perfluorované alkylaminy, jako např Ishikawovo činidlo (N,N-diethyl-1,1,2,3,3,3-hexafluorpropylamin),[16] jsou vysoce selektivní pro hydroxylové skupiny a nereagují s aldehydy a ketony. Amidové vedlejší produkty těchto reakčních činidel je však těžší oddělit od požadovaných produktů než vedlejší produkty aminosulfuranu.

(12)
Alkalické a tetraalkylamoniumfluoridy mohou být použity k vytěsnění sulfonátových esterů; tyto reakce však vyžadují vyšší teploty než fluorace aminosulfuranu odpovídajících volných alkoholů.[17]
- ROSO
2R RF(13)
Experimentální podmínky a postup
Typické podmínky
Fluorace s DAST mohou být prováděny v běžném skleněném zařízení, i když leptání skla může být výsledkem reakčních vedlejších produktů. Reakce se typicky provádějí v aprotických nebo nepolárních rozpouštědlech. Z reakce by měla být vyloučena vlhkost a vzdušný kyslík. Reakce se obvykle zahajují při -78 ° C a zahřívají se na teplotu místnosti nebo vyšší; reakce by však neměly být zahřívány nad 80 ° C, protože při této teplotě začne docházet k rozkladu fluoračního činidla. Zpracování obvykle zahrnuje nalití reakční směsi nad vodu nebo led, následovanou neutralizací kyselých vedlejších produktů hydrogenuhličitanem sodným. K izolaci požadovaných fluorovaných produktů lze použít standardní způsoby čištění.
Příklad postupu
- HOC
7H
15 FC
7H
15 (90%)(14)
Roztok 13,0 g (0,1 mol) 1-oktanolu ve 25 ml dichlormethan se po kapkách přidá k roztoku 16,1 g (0,1 mol) sloučeniny diethylaminosulfur trifluorid v 60 ml dichlormethanu ochlazeného na –70 ° až –65 °. Reakční směs byla zahřátá na 25 ° C, 50 ml voda Přidá se a spodní organická vrstva se oddělí a vysuší bezvodým Síran hořečnatý a destiluje se, čímž se získá 12,0 g (90%) 1-fluoroktanu ve formě bezbarvé kapaliny, teplota varu 42 až 43 ° (20 mm). 19F NMR (CCl3F): -218,8 ppm (tt, 2J = 49 Hz, 3J = 25 Hz).[18]
Reference
- ^ Hudlicky, M. Org. Reagovat. 1988, 35, 513. doi:10.1002 / 0471264180.nebo035.03
- ^ A b von Halasz, P .; Glemser, O. Chem. Ber. 1970, 103, 594.
- ^ Markovskii, N .; Pashinnik, E .; Kirsanova, A. Zh. Org. Khim. 1975, 11, 74 (Angl. překlad, 72).
- ^ Middleton, W. J. U.S. Patent 3940402 (1976) [C.A., 85, 6388j (1976)].
- ^ Rozen, S.; Faust, Y.; Ben-Yakov, H. Tetrahedron Lett. 1979, 20, 1823.
- ^ Leroy, J .; Hebert, E .; Wakselman, C. J. Org. Chem. 1979, 44, 3406.
- ^ Markovskii, N .; Pashinnik, E. Syntéza, 1975, 801.
- ^ A b Middleton, J. J. Org. Chem. 1975, 40, 574.
- ^ Markovskii, N .; Pashinnik, E .; Kirsanova, A. Syntéza, 1973, 787.
- ^ LeTourneau, E .; McCarthy, R. Tetrahedron Lett. 1984, 25, 5227.
- ^ Boswell, Jr., G. A. US Patent 4212815 (1980) [C.A., 93, 239789w (1980)].
- ^ Hudlický, M. J. Fluorine Chem. 1987, 36, 373.
- ^ Newman, S .; Khanna, M .; Kanakarajan, K. J. Am. Chem. Soc. 1979, 101, 6788.
- ^ McCarthy, R .; Peet, P .; LeTourneau, E .; Inbasekaran, M. J. Am. Chem. Soc., 107, 735 (1985).
- ^ Wang, C.-L. Org. Reagovat. 1985, 34, 319.
- ^ Takaoka, A .; Iwagiri, H .; Ishikawa, N. Býk. Chem. Soc. Jpn. 1979, 52, 3377.
- ^ Pattison, M .; Millington, E. Umět. J. Chem. 1956, 34, 757.
- ^ Middleton, W. J. U.S. Patent 3914265 (1975) [C.A., 84, 42635a (1976)]; 3976691 (1976) [C.A., 86, 29054 g (1977)].

![{ displaystyle { begin {array} {l} { ce {{R2N-Si (CH3) 3} + SF4 -> R2N-SF3}} {} { ce {{R2N-SF3} - > [{ ce {R2N-Si (CH3) 3}}] R2N}} {-} ! { begin {matrix} { ce {F2}} { ce {S}} {} end {matrix}} ! { ce {-NR2}} { ce {{3R2N-Si (CH3) 3} + SF4 -> underbrace {(R2N) 2SF2 + (CH3) 3SiF2 ^ -} _ {TASF}}} end {pole}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/776821bd8121707d1ef3108ec4dedda8270846c7)
![{ displaystyle { begin {matrix} {} { ce {R}} {-} { color {Blue} { ce {OH}}} { ce {-> [ color {červená} { ce {R2N-SF3}}] [- { ce {H}} { color {Red} { ce {F}}}] R}} {-} { color {Blue} { ce { O}}} { ce {-SF2NR2 -> [ color {Red} { ce {F -}}] [{ ce {S_ {N} 1 nebo S_ {N} 2}}] R} } {-} { color {Red} { ce {F}}} {} end {matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22904adda801c3a89197c72e6029a952bc3ba6dc)






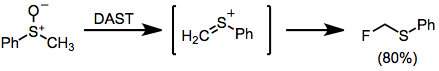
![{ displaystyle { ce {{ underset {carboxylic acid} {R-CO2H}} -> [{} na vrcholu { ce {SF4}}] { underset {trifluormethyl} {R-CF3}}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fab5bbd5519e38953de667bb9c011406cfa65e14)
