Fam188a - Fam188a
Gen
Fam188a je protein nacházející se u lidí. Je také známý jako Derp5 (Dermal Papilla Derived Protein 5,) c10orf97, nebo mozek my042 protein. Je kódován pomocí Gen Derp5 umístěný na chromozom 10p 13.[5][6] Fam188a a jeho paralogy u jiných druhů jsou všichni členy nadrodiny proteinových domén DUF4205. Fam188a je vysoce konzervovaný gen vyskytující se ve všech obratlovců. Fam188a je gen exprimovaný v těle.[7]

Předpokládaná proteinová struktura Fam188a pomocí I-TASSER
Homologie
Všechny srovnávané druhy savců mají 95-99% podíl homologie podobnost s Homo sapiens Fam188a. Důvody toho nejsou známy, ale lze odvodit, že Fam188a musí hrát důležitou roli ve správné buněčné funkci u savců, protože i malé změny v čase v důležitých genech mohou drasticky změnit jejich funkci.

Evoluční srovnání různých druhů Fam188a
Avians, Fish a Insects také sdíleli podobnost v rozmezí 30-40% s Homo sapiens 'Fam188a. I když existuje několik set milionů let odlišností od Lidé a hmyzu se zdá, že skutečnost, že u hmyzu stále existuje 40% podobnost, naznačuje, že tento gen se za tak dlouhou dobu extrémně nezměnil a už dávno musel být důležitý i pro jiné druhy. The spojit vzory u těchto jiných druhů nejsou známy, ale u lidí existuje nejméně 19 různých izoformy ale pouze s 1 hlavním paralogem: Fam188b.[8] Tento paralog se strukturně liší ve 3 exonech u Fam188a.
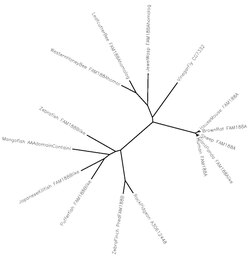
Evoluční strom mezi různými druhy, které mají homology Fam188a.
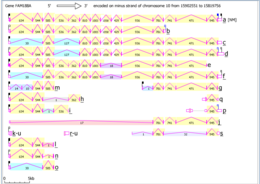
Intron / exonová mapa Fam188a v Homo sapiens
Protein
Fam188a je 445-Aminokyselina řetěz. Strukturálně neukazuje mnoho zajímavých oblastí, které by ji mohly snadno odlišit od ostatních proteinů. Fam188a nemá žádné transmembránové domény, nemá žádné opakování sekvencí.

Fam188a posttranslační predikovaná sekundární struktura proteinu

Fam188a předpovídal vazebná místa pro transkripční faktor
Funkce a interagující proteiny
I-TASSER[9] výsledky skládání bílkovin ukazují, že proteinový produkt Fam188a má podobnou strukturu jako 1CFF,[10] A Kalmodulin vazebný peptid. Kalmodulin se podílí na buňce apoptóza stejně, takže to může také osvětlit teoretickou funkci Fam188a.
Proteinový záhyb je funkčně nejvíce podobný 3LEW,[11] „protein vázající sacharidy podobný SusD z Bacteroides vulgatus“(Společné středisko pro strukturní genomiku). 3LEW sdílí 90% podobnost s Fam188a, ai když to nestačí k vytvoření konkrétního spojení, stačí vytvořit základní myšlenku souvisejících struktur. Dalším funkčně podobným proteinem (81%) je 3SNX, „domnělý protein vázající sacharidy podobný SusD z Bacteroides thetaiotaomicron VPI-5482 ”.[12] Lze předpokládat, že funkce Fam188a hraje roli v buněčné apoptóze, a to proto, že sdílí strukturální podobnosti s jinými proteiny, které se účastní tohoto procesu. Ačkoli neexistuje žádná doména CARD, jak by se normálně nacházela v apoptotickém peptidu, fam188a sdílí podobnou funkci s 1cffA, „peptidem vázajícím kalmodulin Ca2 + pumpy“.[10] Protože je známo, že kalmodulin způsobuje apoptózu v různých tělesných tkáních pomocí pumpy Ca2 +[13][14] a 1cffA sdílí 26% podobnost s Fam188a, mohu předpokládat, že apoptóza je skutečně funkcí Fam188a. Další molekuly podobné Fam188a jsou 1linA,[15] a 1qx7M, které sdílejí 23%, respektive 18% strukturní podobnost, a obě tyto molekuly se také zabývají buď pumpou Ca2 + nebo expresí kalmodulinu.
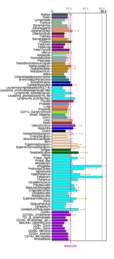
Exprese tkáně Fam188a v různých tělesných tkáních
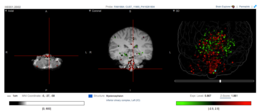
Expresní umístění Fam188a v lidském mozku

Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000148481 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000026767 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ GeneCard pro fam188a
- ^ HomoloGene: 11478
- ^ "Datový list Fam188a" (PDF).
- ^ GeneCard pro FAM188B
- ^ Roy A, Kucukural A, Zhang Y (2010). „I-TASSER: jednotná platforma pro automatickou predikci struktury a funkce proteinů“. Přírodní protokoly. 5 (4): 725–38. doi:10.1038 / nprot.2010.5. PMC 2849174. PMID 20360767.
- ^ A b PDB: 1CFF; Elshorst B, Hennig M, Försterling H, Diener A, Maurer M, Schulte P, Schwalbe H, Griesinger C, Krebs J, Schmid H, Vorherr T, Carafoli E (1999). "Struktura roztoku NMR komplexu kalmodulinu s vazebným peptidem pumpy Ca2 +". Biochemie. 38 (38): 12320–32. doi:10.1021 / bi9908235. PMID 10493800.
- ^ PDB: 3lew
- ^ PDB: 3 snx
- ^ Yu W, Niwa T, Miura Y, Horio F, Teradaira S, Ribar TJ, znamená AR, Hasegawa Y, Senda T, Niki I (2002). „Nadměrná exprese kalmodulinu způsobuje Ca (2 +) - závislou apoptózu beta buněk pankreatu, které lze zabránit inhibicí syntázy oxidu dusnatého“. Laboratorní vyšetřování. 82 (9): 1229–39. doi:10.1097 / 01.lab.0000027921.01548.c5. PMID 12218084.
- ^ Ui-Tei K, Nagano M, Sato S, Miyata Y (2000). „Na kalmodulinu závislá a nezávislá apoptóza v buňce neuronální buněčné linie Drosophila“. Apoptóza. 5 (2): 133–40. doi:10.1023 / A: 1009676528805. PMID 11232241. S2CID 33324141.
- ^ PDB: 1 řádek; Vandonselaar M, Hickie RA, Quail JW, Delbaere LT (1994). "Trifluoperazinem vyvolaná konformační změna Ca (2 +) - kalmodulin". Přírodní strukturní biologie. 1 (11): 795–801. doi:10.1038 / nsb1194-795. PMID 7634090. S2CID 13431074.













