FAM98A - FAM98A
| FAM98A | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||||||||||||||||||
| Aliasy | FAM98A, rodina se sekvenční podobností 98 členů A | ||||||||||||||||||||||||
| Externí ID | MGI: 1919972 HomoloGene: 41042 Genové karty: FAM98A | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortology | |||||||||||||||||||||||||
| Druh | Člověk | Myš | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (protein) | |||||||||||||||||||||||||
| Místo (UCSC) | Chr 2: 33,58 - 33,6 Mb | Chr 17: 75,54 - 75,55 Mb | |||||||||||||||||||||||
| PubMed Vyhledávání | [3] | [4] | |||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Rodina se sekvenční podobností 98, člen Anebo FAM98A, je gen, který v lidský genom kóduje protein FAM98A. FAM98A má dva paralogy u lidí, FAM98B a FAM98C. Všechny tři jsou charakterizovány DUF2465, konzervativní doménou, na kterou se váže RNA.[5] FAM98A se také vyznačuje bohatým na glyciny C-koncová doména.[6] FAM98A také má homology u obratlovců a bezobratlých a má vzdálené homology v choanoflagellates a zelené řasy.
Gen
Místo
Gen FAM98A je lokalizován na 2p22.3 u lidí na řetězci „-“ (minus). Včetně 5 'a 3' UTR, gen pokrývá 15 634 bází a obsahuje 8 exonů.[7]
mRNA
MRNA je 2745 bp, zahrnující 8 exonů. Kódující sekvence začíná na bázi 75 a pokračuje až do báze 1631. Signální sekvence polyA ocasu je šest-nukleotidová sekvence 20 bází od 3 'konce transkriptu na bázi 2725-2730 a místo polyA je na bázi 2745.[8]
Protein
Primární sekvence
FAM98A má délku 518 aminokyselin s molekulovou hmotností 55,3 kDa bez modifikací. Zbytky 10 - 329 obsahují DUF2465 a zbytek proteinu je C-konec bohatý na diglyciny. Glycin tvoří přibližně 20% proteinu, přičemž většina z nich je v posledních 200 zbytcích.[9]
Posttranslační úpravy
FAM98A má šest silně předpovězených fosforylačních míst v DUF2465. Předpokládá se, že tato místa fosforylují S169, T178, S236, T243, S276 a S285 proteinovou kinázou C.[10] GPS také předpovídá fosforylaci proteinovou kinázou C na S285 a T178.[11]FAM98A je pravděpodobně sumoylována na K183 a K195.[12] Sumoylace může umožnit buňce znovu lokalizovat FAM98A mezi jádrem a cytoplazmou.[13] C-konec bohatý na glycin má opakované sekvence GRG, u nichž se ukázalo, že jsou citlivé na methylaci argininu, buď symetricky nebo asymetricky.[14] Další článek vysvětluje účinky methylace argininu na biochemické funkce, jako je aktivace a represi transkripce, sestřih mRNA, nukleární cytosolická doprava a oprava DNA.[15]
Sekundární struktura
Předpokládá se, že N-konec bude mít více alfa šroubovic, ačkoli C-konec bude pravděpodobně pouze stočený.[16] Alfa šroubovice netvoří žádný kanál a FAM98A není transmembránový protein.
Terciární a kvartérní struktura
Struktura FAM98A byla předpovězena programem Phyre2. N-koncová oblast obsahuje několik alfa šroubovic a C-koncovou stočenou oblast odpovídající C-konci bohatému na glycin. Tyto dvě oblasti proteinu jsou spojeny alfa šroubovicí přibližně 50 zbytků dlouhých od zbytků 200-256. Phyre2 zjistil, že nejpodobnějším proteinem je složka lidského proteinu NDC80 kinetochore, nukleární protein, který se váže na mikrotubuly.[17]
Domény a motivy
FAM98A má doménu neznámé funkce 2465 (DUF2465) z aminokyselin 10-329. V DUF2465 je poblíž C-terminálního konce heptid (VPDRGGR), který je konzervován u všech testovaných druhů. C-terminální konec je doména bohatá na glycin (glycin tvoří asi 40% C konce) s GGRGGR opakováními.[9] Ve zbytcích 149-155 existuje předpovězený signál jaderného exportu se sekvencí ICIALGM (obecně [LIVFM] -X- [LIVFM] -X- [LIVFM] -X- [LIVFM]).[18] Předpokládá se, že zbytky 173-176 budou signálem nukleární lokalizace KKLK (K- [K / R] -X- [K / R]).[19]
Homologie
Paralogy
FAM98A má dva paralogy: FAM98B a FAM98C. FAM98A je nejdelší ze tří paralogních proteinových produktů s 518 aminokyselinami. Je to více podobné FAM98B, jehož C-konec bohatý na glycin je mnohem kratší než FAM98A. FAM98C méně podobný FAM98B jako FAM98A, všechny ale postrádající C konec po DUF2465, stejně jako obsahující více rozdílů v aminokyselinové sekvenci v DUF2465. Ukázalo se, že všechny tři proteinové produkty se nešpecificky spojují s RNA: FAM98A se váže na mRNA a FAM98B je začleněn do komplexu sestřihu tRNA.[5]
Ortology
Ortology pro FAM98A byly nalezeny u obratlovců. U hmyzu a měkkýšů existují předpokládané proteiny pro gen FAM98A. Protože u lidí existují tři paralogy FAM98, existuje společný předek těchto genů. Méně jasný je přísný ortholog, gen, který je kolmý k FAM98A a ne k celé rodině FAM98. FAM98A dosud nebyl důkladně studován, což je spojeno se skutečností, že mnoho genomů je ještě třeba zaznamenat, takže je obtížnější určit, zda je předpokládaný gen FAM98A u komárů přísný ortolog (došlo k rozdělení FAM98 na FAM98A, B, C než se druh rozcházel) nebo pokud se jedná o homolog („FAM98A“ u komárů je rodový gen FAM98).
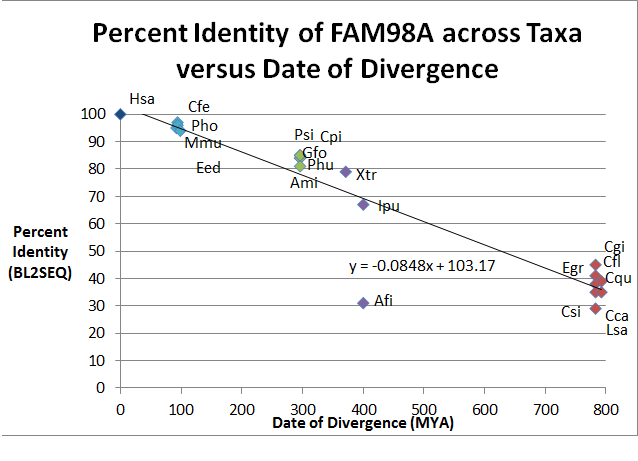
| Sekvence Číslo | Rodové druhy (Gsp) | Běžné jméno | Datum odchylky (MYA) (z Časový strom ) | Přístupové číslo (z NCBI ) | Sekvence Délka (AA) | Identita | Podobnost |
| 1 | Homo sapiens (Hsa) | Člověk | 0 | 518 | 100 | 100 | |
| 2 | Mus musculus (Mmu) | Myš | 92.3 | 515 | 95 | 96 | |
| 3 | Camelus ferus (Cfe) | Bactrian Camel | 94.2 | 517 | 97 | 98 | |
| 4 | Pantholops hodgsonii (Pho) | Tibetská antilopa | 94.2 | 521 | 96 | 97 | |
| 5 | Elephantulus edwardii (Eed) | Klec sloní rejsek | 98.7 | 517 | 94 | 96 | |
| 6 | Geospiza fortis (Gfo) | Středně broušený finch | 296 | 648 | 84 | 88 | |
| 7 | Pseudopodoces humilis (Phu) | Sýkorka | 296 | 545 | 84 | 88 | |
| 8 | Alligator mississippiensis (Ami) | Americký aligátor | 296 | 556 | 81 | 86 | |
| 9 | Pelodiscus sinensis (Psi) | Čínská želva měkká | 296 | 549 | 85 | 88 | |
| 10 | Chrysemys picta bellii (Cpi) | Želva západní | 296 | 549 | 85 | 88 | |
| 11 | Xenopus tropicalis (Xtr) | Western Clawed Frog | 371.2 | 520 | 79 | 86 | |
| 12 | Anoplopoma fimbria (Afi) | Sablefish | 400.1 | 353 | 31 | 48 | |
| 13 | Ictalurus punctatus (Ipu) | Kanál sumec | 400.1 | 543 | 67 | 75 | |
| 14 | Camponotus floridanus (Cfl) | Florida Carpenter Ant | 782.7 | 516 | 41 | 53 | |
| 15 | Culex quinquefasciatus (Cqu) | Komár | 782.7 | 498 | 38 | 52 | |
| 16 | Ceratitis capitata (Cca) | Medfly | 782.7 | 454 | 35 | 51 | |
| 17 | Lepeophtheirus salmonis (Lsa) | Lososí veš | 782.7 | 467 | 29 | 45 | |
| 18 | Crassotrea gigas (Cgi) | Pacifická ústřice | 782.7 | 422 | 45 | 59 | |
| 19 | Clonorchis sinensis (Csi) | Čínská jaterní motolice | 792.4 | 378 | 35 | 47 | |
| 20 | Echinococcus granulosus (Egr) | Psí tasemnice | 792.4 | 1177 | 39 | 56 |
Vzdálení homologové
Předpokládá se, že geny homologní s FAM98A se vyskytují v mnoha taxonech v Animalia, ale existují i jiné taxony mimo Animalia, které mohou mít ve svých genomech homologní geny FAM98. Eukaryota, jako jsou opisthokonts Monosiga brevicollis (XP_00174505.1 ) a Capraspora owczarzaki (XP_004346371.1 ), a dokonce i protist Chlorella variabilis (XP_005845167.1 ), zelená řasa, může obsahovat FAM98 ve svých genomech.[20]
Homologní domény
Homologní doménou ve FAM98A je doména DUF2465 (doména neznámé funkce 2465). Funkce této domény, stejně jako samotného genu, je do značné míry neznámá, i když se uvádí, že se přednostně váže na RNA a cílí na mRNA ve FAM98A a tRNA ve FAM98B.[5]
Výraz
Promotér
Promotor (GXP_90934) přiřazený k lidskému transkriptu FAM98A (GXT_24436545)[21] je 915 bp dlouhý a překrývá se s transkriptem, aby zahrnoval 243 bp transkriptu mRNA. Nukleární respirační faktor 1 (NRF1) je transkripční faktor, u kterého se předpokládalo, že se na promotor váže sedm míst, z nichž čtyři mají podobnost Matrix - optimální skóre 0,085 nebo větší a dva předpokládané předpokládané transkripční faktory byly NRF1 s skóre 0,204 a 0,199.[22]
Výraz
V lidském transkriptomu GEO ve velkém měřítku byl všudypřítomně exprimován FAM98A, i když nebyl exprimován jednotně. Nejvýše exprimované typy buněk byly mnoho částí mozku (kůra, amygdala, thalamus, corpus callosum a hypofýza), varlata, děloha a hladké svalstvo.[23] Podle Aceview je FAM98A exprimován na 3,9násobku exprese průměrného genu. AceView identifikoval jedenáct transkriptů, z nichž pět bylo „dobrých“, úplných (plně přeložených N a C konců) proteinů. Z transkriptů jsou zjevně dvě hlavní části FAM98A: první čtyři exony a druhé čtyři exony a tyto části zhruba odpovídají terciární struktuře proteinu - N-koncové alfa-šroubovice k exonům 1-4 a dlouhé alfa-šroubovité rameno a C-koncové cívky k exonům 5-8.[24]
Funkce a biochemie
Funkce FAM98A nebyla experimentálně stanovena, i když bylo prokázáno, že váže svůj DUF2465 s mRNA.[5] Kiraga a kol. poznamenali, že bazické proteiny se vážou na nukleové kyseliny.[25] Ve skutečnosti má FAM98A (a jeho ortology) nemodifikovaný izoelektrický bod přibližně 9.[26]
Známé interakce
FAM98A bylo experimentálně prokázáno, že interaguje s UBC, DDX1, C14orf166 a SUMO3 a je koexprimován s DDX1, C14orf166 a RBM25.[27] Tyto poslední tři proteiny interagují s mRNA, jak se také předpokládá u FAM98A. DDX1 je domnělá ATP-dependentní RNA helikáza ve spliceosomu, pravděpodobně uvolňující RNA ze sestřihového komplexu.[28] C14orf166 je polymerázový II vazebný faktor,[29] a RBM25 reguluje alternativní sestřih.[30] Všechny tyto interakce naznačují, že FAM98A je jaderný protein. FAM98A také interaguje s SUMO3, který sumoyláty lysinů v proteinu usnadňuje transport přes jadernou membránu mezi jádrem a cytosolem.[13] FAM98A se také váže na nespecifickou mRNA, což indikuje potenciální transport mRNA z jádra na ribozomy.[5]
Klinický význam
Ve studii, která zkoumala rozdíly v úrovních exprese určitých genů (včetně FAM98A) u mladých i starých mužů s dietou s vysokým nebo nízkým obsahem bílkovin, byly hladiny exprese měřeny jako poměr diet s nízkým / vysokým obsahem bílkovin v každé skupině mužů ( mladý a starý). FAM98A měl zvýšenou expresi v dietách s nízkým obsahem bílkovin u mladých i starších mužů, 1,01, respektive 1,20. Pouze jeden další gen ve studii měl stejný trend zvýšené exprese v dietách s nízkým obsahem bílkovin v obou skupinách: THOC4.[31] THOC4, THO komplex 4 nebo exportní faktor Aly / REF, dimerizuje za vzniku většího komplexu a chaperonové sestřihané mRNA, které pomáhají se zpracováním a exportem mRNA.[32] Článek uvádí, že up-regulace mRNA u starších jedinců je spojena s vazbou / sestřihem RNA, signálními proteiny a degradací proteinů; ve skutečnosti má starší skupina vyšší expresi FAM98A v dietách s nízkým obsahem bílkovin než mladší muži.[31]
Sdružení nemocí
Výzkum populace na Tchaj-wanu zjistil souvislost mezi nástupem hypertenze a dvěma SNP před čtyřmi geny v místě 2p22.3. Jedním z těchto čtyř genů byl FAM98A, ačkoli je třeba provést další výzkum, aby se ověřilo, že to byl FAM98A, který byl genem zodpovědným za hypertenzi.[33] FAM98A je ve skutečnosti exprimován středně vysoko (zhruba 75. percentil) v hladkém svalstvu a srdečních myocytech.[23]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000119812 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000002017 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d E Dürnberger G, Bürckstümmer T, Huber K, Giambruno R, Doerks T, Karayel E, Burkard TR, Kaupe I, Müller AC, Schönegger A, Ecker GF, Lohninger H, Bork P, Bennett KL, Superti-Furga G, Colinge J ( Červenec 2013). "Experimentální charakterizace lidského intersekomu nukleové kyseliny nespecifické pro sekvenci". Genome Biology. 14 (7): R81. doi:10.1186 / gb-2013-14-7-r81. PMC 4053969. PMID 23902751.
- ^ „Pfam: Family: DUF2465 (PF10239)“. Pfam. EMBL-EBI. Citováno 5. května 2014.
- ^ „Human Gene FAM98A (uc002rpa.1)“. Genom. NCBI. Citováno 5. května 2014.
- ^ NCBI (Národní centrum pro biotechnologické informace) sekvence mRNA FAM98A NM_015475.3 https://www.ncbi.nlm.nih.gov/nuccore/NM_015475.3
- ^ A b Brendel, V .; Bucher, P .; Nourbakhsh, I.R .; Blaisdell, B.E .; Karlin, S. (1992). "Metody a algoritmy pro statistickou analýzu proteinových sekvencí". Proc. Natl. Acad. Sci. USA. 89 (6): 2002–2006. doi:10.1073 / pnas.89.6.2002. PMC 48584. PMID 1549558.
- ^ Blom N, Sicheritz-Pontén T, Gupta R, Gammeltoft S, Brunak S (červen 2004). „Predikce posttranslační glykosylace a fosforylace proteinů ze sekvence aminokyselin“. Proteomika. 4 (6): 1633–49. doi:10.1002 / pmic.200300771. PMID 15174133. S2CID 18810164.
- ^ Xue Y, Ren J, Gao X, Jin C, Wen L, Yao X (září 2008). „GPS 2.0, nástroj pro předpovídání míst fosforylace specifických pro kinázy v hierarchii“. Molekulární a buněčná proteomika. 7 (9): 1598–608. doi:10,1074 / mcp.m700574-mcp200. PMC 2528073. PMID 18463090.
- ^ Abgent, společnost WuXi App Tec. Program analýzy SUMOplotTM. 2013. http://www.abgent.com/tools
- ^ A b Matunis MJ, Coutavas E, Blobel G (prosinec 1996). „Nová modifikace podobná ubikvitinu moduluje rozdělení proteinu RanGAP1 aktivujícího Ran-GTPázu mezi cytosol a komplex jaderných pórů“. The Journal of Cell Biology. 135 (6 Pt 1): 1457–70. doi:10.1083 / jcb.135.6.1457. PMC 2133973. PMID 8978815.
- ^ Hyun YL, Lew DB, Park SH, Kim CW, Paik WK, Kim S (červen 2000). „Enzymatická methylace arginylových zbytků v -gly-arg-gly-peptidech“. The Biochemical Journal. 348 (3): 573–8. doi:10.1042/0264-6021:3480573. PMC 1221099. PMID 10839988.
- ^ Bedford MT, Clarke SG (leden 2009). „Methylace proteinu a argininu u savců: kdo, co a proč“ (PDF). Molekulární buňka. 33 (1): 1–13. doi:10.1016 / j.molcel.2008.12.013. PMC 3372459. PMID 19150423.
- ^ PELE (BPS, D_R, DSC, GGR, GOR, G_G, H_K, K_S, L_G, Q_S, JOI). SDSC Workbench. Správní rada University of Illinois, 1999.
- ^ Kelley LA, Sternberg MJ (2009). „Predikce proteinové struktury na webu: případová studie využívající server Phyre“ (PDF). Přírodní protokoly. 4 (3): 363–71. doi:10.1038 / nprot.2009.2. hdl:10044/1/18157. PMID 19247286. S2CID 12497300.
- ^ Fu SC, Imai K, Horton P (září 2011). „Predikce exportního signálu nukleárního bohatého na leucin obsahující proteiny s NESsential“. Výzkum nukleových kyselin. 39 (16): e111. doi:10.1093 / nar / gkr493. PMC 3167595. PMID 21705415.
- ^ Timmers AC, Stuger R, Schaap PJ, van 't Riet J, Raué HA (červen 1999). „Nukleární a nukleolární lokalizace ribosomálních proteinů Saccharomyces cerevisiae S22 a S25“. FEBS Dopisy. 452 (3): 335–40. doi:10.1016 / s0014-5793 (99) 00669-9. PMID 10386617. S2CID 1933493.
- ^ Altschul SF, Madden TL, Schäffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ (září 1997). „Gapped BLAST and PSI-BLAST: a new generation of protein database search programs“. Výzkum nukleových kyselin. 25 (17): 3389–402. doi:10.1093 / nar / 25.17.3389. PMC 146917. PMID 9254694.
- ^ Přepis GXT_2827489. Software Genomatix. 2014. http://www.genomatix.de/cgi-bin/[trvalý mrtvý odkaz ]/eldorado/eldorado.pl?s=2ab9d4751cbd873358acdd746c629f61;TRANS=1;TRANSCRIPTID=2827489;ELDORADO_VERSION=E28R1306
- ^ GXP_90934. Software Genomatix. 2014. http://www.genomatix.de/cgi-bin/[trvalý mrtvý odkaz ]/eldorado/eldorado.pl?s=99a7e4da5d3118fa8a93fb9a283d710f;PROM_ID=GXP_90934;GROUP=vertebrates;GROUP=others;ELDORADO_VERSION=E28R1306
- ^ A b National Center for Biotechnology Information, US National Library of Medicine. Profily Gene Expression Omnibus (GEO). "Rozsáhlá analýza lidského transkriptomu (HG-U133A)". https://www.ncbi.nlm.nih.gov/geo/tools/profileGraph.cgi?ID=GDS596:212333_at
- ^ „Homo sapiens komplex lokus FAM98A, kódující rodina se sekvenční podobností 98, člen A.“ AceView. NCBI.
- ^ Kiraga J, Mackiewicz P, Mackiewicz D, Kowalczuk M, Biecek P, Polak N, Smolarczyk K, Dudek MR, Cebrat S (červen 2007). „Vztahy mezi izoelektrickým bodem a: délkou proteinů, taxonomií a ekologií organismů“. BMC Genomics. 8: 163. doi:10.1186/1471-2164-8-163. PMC 1905920. PMID 17565672.
- ^ Program Dr. Luca Toldo, vyvinutý v http://www.embl-heidelberg.de. Změněno Bjoernem Kindlerem, aby se vytiskl také nejnižší nalezený čistý poplatek. K dispozici na EMBL WWW Gateway to Isoelectric Point Service „Archivovaná kopie“. Archivovány od originál dne 2008-10-26. Citováno 2014-05-10.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Řetězec 9.1. FAM98A. http://string-db.org/newstring_cgi/show_network_section.pl
- ^ "DEAD (Asp-Glu-Ala-Asp) Box Helicase 1". Genové karty.
- ^ „Otevřený čtecí rámeček chromozomu 14 166“. Genové karty.
- ^ "Protein vázající RNA 25". Genové karty.
- ^ A b Thalacker-Mercer AE, Fleet JC, Craig BA, Campbell WW (listopad 2010). „Profil transkriptu kosterního svalstva odráží akomodační reakce na nedostatečný příjem bílkovin u mladších a starších mužů.“. The Journal of Nutritional Biochemistry. 21 (11): 1076–82. doi:10.1016 / j.jnutbio.2009.09.004. PMC 2891367. PMID 20149619.
- ^ „Exportní faktor Aly / REF“. Genové karty.
- ^ Yang HC, Liang YJ, Wu YL, Chung CM, Chiang KM, Ho HY, Ting CT, Lin TH, Sheu SH, Tsai WC, Chen JH, Leu HB, Yin WH, Chiu TY, Chen CI, Fann CS, Wu JY , Lin TN, Lin SJ, Chen YT, Chen JW, Pan WH (2009). „Celá asociační studie genomu mladé hypertenze u čínské populace Han na Tchaj-wanu“. PLOS ONE. 4 (5): e5459. doi:10,1371 / journal.pone.0005459. PMC 2674219. PMID 19421330.




