Erytrogenní toxin - Erythrogenic toxin
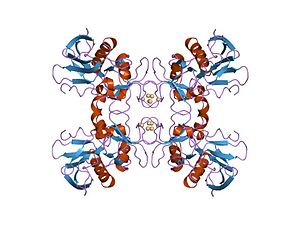
Erytrogenní toxiny, označovaný také jako streptokokový pyrogenní exotoxiny, jsou vylučovány kmeny bakterie Streptococcus pyogenes.[1][2] SpeA a speC jsou superantigeny, které nespecificky aktivují zánět T buňky a stimulace produkce zánětlivých cytokiny.[3] SpeB, nejhojnější streptokokový extracelulární protein, je a cysteinová proteáza.[4][5] Pyrogenní exotoxiny jsou implikovány jako původce spála a syndrom streptokokového toxického šoku.[2] O přesném počtu pyrogenních exotoxinů neexistuje shoda. Sérotypy AC[je zapotřebí objasnění ] jsou nejvíce studovány a uznávány všemi zdroji, ale jiní zaznamenávají až třináct odlišných typů, kategorizujících speF prostřednictvím speM jako další superantigeny.[1][2][6][7]
Je známo, že erythrogenní toxiny poškozují plazmatické membrány krevních kapilár pod kůží a vytvářejí červenou kožní vyrážku (charakteristickou pro spálu).[8] Předchozí studie ukázaly, že může být produkováno více variant erytrogenních toxinů, v závislosti na kmenu S. pyogenes v otázce. Některé kmeny nemusí vůbec produkovat zjistitelný toxin.[9] Bakteriofág T12 infekce S. pyogenes umožňuje produkci speA a zvyšuje virulenci.[10]
Dějiny
Objev a nomenklatura
SpeB byl identifikován v roce 1919 jako ektoenzym vylučovaný určitými kmeny streptokoků.[11] Původně byl studován jako dva samostatné toxiny, streptokokový pyrogenní exotoxin B a streptokoková cysteinová proteináza, dokud nebylo prokázáno, že oba proteiny byly kódovány SpeB gen a že přisuzované pyrogenní aktivity byly způsobeny kontaminací SpeA a SpeC.[12]
Pyrogenní, v streptokokový pyrogenní exotoxin, znamená „způsobuje horečku“.[13] Erytrogenní odkazuje na typickou červenou vyrážku spálu. Ve starší literatuře jsou tyto toxiny označovány také jako toxiny scarlatiny nebo toxiny spálu kvůli jejich roli jako původců choroby.[2]
SpeB je známý jako streptokokový pyrogenní exotoxin B, streptopain a streptokoková cysteinová proteináza v důsledku své původní nesprávné identifikace jako dvou samostatných toxinů a není ani exotoxin, ani pyrogenní.[12]
Struktura
Umístění genů
The SpeB a speJ geny se nacházejí v jádru bakteriálního chromozomu všech kmenů S. pyogenes.[3][14] Navzdory své přítomnosti a vysokým úrovním ochrany v nukleotidové sekvenci však 25-40% těchto kmenů neexprimuje toxin SpeB ve významných množstvích.[14]
V porovnání, speA, speC a speH-M jsou kódovány pomocí bakteriofágy.[3][15]
Neexistuje shoda ohledně umístění speG gen, který byl přičítán jak jádrovému chromozomu, tak lysogenním fágům.[1]
Struktura bílkovin

SpeB je protein 28 kDa se třemi hlavními formami, mSpeB1, mSpeB2 a mSpeB3, které jsou kategorizovány variacemi primární aminokyselinové sekvence.[4] Tři aminokyseliny, C192, H340 a W357, jsou životně důležité pro enzymatickou aktivitu ve všech variantách.[11] Toxin obsahuje kanonický papain podobná doména a mSpeB2 má dalšího člověka integrin vazebná doména.[4][11]
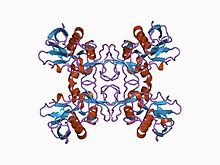
Všechny superantigenní streptokokové pyrogenní exotoxiny obsahují dvě hlavní konzervované proteinové domény, které jsou spojeny a-šroubovicí, které se skládají z aminoterminálního oligosokaridového / oligonukleotidového vazebného ohybu a karboxyterminální β-uchopovací domény, stejně jako dodekapeptidové vazebné oblasti. SpeA má také cystinovou smyčku, vazebné místo MHC II s nízkou afinitou a-řetězce a vazebné místo Vp-TCR. SpeC, SpeG, SpeH a SpeJ obsahuje Zn2+-závislé vazebné místo MHC II s vysokým p-řetězcem kromě místa s nízkou afinitou přítomného ve SpeA a postrádá cystinovou smyčku. SpeH má také další smyčku a3-β8, která zprostředkovává specificitu vazebného místa Vp-TCR toxinu.[2]
Zpracování a regulace
The SpeB Gen kóduje aminokyselinovou sekvenci, která se stane 40 kDa zymogen, známý jako SpeBz, po štěpení signální sekvence.[11] SpeBz prochází autokatalýza prostřednictvím alespoň osmi meziproduktů k vytvoření SpeBm 28 kDa. Nakonec cystin-192 a histidin-340 tvoří katalytický dyad.[4][5] Každý krok je přísně regulován několika faktory, což umožňuje sofistikovanou časovou expresi zralé proteinázy.[11]
Mechanismy působení
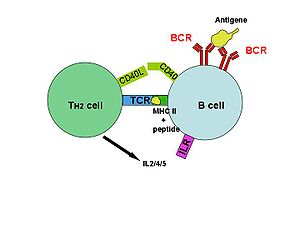

SpeA a speC
SpeA a SpeC se vážou MHC třídy II molekuly, jsou prezentovány T buňkám a váží se na variabilní oblast beta řetězce receptorů T buněk.[3] Po aktivaci uvolňují T buňky prozánětlivé cytokiny a chemokiny.[1] Interakce s TCR se vyznačují nízkou afinitou a rychlou disociací, což umožňuje toxinu aktivovat více T buněk za sebou.[7] Nedostatek specificity umožňuje aktivaci až 50% T buněk v těle.[6]
SpeB
SpeB štěpí degradací více proteinů hydrolýzou, včetně cytokinů, proteinů extracelulární matrix a imunoglobulinu.[12] Vyžaduje tři aminokyseliny před místem štěpení, známé jako P1, P2 a P3. Z nich má SpeB přednost hydrofobním zbytkům P2 a pozitivně nabitým zbytkům P1, přičemž větší důležitost má aminokyselina P2.[5][11]
Role virulence, patogeneze a infekce
SpeB
Streptokoková cysteinová proteináza má roli v imunitní úniku a apoptóze, stejně jako v potenciálním vlivu na internalizaci bakterií. Existují protichůdné důkazy týkající se účinku SpeB na virulenci. Některé studie uvádějí zvýšené hladiny proteáz u kmenů, které způsobují spálu ve srovnání s těmi spojenými se syndromem streptokokového toxického šoku, zatímco jiné vykazují sníženou expresi u virulentnějších kmenů.[4]
SpeB degraduje imunoglobuliny a cytokiny, stejně jako štěpením C3b, čímž inhibuje nábor fagocytujících buněk a cesta aktivace komplementu.[5] To má za následek snížení zánětu a hladiny neutrofilů v okolí místa infekce, prevenci clearance a fagocytózy a podporu přežití S. pyogenes.[4][5]
Toxin také indukuje apoptóza v hostitelských buňkách po internalizaci GAS. Důkazy naznačují, že k tomu může dojít prostřednictvím cest vnější a vnitřní kaspázy. Do tohoto procesu byla zahrnuta vazebná dráha pro receptor a apoptotická signální dráha zprostředkovaná Fas.[4] Indukce apoptózy vede k nekrotizující fasciitidě.
Reference
- ^ A b C d Brosnahan, A.J .; Schlievert, P.M. (Prosinec 2011). „Grampozitivní bakteriální superantigen signalizace zvenčí způsobuje syndrom toxického šoku: Superantigen signalizace zvenčí. FEBS Journal. 278 (23): 4649–67. doi:10.1111 / j.1742-4658.2011.08151.x. PMC 3165073. PMID 21535475.
- ^ A b C d E Spaulding, A.R .; Salgado-Pabon, W .; Kohler, P.L .; Horswill, A.R .; Leung, D.Y.M .; Schlievert, P.M. (2013). "Stafylokokové a streptokokové superantigenové exotoxiny". Recenze klinické mikrobiologie. 26 (3): 422–47. doi:10.1128 / CMR.00104-12. PMC 3719495. PMID 23824366.
- ^ A b C d Llewelyn, M .; Cohen, J. (březen 2002). "Superantigeny: mikrobiální látky, které narušují imunitu". Infekční nemoci Lancet. 2 (3): 156–62. doi:10.1016 / s1473-3099 (02) 00222-0. PMID 11944185.
- ^ A b C d E F G Chiang-Ni, C .; Wu, J.-J (2008). "Účinky streptokokového pyrogenního exotoxinu B na patogenezi Streptococcus pyogenes". Journal of the Formosan Medical Association. 107 (9): 677–85. doi:10.1016 / S0929-6646 (08) 60112-6. PMID 18796357.
- ^ A b C d E Nelson, Daniel C .; Garbe, Julia; Collin, Mattias (2011). „Cysteinová proteináza SpeB ze Streptococcus pyogenes - silný modifikátor imunologicky důležitých hostitelských a bakteriálních proteinů“. Biologická chemie. 392 (12): 1077–88. doi:10.1515 / př. 2011.208. PMID 22050223.
- ^ A b Brosnahan, Amanda J .; Schlievert, Patrick M. (01.12.2011). „Grampozitivní bakteriální superantigen signalizace zvenčí způsobuje syndrom toxického šoku“. FEBS Journal. 278 (23): 4649–4667. doi:10.1111 / j.1742-4658.2011.08151.x. ISSN 1742-4658. PMC 3165073. PMID 21535475.
- ^ A b Hongmin Li; Andrea Llera; Emilio L. Malchiodi; Roy A. Mariuzza (1999). "Strukturální základ aktivace T buněk superantigeny". Výroční přehled imunologie. 17 (1): 435–466. doi:10.1146 / annurev.immunol.17.1.435. PMID 10358765.
- ^ Tortora, Gerard; Funke, Berdell; Case, Christine (2013). Mikrobiologie (11. vydání). Pearson. str. 439.
- ^ Knöll H, Srámek J, Vrbová K, Gerlach D, Reichardt W, Köhler W (prosinec 1991). „Šarlach a typy erytrogenních toxinů produkovaných infikujícími streptokokovými kmeny“. Zentralbl Bakteriol. 276 (1): 94–106. doi:10.1016 / s0934-8840 (11) 80223-9. PMID 1789905.
- ^ McShan, WM; Tang, YF; Ferretti, JJ (1997). „Bakteriofág T12 Streptococcus pyogenes se integruje do genu kódujícího serinovou tRNA“. Molekulární mikrobiologie. 23 (4): 719–28. doi:10.1046 / j.1365-2958.1997.2591616.x. PMID 9157243.
- ^ A b C d E F Carroll, Ronan K .; Musser, James M. (01.08.2011). „Od transkripce k aktivaci: jak streptokok skupiny A, masožravý patogen, reguluje produkci cysteinové proteázy SpeB“. Molekulární mikrobiologie. 81 (3): 588–601. doi:10.1111 / j.1365-2958.2011.07709.x. ISSN 1365-2958. PMID 21707787.
- ^ A b C Nelson, Daniel C .; Garbe, Julia; Collin, Mattias (01.12.2011). „Cysteinová proteináza SpeB ze Streptococcus pyogenes - silný modifikátor imunologicky důležitých hostitelských a bakteriálních proteinů“. Biologická chemie. 392 (12): 1077–1088. doi:10.1515 / BC.2011.208. ISSN 1437-4315. PMID 22050223.
- ^ „Pyrogen (definice)“. Svobodný slovník.
- ^ A b Chiang-Ni, Chuan; Wu, Jiunn-Jong (2008). "Účinky streptokokového pyrogenního exotoxinu B na patogenezi Streptococcus pyogenes". Journal of the Formosan Medical Association. 107 (9): 677–685. doi:10.1016 / s0929-6646 (08) 60112-6. PMID 18796357.
- ^ Boyd, E. Fidelma (2012). Szybalski, Małgorzata Łobocka a Wacław T. (ed.). Kapitola 4 - Faktory bakteriální virulence kódované bakteriofágy a interakce ostrovů fág – patogenita. Pokroky ve výzkumu virů. Bakteriofágy, část A. 82. str. 91–118. doi:10.1016 / b978-0-12-394621-8.00014-5. ISBN 9780123946218. PMID 22420852.
externí odkazy
 Média související s Erytrogenní toxin na Wikimedia Commons
Média související s Erytrogenní toxin na Wikimedia Commons- Todarova online učebnice bakteriologie
- Streptokokový pyrogenní exotoxin A1
