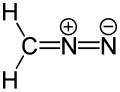
Dipolární sloučenina - Dipolar compound
Příklad dipolární sloučeniny představované a rezonanční struktura (isokyanid )
v organická chemie, a dipolární sloučenina nebo jednoduše dipól je elektricky neutrální molekula nesoucí kladný a záporný náboj v alespoň jednom kanonickém popisu. Ve většině dipolárních sloučenin jsou náboje přemístěn.[1]Na rozdíl od soli, dipolární sloučeniny mají náboje na samostatných atomech, ne na kladných a záporných ionty které tvoří sloučeninu. Dipolární sloučeniny vykazují a dipólový moment.
Dipolární sloučeniny mohou být reprezentovány a rezonanční struktura. Přispívající struktury obsahující nabité atomy jsou označeny jako zwitterions. [2][3][4][5][6]Některé dipolární sloučeniny mohou mít nenabitou kanonickou formu.
Druhy dipolárních sloučenin
- 1,2-dipolární sloučeniny mají opačné náboje na sousedních atomech.
- 1,3-dipolární sloučeniny mají náboje rozdělené na tři atomy.[1] Jsou to reaktanty 1,3-dipolární cykloadice.
- Také 1,4-dipoláře,[4] 1,5-dipoláře atd. Existují.
Příklady
Viz také
Reference
- ^ A b IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “dipolární sloučeniny ". doi:10.1351 / zlatá kniha D01753
- ^ Braida a kol .: Jasná korelace mezi diradickým charakterem 1,3-dipólů a jejich reaktivitou vůči ethylenu nebo acetylenu.; J. Am. Chem. Soc .; 2010 Červen 9; 132 (22): 7631-7
- ^ Hartmann a Heuschmann: Izolace zwitterionu v reakci Diels-Alder s inverzní elektronovou poptávkou; Angewandte Chemie; září 1989; Svazek 28, číslo 9, strany 1267–1268
- ^ A b MacHiguchi, Takahisa; Okamoto, Junko; Takachi, Junpei; Hasegawa, Toshio; Yamabe, Shinichi; Minato, Tsutomu (2003). „Exkluzivní tvorba α-methylenoxetanů v cykloadicích keten-alken. Důkazy pro intervenci jak α-methylenoxetanu, tak i následného 1,4-zwitterionu“. Journal of the American Chemical Society. 125 (47): 14446–8. doi:10.1021 / ja030191g. PMID 14624592.
- ^ IUPAC: Upřednostňováno IUPAC Jména; Kapitola 7, září 2004, s. 56-70
- ^ Rolf Huisgen (IUPAC): Cykloadiční mechanismus a závislost rychlosti na rozpouštědle; Pure Appl. Chem .; 1980, sv. 52, str. 2283–2302.

![{ displaystyle { ce {[R - { overset { oplus} {N}} { equiv} { overset { ominus} {C}} {:} <-> R - { ddot {N} } = C {:}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5755177ecf83528cc710550d28d4727f06d6f8f0)