Decamethylsilicocene - Decamethylsilicocene
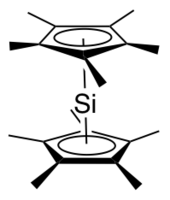
Decamethylsilicocene, (C.5Mě5)2Si, je skupina 14 sendvičová směs. Je to příklad a hlavní skupina cyklopentadienylový komplex; tyto molekuly jsou příbuzné metaloceny ale obsahují prvky p-bloku jako centrální atom. Je to bezbarvá, na vzduch citlivá pevná látka, která sublimuje ve vakuu.[1]
Syntéza
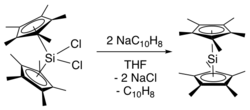
První syntéza dekamethylsilicocenu byla uvedena Jutzi a spolupracovníky.[2] Jednalo se o redukci dichloridu bis (pentamethylcyklopentadienyl) křemíku (IV) dvěma ekvivalenty naftalenid sodný za vzniku dekametylsilikocenu, naftalenu a chloridu sodného. Výroba stericky přeplněného bis (pentamethylcyklopentadienyl) křemíku (IV) dichloridu vyžadovala několik kroků, počínaje dvojitou deprotonací (C5Mě4H)2SiCl2 použitím tert-butyllithium, následované zpracováním výsledného (C5Mě4Li)2SiCl2 s methyljodidem.[3]
Decamethylsilicocene je rozpustný v aprotická rozpouštědla jako hexan, benzen, a chlorovaná rozpouštědla. Stanovení molekulové hmotnosti ukázat, že dekamethylsilicocen existuje jako monomer v benzenu. The 1H NMR spektrum ukazuje jeden ostrý signál a 13C-{1H} ukazuje dva signály, jeden pro kruhové uhlíky a jeden pro uhlíky methylové skupiny, v souladu s navrhovanou průměrnou pětinásobnou symetrickou strukturou v roztoku a η5 koordinace pentamethylcyklopentadienylových skupin.[2]
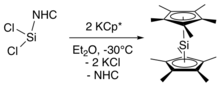
Nedávná syntéza přímo tvoří dekametylsilikocen přes metathesi soli z an N-heterocyklický karben -stabilizovaný silylen.[4] Tato syntetická cesta se vyhýbá syntéze výchozího materiálu bis (pentamethylcyklopentadienyl) křemíku (IV). V této syntéze je NHC stabilizovaný silylen (NHC = C [N- (C
6H
3–2,6–iPr
2) CH]
2) byla zpracována s draselnou solí dekamethylcyklopentadienu při -30 ° C (-22 ° F), následovala extrakce dekametylsilikocenu do hexanu při -60 ° C (-76 ° F), aby se odstranily vedlejší produkty NHC a KCI.
Struktura a lepení
The rentgenové krystalograficky Stanovená struktura dekamethylsilicocenu obsahuje dva izomery v poměru 2: 1.[2][1] Hlavní izomer přijímá Cs geometrie připomínající a ohnutý metalocen, přičemž cyklopentadienylové roviny tvoří úhel asi 25 ° a methylové skupiny se potácejí. V tomto izomeru je osamocený pár na křemíku popsán jako stereochemicky aktivní a vzdálenost od atomu křemíku ke každému těžišti Cp * je 2,12 Á. Menší izomer přijímá D.5 d geometrie, stejná jako dekametylferrocen s cyklopentadienylovými kruhy navzájem rovnoběžnými a methylové skupiny se potácely. Vzdálenost od atomu křemíku ke každému těžišti Cp * je 2,11 Å. Předpokládá se, že přítomnost dvou izomerů je způsobena balicími účinky.[2]
Výpočtové studie provedené na mateřském silikonenu (C5H5)2Si, odhalí velmi malou (~ 4 kJ / mol) energetickou změnu po zkreslení molekuly z D5 d geometrie buď na C2v (ohnuté, atomy vodíku zastíněny) nebo Cs (ohnuté, atomy vodíku rozložené) geometrie.[5] Kvalitativní molekulární orbitální diagram předpovídá, že HOMO by měl křemíkový (3s) -cyklopentadienylový antibondovací charakter a LUMO bude mít křemíkový (3p) -cyklopentadienylový protivazný charakter.[5] Výpočty NBO jsou v souladu s předpovědi z kvalitativního molekulárního orbitálního diagramu, ukazující antibondingový charakter mezi křemíkovými a cyklopentadienylovými ligandy jak v HOMO, tak v LUMO. Vypočtené počty valenčních NBO valenčních okupací naznačují, že mezi cyklopentadienylovými ligandy a křemíkovými 3s, 3px a 3py orbitaly dochází k významné vazbě.[5]
Ve srovnání s karcenovým kongenerem se křemík počítá tak, že se silněji váže na cyklopentadienylové ligandy kvůli většímu radiálnímu prodloužení 3p orbitalů ve srovnání s 2p orbitály. Energetická separace mezi orbitály 3s a 3p je navíc větší než pro orbitaly 2s a 2p, což vede k menšímu rozměru, což snižuje příznivost zkreslení na geometrii silylenu, ve které je každý cyklopentadienylový ligand vázán1 k atomu křemíku.[5] Atomy v molekulách (AIM) výpočty jsou v souladu s tímto pohledem. Graf laplacianské hustoty elektronů mezi centrálním atomem křemíku a jedním cyklopentadienylovým uhlíkem ukazuje menší lokalizaci náboje směrem k centrálnímu atomu ve srovnání s ekvivalentními výpočty pro karbocen.[5]
Reaktivita
Decamethylsilicocene reaguje s aldehydy a ketony za vzniku produktů s centrálním atomem křemíku (IV) a vazbou uhlík-uhlík vytvořenou mezi dvěma ekvivalenty aldehydu nebo ketonu. Dva výsledné alkoxidy jsou koordinovány s atomem křemíku za vzniku pětičlenného kruhu.[6] Koordinace cyklopentadienylového kruhu se mění z η5 do η1 v průběhu těchto reakcí
Podobné změny v haptičnosti pentamethylcyklopentadientylových kruhů nastávají, když dekametylsilikocen reaguje s trojnými vazbami uhlík-dusík. U organických kyanátů a thiokyanátů dochází k tvorbě vazby uhlík-uhlík a výsledný organický fragment je koordinován na atom křemíku prostřednictvím dvou aniontových dusíků.[7] Decamethylsilicocene reaguje s anorganickými kyanidy, jako je BrCN a (Mě
3Si) CN oxidativním přidáním za vzniku produktu křemíku (IV) s kyanidovým ligandem spolu s Br nebo Me3Si ligand.
Decamethylsilicocene lze protonovat pomocí silných kyselin, jako jsou [HOEt
2][PŘED NAŠÍM LETOPOČTEM
6F
5)
4]. Po protonaci se eliminuje jeden ekvivalent pentamethylcyklopentadienu za vzniku kationu pentamethylsilikonu (II) s [PŘED NAŠÍM LETOPOČTEM
6F
5)
4]−
.[4]
Kation pentamethylcyklopentadienylsilikonu (II) reaguje s řadou cyklopentadienylových solí za vzniku substituovaných silikonů. Silikocenové deriváty syntetizované tímto způsobem zahrnují (Me5C5) ((i-Pr)5C5) Si, ((já5C5) (1,3,4-Me3H2C5) Si a (já5C5) (H5C5) Si.[8] Druhá sloučenina je stabilní při -50 ° C (-58 ° F), ale začíná se rozkládat při -30 ° C (-22 ° F). Navíc může kationt pentamethylcyklopentadienylsilikonu (II) reagovat s prekurzory kovů za vzniku komplexů s vícenásobnými vazbami kov-křemík.[4]
Reference
- ^ A b Jutzi, Peter; Holtmann, Udo; Kanne, Dieter; Krüger, Carl; Blom, Richard; Gleiter, Rolf; Hyla-Kryspin, Isabella (01.09.1989). „Decamethylsilicocene - první stabilní sloučenina křemíku (II): Syntéza, struktura a vazba“. Chemische Berichte. 122 (9): 1629–1639. doi:10.1002 / cber.19891220906. ISSN 1099-0682.
- ^ A b C d Jutzi, Peter; Kanne, Dieter; Krüger, Carl (01.02.1986). „Decamethylsilicocene - syntéza a struktura“. Angewandte Chemie International Edition v angličtině. 25 (2): 164. doi:10,1002 / anie.198601641. ISSN 1521-3773.
- ^ Jutzi, Peter; Kanne, Dieter; Hursthouse, Mike; Howes, Andrew J. (01.07.1988). „Mono- und Bis (η1-pentamethylcyklopentadienyl) silan - Synthese, Struktur und Eigenschaften“. Chemische Berichte. 121 (7): 1299–1305. doi:10.1002 / cber.19881210714. ISSN 1099-0682.
- ^ A b C Ghana, Priyabrata; Arz, Marius I .; Schnakenburg, Gregor; Straßmann, Martin; Filippou, Alexander C. (2017-10-19). „Metal – Silicon Triple Bonds: Access to [Si (η5-C5Me5)] + from SiX2 (NHC) and its Conversion to the Silylidyne Complex [TpMe (CO) 2MoSi (η3-C5Me5)] (TpMe = κ3-N, N ', N "-hydridotris (3,5-dimethyl-l-pyrazolyl) borát)". Organometallics. 37 (5): 772–780. doi:10.1021 / acs.organomet.7b00665. ISSN 0276-7333.
- ^ A b C d E Schoeller, Wolfgang W .; Friedrich, Oliver; Sundermann, Andreas; Rozhenko, Alexander (01.05.1999). „Geometric and Electronic Structure of Carbocene, (C5R5) 2C, versus Silicocene, (C5R5) 2Si (R = H, Me)“. Organometallics. 18 (11): 2099–2106. doi:10.1021 / om980737l. ISSN 0276-7333.
- ^ Jutzi, Peter; Eikenberg, Dirk; Bunte, Ernst-August; Möhrke, Andreas; Neumann, Beate; Stammler, Hans-Georg (04.02.1996). „Decamethylsilicocene Chemistry: Reaction with Representative Aldehydes and Ketones“. Organometallics. 15 (7): 1930–1934. doi:10,1021 / om950897m. ISSN 0276-7333.
- ^ Jutzi, Peter; Eikenberg, Dirk; Neumann, Beate; Stammler, Hans-Georg (1996-08-20). „Decamethylsilicocene Chemistry: Reaction with Carbon-Nitrogen Triple-Bond Species“. Organometallics. 15 (17): 3659–3663. doi:10.1021 / om960338v. ISSN 0276-7333.
- ^ Jutzi, Peter (2014-07-21). „Pentamethylcyklopentadienylsilicon (II) Cation: Synthesis, Characterization, and Reactivity“. Chemistry - A European Journal. 20 (30): 9192–9207. doi:10.1002 / chem.201402163. ISSN 1521-3765. PMID 24986115.
