Cykloparafenylen - Cycloparaphenylene


A cykloparafenylen je molekula, která se skládá z několika benzenové kruhy spojeny kovalentními vazbami v odst pozice pro vytvoření struktury podobné obruči nebo náhrdelníku. Své chemický vzorec je [C
6H
4]
n nebo C
6nH
4n Taková molekula se obvykle označuje [n] CPP kde n je počet benzenových kruhů.
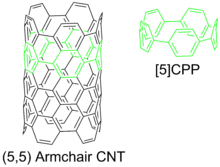
Cykloparafenylen lze považovat za nejmenší možné křeslo uhlíková nanotrubice, a je typem uhlíkový nanohoop.[2] Cykloparafenyleny jsou náročným cílem chemická syntéza v důsledku napětí v kruhu vzniklé vytlačováním benzenových kruhů z rovnosti.
Dějiny
V roce 1934 by V. C. Parekh a P. C. Guha popsal první publikovaný pokus syntetizovat cykloparafenylen, konkrétně [2] CPP. Spojili dva aromatické kruhy s a sulfidový můstek, a doufali, že jejich odstraněním se získá požadovaná sloučenina. Pokus však selhal, protože sloučenina by byla příliš napjatá, než aby existovala za všech okolností, kromě extrémních podmínek.[3]

Do roku 1993 se Fritz Vögtle pokusil syntetizovat méně namáhané [6] CPP a [8] CPP stejným způsobem. Vyrobil obruč fenylové kruhy, přemostěné dohromady atomem síry. Jeho pokusy o odstranění síry však selhaly také. Také syntetizovali a makrocyklus že při dehydrogenaci by se získal CPP, ale nemohl provést tento poslední krok.[5][4]
V roce 2000 dospěli Chandrasekhar a další pomocí počítačové analýzy k závěru, že [5] CPP a [6] CPP by se měly výrazně lišit ve své aromatičnosti.[6] Syntéza [5] CPP v roce 2014 však tento závěr vyvrátila.[1][7][8][9]
V roce 2008 syntetizoval první cykloparafenyleny Ramesh Jasti během svého postdoktorandského výzkumu v laboratoři Carolyn Bertozzi. Použil cyklohexa-1,4-dienes které jsou v oxidačním stavu blíže k požadovanému fenylenu než cyklohexany, které dříve používal Vögtle. První cykloparafenyleny, které byly popsány a charakterizovány, byly: [9] CPP, [12] CPP a [18] CPP.[10] V roce 2009 Itami skupina uvedla selektivní syntézu [12] CPP a krátce nato společnost Yamago syntetizovala [8] CPP v roce 2010.[11][12] Skupina Jasti poté syntetizovala všechny stále menší CPP pomocí nové metodiky, která umožňovala [7] CPP,[13] [6] CPP,[14] a nakonec [5] CPP[1] být hlášeny v relativně rychlém sledu.
Vlastnosti
Struktura
Normální konfigurace každého fenylenového prvku by byla rovinná, přičemž vazby v para poloze směřovaly proti sobě v přímce. Proto je molekula cykloparafenylenu napnutá a kmen se zvyšuje se snižujícím se počtem jednotek. Deformační energie [5] CPP byla vypočtena jako 117,2 kcal / mol. Navzdory kmenu si fenylové kruhy zachovávají svůj aromatický charakter, dokonce i v [5] CPP.[1][15] Jak se však zmenšuje velikost CPP, zmenšuje se také mezera HOMO-LUMO. Tento trend je opačný k trendu pozorovanému u lineárních polyparafenyleny kde mezera HOMO-LUMO zmenšuje se zvětšováním velikosti.[9][12] To způsobí červený posun fluorescenční emise.[9]
Balení v pevné fázi
Cykloparafenyleny se 7 až 12 kruhy přijímají a rybí kost -jako balení v pevném stavu. Podobná, ale hustší struktura byla pozorována u [5] CPP, zatímco [6] CPP tvoří sloupce.[14] Tato sloupcová těsnicí struktura byla zajímavá kvůli potenciálně vysoké vnitřní povrchové ploše. Částečnou fluorací bylo zjištěno, že tato geometrie obalu může být navržena.[16]
Syntéza
Pro syntézu cykloparafenylenu se používají tři hlavní metody.
Suzuki Coupling of Curved Oligophenylene Precursors
V počáteční syntéze cykloparafenyleny s n = 9, 12 a 18 byly syntetizovány vycházející z makrocyklů obsahujících 1,4-syn-dimethoxy-2,5-cyklohexadienové jednotky jako maskované aromatické kruhy. Výměna lithium-halogen s p-diiobenzen následuje dvojí nukleofilní adice reakce s 1,4-benzochinon poskytla syn-cyklohexadienovou část. Borylace tohoto materiálu následovala makrocyklizace za Suzukiho-Miyuarovy křížové vazby s ekvivalentem dijodidu a vytvořila makrocykly v nízkých výtěžcích, které mohly být odděleny sloupcovou chromatografií. Tyto makrocykly pak byly redukčně aromatizovány za použití naftalenidu sodného, čímž se získal [n] cykloparafenyleny. Protože tato počáteční syntéza využívá symetrické stavební bloky, je náročné ji použít k výrobě menších CPP. Proto byl místo benzochinonu použit benzochinon monomethylketal, aby bylo možné použít asymetrické stavební bloky. Tato inovace umožnila selektivní syntézu [12] CPP až [5] CPP.[17]
[5] CPP je syntetizován s intramolekulárním boronátem homocoupling technika, která byla původně považována za nežádoucí vedlejší produkt křížových vazebných reakcí Suzuki-Miyaura při syntéze [10] CPP.[1][15]Cykloparafenyleny nyní mají selektivní, modulární a vysoce výnosné syntetické dráhy.
Redukční eliminace platinových makrocyklů
Rychlejší cesta k [8-13] CPP začíná selektivním budováním [8] CPP a [12] CPP z reakce 4,4'-bis (trimethylstannyl) bifenylu a 4,4 ′ ′ -bis (trimethylstannyl) terfenylu, respektive s Pt (treska) Cl2 (kde treska je 1,5-cyklooktadien ) prostřednictvím čtvercových meziproduktů tetranukleární platiny.[12] Směs [8-13] cykloparafenylenů lze získat v dobrých kombinovaných výtěžcích smícháním bifenyl a terfenyl prekurzory se zdroji platiny.[12]
Alkyne Cyclotrimerization
Třetí méně používaná metoda vyvinutá ve skupině Tanaka používá pro syntézu cykloparafenylenů rhodiem katalyzovanou alkynecyklotrimerizaci.[18]
Potenciální aplikace
Mezi potenciální aplikace cykloparafenylenů patří chemie hostitel – host,[10] semena pro uhlíková nanotrubice růst a hybrid nanostruktury obsahující substituenty nanohoopového typu.[19] Cykloparafenylen lze považovat za minimální jednostěnnou uhlíkovou nanotrubičku typu křesla. Cykloparafenylen jako takový může být semenem pro syntézu delších nanotrubiček.[10][12][20] Užitečné mohou být také jejich elektronické vlastnosti.[21][22]
Fullerenová vazba
Cykloparafenyleny prokázaly afinitu k fullerenům a dalším molekulám uhlíku,[10] s interakcemi podobnými těm v uhlíkové peapody. Potenciální aplikace těchto struktur zahrnují nanolasery, tranzistory s jedním elektronem, pole spin-qubit pro kvantové výpočty, nanopipety a zařízení pro ukládání dat.[23][24][25]
Konkrétně Interakce π-π a očekává se, že konkávní vnitřek cykloparafenylenů se váže na π konjugované systémy s konvexními povrchy, které se vejdou dovnitř kruhu. Ukázalo se, že [10] CPP selektivně váže a Fulleren C60 uvnitř jeho díry, čímž vzniká „molekulární ložisko“.[10] Fulleren zůstává v kruhu dostatečně dlouho, aby byl pozorován v časovém měřítku NMR.[26] Fluorescence [10] CPP se uhasí při komplexaci s C60, což naznačuje jeho potenciál jako senzoru C60.[10] V roce 2018 byla tato afinita využita k vytvoření CPP-fullerenu rotaxany.[27]
Bylo pozorováno, že takové interakce „koule v obruči“ jsou silnější endohedrální metalo-fullereny, ve kterém je kladně nabitý kovový ion zachycen uvnitř fullerenové klece a činí jej elektronegativnějším.[28][20] Konkrétně bylo zjištěno, že [12] CPP přednostně uzavírá metalo-fullereny místo „prázdných“ fullerenů, což snižuje jejich rozpustnost v toluen; který poskytuje pohodlnou separační metodu pro tyto dva druhy.[26]
Související sloučeniny
Jelikož se syntéza CPP stala jednodušší, začaly se syntetizovat také derivační struktury. V roce 2013 Itami skupina uvedla syntézu nanoklece vyrobené zcela z benzenových kruhů. Tato sloučenina byla obzvláště zajímavá, protože ji lze považovat za spojení rozvětvené struktury nanotrubiček.[29]
jiný chirální byly také charakterizovány deriváty cykloparafenylenů (které mohou sloužit jako chemické šablony pro syntézu chirálních nanotrubiček). Podobně jako původní (n, n) cykloparafenyleny vykazují tyto chirální nanoringy také neobvyklé optoelektronické vlastnosti s rostoucími excitačními energiemi v závislosti na velikosti; chirální nanorování (n + 3, n + 1) však vykazuje větší fotoindukované přechody ve srovnání s původními (n, n) cykloparafenyleny, což vede ke snadněji pozorovatelným optickým vlastnostem ve spektroskopických experimentech.[30]
V roce 2012 Jasti Skupina uvedla syntézu dimerů [8] CPP spojených arenovými můstky.[31] Po této syntéze následovala o dva roky později syntéza přímo připojeného dimeru [10] CPP z chloro [10] CPP pomocí Itami skupina.[32]
Funkcionalizace dárce-akceptor
CPP jsou jedinečné v tom, že jejich vlastnosti donor-akceptor lze upravit přidáním nebo odstraněním každého fenylového kruhu. V celokarbonových nano-obručích odpovídá zmenšení šířky vyšší HOMO a nižší LUMO. Další selektivita donor-akceptor byla pozorována přidáním aromatických heterocyklů do většího kruhu. N-methylaza [n] CPP ukázal, že snížení LUMO lze zvýšit zmenšením velikosti prstence, zatímco energetická hladina HOMO zůstala stejná.[33]
Reference
- ^ A b C d E Evans, Paul J .; Darzi, Evan R .; Jasti, Ramesh (květen 2014). „Efektivní syntéza vysoce napjatého uhlíkového nanohoop fragmentu buckminsterfullerenu při pokojové teplotě“. Přírodní chemie. 6 (5): 404–408. doi:10.1038 / nchem.1888. ISSN 1755-4349. PMID 24755591.
- ^ https://ipo.lbl.gov/lbnl2753/
- ^ Parekh, V.C .; Guha, P.C. (1934). "Syntéza p, p'-difenylen-disulfidu". Journal of Indian Chemical Society. 11: 95–100.
- ^ A b Friederich, Rolf; Nieger, Martin; Vögtle, Fritz (01.07.1993). „Auf dem Weg zu makrocyclischen para-Phenylenen (On the Way to Macrocyclic Paraphenylenes)“. Chemische Berichte. 126 (7): 1723–1732. doi:10.1002 / cber.19931260732. ISSN 1099-0682.
- ^ Miyahara, Yuji; Inazu, Takahiko; Yoshino, Tamotsu (1983). "Syntéza [1.1.1.1] paracylofanu". Čtyřstěn dopisy. 24 (47): 5277–5280. doi:10.1016 / s0040-4039 (00) 88416-6.
- ^ Jagadeesh, Mavinahalli N .; Makur, Anindita; Chandrasekhar, Jayaraman (02.02.2000). „Souhra úhlového namáhání a aromatičnosti: Molekulární a elektronické struktury [0n] paracyklofanů“ (PDF). Molekulární modelování výroční. 6 (2): 226–233. doi:10,1007 / s0089400060226. ISSN 0949-183X.
- ^ Bodwell, Graham J. (květen 2014). "Uzavření smyčky". Přírodní chemie. 6 (5): 383–385. doi:10.1038 / nchem.1932. ISSN 1755-4349. PMID 24755587.
- ^ Kayahara, Eiichi; Patel, Vijay Kumar; Yamago, Shigeru (12.02.2014). "Syntéza a charakterizace [5] cykloparafenylenu". Journal of the American Chemical Society. 136 (6): 2284–2287. doi:10.1021 / ja413214q. ISSN 0002-7863. PMID 24460371.
- ^ A b C Wong, Bryan M. (2009-12-31). „Optoelektronické vlastnosti uhlíkových nanoringů: excitační efekty z časově závislé funkční teorie hustoty“. The Journal of Physical Chemistry C. 113 (52): 21921–21927. doi:10.1021 / jp9074674. ISSN 1932-7447. PMC 3317592. PMID 22481999.
- ^ A b C d E F Iwamoto, Takahiro; Watanabe, Yoshiki; Sadahiro, Tatsuya; Haino, Takeharu; Yamago, Shigeru. „Velikostně selektivní zapouzdření C60 [10] cykloparafenylenem: vznik nejkratšího Fullerene-Peapodu“. Angewandte Chemie. 50 (36): 8342–8344. doi:10.1002 / anie.201102302. ISSN 1521-3773. PMID 21770005.
- ^ Yamago, Shigeru; Watanabe, Yoshiki; Iwamoto, Takahiro (18.01.2010). „Syntéza [8] cykloparafenylenu z čtvercového tetranukleárního komplexu platiny“. Angewandte Chemie International Edition. 49 (4): 757–759. doi:10.1002 / anie.200905659. ISSN 1521-3773. PMID 20014269.
- ^ A b C d E Iwamoto, Takahiro; Watanabe, Yoshiki; Sakamoto, Youichi; Suzuki, Toshiyasu; Yamago, Shigeru (01.06.2011). "Selektivní a náhodné syntézy [n] cykloparafenylenů (n = 8–13) a závislost velikosti na jejich elektronických vlastnostech". Journal of the American Chemical Society. 133 (21): 8354–8361. doi:10.1021 / ja2020668. ISSN 0002-7863. PMID 21542589.
- ^ Sisto, Thomas J .; Golder, Matthew R .; Hirst, Elizabeth S .; Jasti, Ramesh (2011). „Selektivní syntéza napjatého [7] cykloparafenylenu: oranžově emitující fluorofor“. Journal of the American Chemical Society. 133 (40): 15800–15802. doi:10.1021 / ja205606p. PMID 21913694.
- ^ A b Xia, Jianlong; Jasti, Ramesh (2012). "Syntéza, charakterizace a krystalová struktura [6] cykloparafenylenu". Angewandte Chemie International Edition. 51 (10): 2474–2476. doi:10,1002 / anie.201108167. ISSN 1521-3773. PMID 22287256.
- ^ A b Omachi, Haruka; Matsuura, Sanae; Segawa, Yasutomo; Itami, Kenichiro (2010-12-27). „Modulární a velikostně selektivní syntéza [n] cykloparafenylenů: krok k selektivní syntéze [n, n] jednostěnných uhlíkových nanotrubiček“. Angewandte Chemie International Edition. 49 (52): 10202–10205. doi:10,1002 / anie.201005734. ISSN 1521-3773. PMID 21105035.
- ^ Leonhardt, Erik J .; Van Raden, Jeff M .; Miller, David; Zakharov, Lev N .; Alemán, Benjamín; Jasti, Ramesh (2018). „Přístup zdola nahoru k atomově přesným grafickým válcům zpracovaným řešením na grafitu“. Nano dopisy. 18 (12): 7991–7997. doi:10,1021 / acs.nanolett.8b03979. PMID 30480454.
- ^ Darzi, Evan R .; Sisto, Thomas J .; Jasti, Ramesh (2012). „Selektivní syntézy [7] - [12] cykloparafenylenů pomocí ortogonálních Suzuki – Miyaura cross-Coupling Reactions“. The Journal of Organic Chemistry. 77 (15): 6624–6628. doi:10.1021 / jo3011667. PMID 22804729.
- ^ Hayase, Norihiko; Miyauchi, Yuta; Aida, Yukimasa; Sugiyama, Haruki; Uekusa, Hidehiro; Shibata, Yu; Tanaka, Ken (2017). "Syntéza [8] cykloparafenylen-oktakarboxylátů pomocí Rh-katalyzované postupné křížové Alkylovy cyklotrimerizace". Organické dopisy. 19 (11): 2993–2996. doi:10.1021 / acs.orglett.7b01231. PMID 28513181.
- ^ Li, Penghao; Zakharov, Lev N .; Jasti, Ramesh (02.05.2017). „Molekulární vrtule se třemi čepelemi nanohoopů: syntéza, charakterizace a obal v pevné fázi“. Angewandte Chemie International Edition. 56 (19): 5237–5241. doi:10.1002 / anie.201700935. ISSN 1521-3773. PMID 28374422.
- ^ A b Lewis, Simon E. (10.04.2015). „Cycloparaphenylenes and related nanohoops“. Recenze chemické společnosti. 44 (8): 2221–2304. doi:10,1039 / c4cs00366g. ISSN 1460-4744. PMID 25735813.
- ^ Golder, Matthew R .; Wong, Bryan M .; Jasti, Ramesh (2013-09-30). „Fotofyzikální a teoretické zkoumání [8] cykloparafenylenového radikálového kationu a jeho dimeru náboj-rezonance“. Chemická věda. 4 (11): 4285. doi:10.1039 / C3SC51861B. ISSN 2041-6539.
- ^ Zabula, Alexander V .; Filatov, Alexander S .; Xia, Jianlong; Jasti, Ramesh; Petrukhina, Marina A. (2013-05-03). "Utažení nanobeltu při redukci multielektronů". Angewandte Chemie International Edition. 52 (19): 5033–5036. doi:10,1002 / anie.201301226. ISSN 1521-3773. PMID 23564669.
- ^ Service, Robert F. (04.06.2001). "Nanotube 'Peapods' Show Elektrizující příslib". Věda. 292 (5514): 45. doi:10.1126 / science.292.5514.45. ISSN 0036-8075. PMID 11294210.
- ^ Kwon, Young-Kyun (1999). ""Bucky Shuttle „Paměťové zařízení: Syntetický přístup a simulace molekulární dynamiky“. Dopisy o fyzické kontrole. 82 (7): 1470–1473. doi:10.1103 / fyzrevlett.82.1470.
- ^ Utko, Pawel; Nygård, Jesper; Monthioux, Marc; Noé, Laure (2006). „Sub-Kelvinova transportní spektroskopie kvantových teček Fullerene Peapod“. Aplikovaná fyzikální písmena. 89 (23): 233118. doi:10.1063/1.2403909.
- ^ A b Matsuno, Taisuke; Kamata, Sho; Hitosugi, Shunpei; Isobe, Hiroyuki (02.07.2013). "Syntéza zdola nahoru a struktury tubulárních makrocyklů prodloužených o π". Chemická věda. 4 (8): 3179. doi:10.1039 / c3sc50645b. ISSN 2041-6539. S2CID 98409330.
- ^ Xu, Youzhi; Kaur, Ramandeep; Wang, Bingzhe; Minameyer, Martin; Gsänger, Sebastian; Meyer, Bernd; Drewello, Thomas; Guldi, Dirk; von Delius, Max (20. září 2018). „Konkávní – konvexní π – π přístup pomocí šablony umožňuje syntézu [10] cykloparafenylen – fullerenu [2] rotaxanů“. Journal of the American Chemical Society. 140 (41): 13413–20. doi:10.1021 / jacs.8b08244. PMID 30234982.
- ^ Iwamoto, Takahiro; Slanina, Zdeněk; Mizorogi, Naomi; Guo, Jingdong; Akasaka, Takeshi; Nagase, Shigeru; Takaya, Hikaru; Yasuda, Nobuhiro; Kato, Tatsuhisa (2014-10-27). „Částečný přenos náboje v nejkratším možném metalofullerenovém peapodu, La @ C82⊂ [11] Cycloparaphenylene“. Chemistry - A European Journal. 20 (44): 14403–14409. doi:10,1002 / chem.201403879. ISSN 1521-3765. PMID 25224281.
- ^ Matsui, Katsuma; Segawa, Yasutomo; Namikawa, Tomotaka; Kamada, Kenji; Itami, Kenichiro (2012-11-29). „Syntéza a vlastnosti celobenzenových uhlíkových nanoklecí: spojovací jednotka rozvětvených uhlíkových nanotrubiček“. Chem. Sci. 4 (1): 84–88. doi:10.1039 / c2sc21322b. ISSN 2041-6539.
- ^ Wong, Bryan M .; Lee, Jonathan W. (2011-11-03). „Anomální optoelektronické vlastnosti chirálních uhlíkových nanoringů ... a jeden prsten jim vládne všem“. The Journal of Physical Chemistry Letters. 2 (21): 2702–2706. doi:10.1021 / jz2012534. ISSN 1948-7185. PMC 4047598. PMID 24920994.
- ^ Xia, Jianlong; Golder, Matthew R .; Foster, Michael E .; Wong, Bryan M .; Jasti, Ramesh (2012-12-05). "Syntéza, charakterizace a výpočetní studie cykloparafenylenových dimerů". Journal of the American Chemical Society. 134 (48): 19709–19715. doi:10.1021 / ja307373r. ISSN 0002-7863. PMID 23130993.
- ^ Ishii, Yuuki; Matsuura, Sanae; Segawa, Yasutomo; Itami, Kenichiro (2014-04-18). "Syntéza a dimerizace chloro [10] cykloparafenylenu: přímo připojený cykloparafenylenový dimer". Organické dopisy. 16 (8): 2174–2176. doi:10.1021 / ol500643c. ISSN 1523-7060. PMID 24689496.
- ^ Van Raden, J. M .; Darzi, E. R .; Zakharov, L. N .; Jasti, R. (2016-06-15). "Syntéza a charakterizace vysoce napjatého dárce-akceptor nanohoopu". Organická a biomolekulární chemie. 14 (24): 5721–5727. doi:10.1039 / c6ob00133e. ISSN 1477-0539. PMID 26881906.
