Kombinovaná restrikční analýza hydrogensiřičitanu - Combined bisulfite restriction analysis - Wikipedia
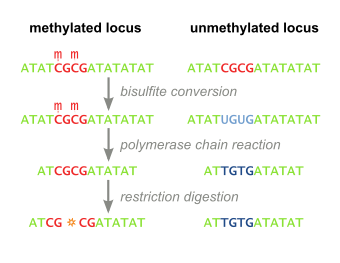
Kombinovaná analýza omezení bisulfitu (nebo KOBRA) je technika molekulární biologie, která umožňuje citlivou kvantifikaci Methylace DNA hladiny na konkrétním genomovém místě na a Sekvence DNA v malém vzorku genomové DNA.[1] Tato technika je variantou bisulfitové sekvenování a kombinuje konverze hydrogensiřičitanu na základě polymerázová řetězová reakce s omezené trávení. Původně vyvinut pro spolehlivé zpracování nepatrného množství genomové DNA z mikrodisekcí parafín - vložené vzorky tkáně, technika se od té doby rozšířila v výzkum rakoviny a epigenetika studie.[2]
Postup
Zpracování hydrogensiřičitanem
Genomická DNA, která nás zajímá, je ošetřena hydrogensiřičitan sodný, který zavádí rozdíly v sekvenci závislé na methylaci. Během zpracování hydrogensiřičitanem sodným, nemetylovaný cytosin zbytky se převádějí na uracil, zatímco methylovaný cytosin zbytky nejsou ovlivněny.

Amplifikace PCR

Bisulfitem ošetřená DNA je poté amplifikována pomocí PCR, což má za následek cytosinové zbytky v původně methylovaných pozicích a thyminové zbytky v původně nemetylované poloze (které byly převedeny na uracil). Primery použité během tohoto kroku neobsahují CpG stránky (společný cíl methylace cytosinu), takže proces amplifikace nediskriminuje šablony na základě stavu methylace. Produkty PCR jsou očištěno pro zajištění úplného trávení v následujícím kroku.
Omezení trávení
Výše uvedené kroky vedou k methylačně závislé retenci nebo ztrátě CpG obsahujícího místa restrikčních enzymů, jako jsou ty pro TaqI (TCGA) a BstUI (CGCG), v závislosti na tom, zda byl cytosinový zbytek původně methylován nebo ne. Díky amplifikaci nezávislé na methylaci ve výše uvedeném kroku budou výsledné produkty PCR smíšenou populací fragmentů, které ztratily nebo udržely místa restrikčních enzymů obsahujících CpG, jejichž příslušná procenta budou přímo korelována s původní úrovní methylace DNA v vzorek DNA.
Produkty PCR se poté zpracují restrikčním enzymem (např. BstUI), který štěpí pouze místa, která byla původně methylovaná (CGCG), zatímco ponechá místa, která byla původně nemetylovaná (TGTG). Aby se zajistilo, že všechna CpG místa zůstanou zachována kvůli původně methylovaným, a nikoli zbytku neúplné konverze hydrogensiřičitanu, provede se kontrolní digesce pomocí enzymů, jako je Hsp92II který rozpoznává sekvenci CATG, z nichž žádný by neměl zůstat po konverzi hydrogensiřičitanem (s výjimkou vzácné metylace jiné než CpG), a proto by nemělo dojít k štěpení, pokud by byla konverze hydrogensiřičitanu úplná.
Kvantifikace
Štěpené fragmenty jsou poté odděleny elektroforéza na polyakrylamidovém gelu s očekávaným výskytem pásů odpovídajících jednomu velkému nestrávenému fragmentu a několika menších pásů odpovídajících štěpeným fragmentům. Kvantitativní množství DNA v těchto pásech lze určit pomocí zařízení, jako je a fosfoimager, po kterém lze procento methylace původního vzorku vypočítat podle:
Použití a aplikace
COBRA se hojně používá v mnoha aplikacích založených na výzkumu, jako je screening změn methylace DNA při promotory genů ve studiích rakoviny,[3][4] detekce změněných methylačních vzorců v potištěné geny,[5] a charakterizace methylačních vzorců v genomu během vývoje u savců.[6][7]
V medicíně se COBRA používá jako nástroj k diagnostice lidských onemocnění zahrnujících aberantní metylaci DNA. Výzkumníci využili COBRA ve spojení s denaturační vysoce účinná kapalinová chromatografie v diagnostice genetický otisk porucha Russell-Silverův syndrom kde hypomethylace potištěného genu H19 je zodpovědný za poruchu až u 50% pacientů.[8]
Silné stránky
- Jednoduché, rychlé a levné: V COBRA jsou hladiny methylace DNA snadno a rychle měřeny bez nutnosti pracného subklonování a sekvenování, jako u bisulfitového sekvenování. Test je přímý a lze jej provést pomocí standardních levných činidel molekulární biologie.
- Vysoká kompatibilita: Vzhledem k krokům PCR a čištění metoda pracuje nejen s velmi malým množstvím genomové DNA, ale také se vzorky, které byly ošetřeny parafinem, což může být problémem v jiných protokolech kvantifikace DNA methylace, jako je například Southern blot a digesce restrikčních enzymů citlivých na methylaci následovaná PCR.
- Kvantitativní: To je v rozporu s methylačně specifická PCR, což je kvalitativní. Pomocí COBRA lze hladiny methylace DNA přímo kvantifikovat na daném místě, čímž se získá více informací na jeden test.
- Škálovatelnost pro vysoce výkonné zpracování vzorků: S COBRA lze mnoho oblastí zájmu zpracovat paralelně v samostatných vzorcích štěpených stejným restrikčním enzymem. To je v rozporu s bisulfitovou sekvenční analýzou, kde je třeba každou oblast pečlivě zkoumat sekvenováním mnoha klonů na lokus, což stojí více času.
- Více dotazů na test: Metylační stav může být vyšetřován na více restrikčních místech obsahujících CpG v jednom testu digesce.
Slabé stránky
- Test je omezeno na použití stávajících restrikčních stránek v oblasti zájmu a methylace, která se nevyskytuje v kontextu konkrétního restrikčního místa, nebude testována.
- Neúplné trávení restrikčními enzymy po PCR může zmást analýzu: neúplné štěpení by naznačovalo nedostatek methylace DNA (při štěpení enzymem citlivým na methylaci, jako je HpaII). Je také známo, že BstUI může řezat na nepřevedených místech, což vede k nadhodnocení úrovní methylace, a proto je často nutné použití HpaII.[9]
- Ve složitých vzorcích heterogenita buněčného typu může zmást analýzu protože DNA není sekvenována, heterogenita sekvencí z různých buněk ve vzorku (tj. různé buněčné populace v nádoru), které získaly mutace ve vyšetřované oblasti, jako je změna CG dinukleotidu na CA nebo CT, by vedly ke ztrátě restrikčního místa, což by vedlo ke zjevně methylované oblasti kvůli nedostatečnému trávení. To by zkreslilo kvantifikaci úrovní methylace DNA v daném vzorku.
Alternativy
Obecně se COBRA často kombinuje s jinými analýzami methylace DNA a často se používá při počátečním screeningu zájmových míst. Pokud COBRA navrhuje pozměněné methylační vzorce, lze použít přísnější techniky náročné na práci, jako je bisulfitové sekvenování nebo MeDIP. K detekci methylace DNA lze použít také PacBio sekvenování.
Reference
- ^ Xiong, Zhenggang; Laird, Peter W. (1997). „COBRA: citlivý a kvantitativní test methylace DNA“. Výzkum nukleových kyselin. 25 (12): 2532–2534. doi:10.1093 / nar / 25.12.2532. PMC 146738. PMID 9171110.
- ^ Laird, Peter W. (2003). „Síla a příslib markerů methylace DNA“. Nature Reviews Cancer. 3 (Duben): 253–266. doi:10.1038 / nrc1045. PMID 12671664. Tento dokument měl podle 576 referencí k 2. – 11. Února Scopus
- ^ Shen, Lanlan; et al. (2005). „Methylace promotoru MGMT a defekt pole u sporadického karcinomu tlustého střeva a konečníku“. Journal of the National Cancer Institute. 97 (18): 1330–1338. CiteSeerX 10.1.1.536.6096. doi:10.1093 / jnci / dji275. PMID 16174854.
- ^ Suter, Catherine, M .; et al. (2004). „Germimální epimutace v MLH1 u jedinců s více druhy rakoviny“. Genetika přírody. 36 (5): 497–501. doi:10.1038 / ng1342. PMID 15064764.
- ^ Bliek, Jet; et al. (2009). „Hypomethylace ve více mateřských methylovaných potištěných oblastech, včetně lokusů PLAGL1 a GNAS v Beckwith – Wiedemann_syndrome, a charakterizace vzorů methylace DNA v genomu během vývoje u savců“ (PDF). European Journal of Human Genetics. 17 (5): 611–618. doi:10.1038 / ejhg.2008.233. PMC 2986258. PMID 19092779.
- ^ Wernig, Marius; et al. (2007). „Přeprogramování fibroblastů in vitro do stavu podobného pluripotentním ES buňkám“. Příroda. 448 (7151): 318–324. Bibcode:2007 Natur.448..318W. doi:10.1038 / nature05944. PMID 17554336.
- ^ Mikkelsen, Tarjei S .; et al. (2008). „Disekující přímé přeprogramování pomocí integrativní genomické analýzy“. Příroda. 454 (Červenec): 49–56. Bibcode:2008Natur.454 ... 49M. doi:10.1038 / nature07056. PMC 2754827. PMID 18509334.
- ^ Hattori, M .; et al. (2009). „Diagnóza Russell-Silverova syndromu kombinovanou analýzou bisulfitové restrikční analýzy - denaturující vysoce účinnou kapalinovou chromatografií“. Genetické testování a molekulární biomarkery. 13 (5): 623–630. doi:10.1089 / gtmb.2009.0018. PMID 19814617.
- ^ Fraga, Mario F .; Esteller, Manel (2002). „Methylace DNA: profil metod a aplikací“. Biotechniky. 33 (3): 633–649. doi:10.2144 / 02333rv01. PMID 12238773.

