Analýza buněčného cyklu - Cell cycle analysis
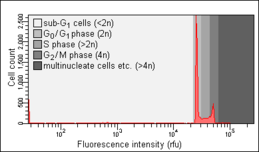
Analýza buněčného cyklu měřením obsahu DNA je metoda, která se nejčastěji používá průtoková cytometrie rozlišovat buňky v různých fázích buněčný cyklus. Před analýzou jsou buňky obvykle permeabilizovaný a ošetřeno a fluorescenční barvivo to skvrny DNA kvantitativně, jako např propidium jodid (PI) nebo 4,6-diamidino-2-fenylindol (DAPI). Intenzita fluorescence obarvených buněk koreluje s množstvím DNA, které obsahují. Protože se během DNA obsah DNA zdvojnásobuje S fáze obsah DNA (a tím i intenzita fluorescence) buněk v G0 fáze a G1 fáze (před S), ve fázi S a ve fázi S G2 fáze a M fáze (po S) identifikuje polohu fáze buněčného cyklu v hlavních fázích (G0/G1 proti S proti G.2/ M fáze) buněčného cyklu. Obsah buněčné DNA v jednotlivých buňkách je často vykreslován jako jejich frekvenční histogram, který poskytuje informace o relativní frekvenci (procento) buněk v hlavních fázích buněčného cyklu.
Anomálie buněčného cyklu odhalené na histogramu frekvence obsahu DNA jsou často pozorovány po různých typech poškození buněk, například po takových Poškození DNA který jistě přeruší postup buněčného cyklu kontrolní body. Takové zastavení progrese buněčného cyklu může vést buď k účinné opravě DNA, která může zabránit transformaci normálu na rakovinnou buňku (karcinogeneze ), nebo k buněčné smrti, často způsobem apoptóza. Zatčení buněk v G0 nebo G.1 je často vnímán jako důsledek nedostatku živin (růstových faktorů), například po sérum deprivace. Analýza buněčného cyklu byla poprvé popsána v roce 1969 v Vědecká laboratoř Los Alamos skupinou z University of California za použití Barvení Feulgenem technika.[1] První protokol pro analýzu buněčného cyklu pomocí barvení propidium jodidem byl představen v roce 1975 autorem Awtar Krishan z Harvardská lékařská škola a je dodnes široce citován.[2]
Multiparametrická analýza buněčného cyklu zahrnuje kromě měření obsahu buněčné DNA i další složky / vlastnosti související s buněčným cyklem. Souběžné měření obsahu buněčné DNA a RNA nebo náchylnosti DNA k denaturaci při nízkém pH pomocí metachromatického barviva akridinová oranžová, odhaluje G.1Q, G.1Aa G.1B oddíly buněčného cyklu a také umožňuje rozlišovat mezi S, G2 a mitotické buňky.[3] Buňky v G1Q jsou v klidu, dočasně staženy z buněčného cyklu (také identifikovatelné jako G0), G1A jsou ve fázi růstu, zatímco G1B jsou buňky těsně před vstupem do S, jejichž růst (obsah RNA a bílkovin, velikost) je podobný růstu buněk iniciujících replikaci DNA. Podobné oddíly buněčného cyklu jsou také rozpoznávány multiparametrovou analýzou, která zahrnuje měření exprese cyklin D1, cyklin E, cyklin A a cyklin B1, každý ve vztahu k obsahu DNA [4] Souběžné měření obsahu DNA a začlenění prekurzoru DNA 5-brom-2'-deoxyuridin (BrdU) průtokovou cytometrií je obzvláště užitečným testem, který se široce používá při analýze buněčného cyklu in vitro a in vivo.[5] Začlenění 5-ethynyl-2'-deoxyuridin (EdU), předchůdce, jehož detekce nabízí určité výhody oproti BrdU, se nyní stal upřednostňovanou metodikou pro detekci buněk replikujících DNA (fáze S).[6]
experimentální procedura
Pokud se barvení neprovádí pomocí Hoechst 33342, prvním krokem při přípravě buněk na analýzu buněčného cyklu je permeabilizace buněk plazmatické membrány. To se obvykle provádí inkubací v a pufrovací roztok obsahující mírné čisticí prostředek[7] jako Triton X-100 nebo NP-40 nebo fixační je dovnitř ethanol. Většina fluorescenčních barviv DNA (jedna z výjimek je Hoechst 33342 ) nejsou prostupující plazmatickou membránou, to znamená, že nemohou projít neporušenou buněčnou membránou. Permeabilizace je proto zásadní pro úspěch dalšího kroku, barvení buněk.
Před (nebo během kroku barvení) jsou buňky často ošetřeny RNáza A odebrat RNA. To je důležité, protože určitá barviva, která obarvují DNA, také obarví RNA, a tak vytvoří artefakty to by zkreslilo výsledky. Výjimkou je metachromatický fluorochrom akridinová oranžová, které podle specifického protokolu barvení mohou odlišně barvit jak RNA (generující červenou luminiscenci), tak DNA (zelená fluorescence), nebo v jiném protokolu po odstranění RNA a částečné denaturaci DNA odlišně barvit dvouvláknovou DNA (zelená fluorescence) versus jednořetězcová DNA (červená luminiscence)[3]. Kromě propidium jodidu a akridinové pomeranče patří mezi často používaná kvantifikovatelná barviva (mimo jiné) DRAQ5, 7-Aminoactinomycin D, DAPI a Hoechst 33342.
Diskriminační diskriminace
Vzhledem k tomu, že buňky a zejména fixované buňky mají tendenci se držet pohromadě, musí být buněčné agregáty vyloučeny z analýzy pomocí tzv diskriminace dubletu. To je důležité, protože dublet dvou G0/G1 buňky mají stejný celkový obsah DNA a tedy stejnou intenzitu fluorescence jako jediný G2/ M buňka.[8][9] Pokud není uznán jako takový G0/G1 dublety by přispěly k falešně pozitivní identifikace a počet G2/ M buněk.
Související metody
Stanovení Nicoletti
The Stanovení Nicoletti, pojmenovaná po svém vynálezci, italském lékaři Ildo Nicoletti, je upravená forma analýzy buněčného cyklu. Používá se k detekci a kvantifikaci apoptóza, forma programovaná buněčná smrt, analýzou buněk s obsahem DNA nižším než 2 n („sub-G0/G1 buňky "). Tyto buňky jsou obvykle výsledkem apoptotická fragmentace DNA: během apoptózy je DNA buněčně degradována endonukleázy. Proto, jádra apoptotických buněk obsahuje méně DNA než jádra zdravého G.0/G1 buněk, což má za následek sub-G0/G1 vrchol fluorescence histogram které lze použít ke stanovení relativního množství apoptotických buněk ve vzorku. Tato metoda byla vyvinuta a poprvé popsána v roce 1991 Nicoletti a spolupracovníky společnosti Univerzita v Perugii Lékařská fakulta.[10] V roce 2006 byl publikován optimalizovaný protokol vyvinutý dvěma autory původní publikace.[11] Objekty měřené v sub-G0/G1 pík s obsahem DNA menším než 5% obsahu G0G1 vrchol, jsou s největší pravděpodobností apoptotická těla, a proto nepředstavují jednotlivé apoptotické buňky [12]
- Nicolettiho test se zdravými (levými) a apoptotickými (středními a pravými) buňkami
Zdravé buňky. Všimněte si absence sub-G0/G1 vrchol.

Apoptotické buňky jeden den po indukci apoptózy. Všimněte si přítomnosti sub-G0/G1 vrchol.

Apoptotické buňky několik dní po indukci apoptózy. Všimněte si relativního nárůstu sub-G0/G1 vrchol.
Reference
- ^ Van Dilla MA, Trujillo TT, Mullaney PF, Coulter JR (14. března 1969). „Mikrofluorometrie buněk: metoda rychlého měření fluorescence“. Věda. 163 (3872): 1213–1214. Bibcode:1969Sci ... 163.1213V. doi:10.1126 / science.163.3872.1213. PMID 5812751.
- ^ Krishan A. (červenec 1975). „Rychlá cytofluorometrická analýza buněčného cyklu savců barvením propidium jodidem“. The Journal of Cell Biology. 66 (1): 188–193. doi:10.1083 / jcb.66.1.188. PMC 2109516. PMID 49354.
- ^ Darzynkiewicz Z, Traganos F, Melamed MR (1980). "Nové oddíly buněčného cyklu identifikované multiparametrovou průtokovou cytometrií". Cytometrie. 1 (2): 98–108. doi:10,1002 / cyto.990010203. PMID 6170495.
- ^ Darzynkiewicz Z, Gong JP, Juan G, Ardelt B, Traganos F (1996). "Cytometrie cyklinových proteinů". Cytometrie. 25 (1): 1–13. doi:10.1002 / (SICI) 1097-0320 (19960901) 25: 1 <1 :: AID-CYTO1> 3.0.CO; 2-N. PMID 8875049.
- ^ Gray JW, Dolbeare F, Pallavicini MG, Beisker W, Waldman F (1986). "Analýza buněčného cyklu pomocí průtokové cytometrie". Int J Radiat Biol Relat Stud Phys Chem Chem Med. 49 (2): 237–55. doi:10.1080/09553008514552531. PMID 3510993.
- ^ Buck SB, Bradford J, Gee KR, Agnew BJ, Clarke ST, Salic A (2008). „Detekce progrese buněčného cyklu na S-fázi pomocí inkorporace 5-ethynyl-2'-deoxyuridinu chemií klikání, alternativa k použití protilátek proti 5-brom-2'-deoxyuridinu“. Biotechniky. 44 (7): 927–9. doi:10.2144/000112812. PMID 18533904.
- ^ Vindeløv LL, Christensen IJ, Nissen NI (březen 1983). „Detergent-trypsinová metoda pro přípravu jader pro analýzu průtokovou cytometrickou DNA“. Cytometrie. 3 (5): 323–327. doi:10,1002 / cyto.990030503. PMID 6188586.
- ^ Sharpless T, Traganos F, Darzynkiewicz Z, Melamed MR (1975). "Průtoková cytofluorimetrie: rozlišení mezi jednotlivými buňkami a agregáty buněk přímým měřením velikosti". Acta Cytol. 19 (6): 577–81. PMID 1108568.
- ^ Wersto RP, Chrest FJ, Leary JF, Morris C, Stetler-Stevenson MA, Gabrielson E (15. října 2001). „Diskriminační diskriminace v analýze buněčného cyklu DNA“. Cytometrie. 46 (5): 296–306. doi:10,1002 / cyto.1171. PMID 11746105.
- ^ Nicoletti I, Migliorati G, Pagliacci MC, Grignani F, Riccardi C (3. června 1991). "Rychlá a jednoduchá metoda pro měření apoptózy thymocytů barvením propidium jodidem a průtokovou cytometrií". Journal of Immunological Methods. 139 (2): 271–279. doi:10.1016 / 0022-1759 (91) 90198-O. PMID 1710634.
- ^ Riccardi C, Nicoletti I (9. listopadu 2006). "Analýza apoptózy barvením propidium jodidem a průtokovou cytometrií". Přírodní protokoly. 1 (3): 1458–1461. doi:10.1038 / nprot.2006.238. PMID 17406435.
- ^ Darzynkiewicz Z, Bedner E, Traganos F (2001). „Potíže a úskalí při analýze apoptózy“. Metody Cell Biol. 63: 527–559. doi:10.1016 / s0091-679x (01) 63028-0. PMID 11060857.
Další čtení
- "Základy buněčného cyklu" (PDF). University College v Londýně. Archivovány od originál (PDF, 0,1 MB) dne 06.06.2011. Citováno 2010-05-20.
- Rabinovitch, Peter. "Úvod do analýzy buněčného cyklu" (PDF, 0,5 MB). Phoenix Flow Systems, Inc.. Citováno 2010-05-20.