Kostní sialoprotein - Bone sialoprotein
| IBSP | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| Identifikátory | |||||||||||||||||||||||||
| Aliasy | IBSP, BNSP, BSP, BSP-II, SP-II, integrin vázající sialoprotein | ||||||||||||||||||||||||
| Externí ID | OMIM: 147563 MGI: 96389 HomoloGene: 3644 Genové karty: IBSP | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortology | |||||||||||||||||||||||||
| Druh | Člověk | Myš | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (protein) | |||||||||||||||||||||||||
| Místo (UCSC) | Chr 4: 87,8 - 87,81 Mb | Chr 5: 104,3 - 104,31 Mb | |||||||||||||||||||||||
| PubMed Vyhledávání | [3] | [4] | |||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Kostní sialoprotein (BSP) je součástí mineralizované tkáně jako kost, dentin, cement a kalcifikovaný chrupavka. BSP je významnou složkou kostní extracelulární matrice a bylo navrženo, že tvoří přibližně 8% všech nekolagenních proteinů nalezených v kostech a cementu.[5] BSP, a SIBLING protein, byl původně izolován z bovinní kortikální kosti jako 23-kDa glykopeptid s vysokým obsahem kyselina sialová obsah.[6][7]
Lidská varianta BSP se nazývá kostní sialoprotein 2 také známý jako sialoprotein vázající se na buňky nebo integrin vázající sialoprotein a je kódován IBSP gen.[8]
Struktura
Nativní BSP má na základě zdánlivé molekulové hmotnosti 60-80 kDa SDS-PAGE, což je značná odchylka od předpokládané hmotnosti (na základě cDNA sekvence) přibližně 33 kDa.[9] Savčí BSP cDNA kódují proteiny v průměru 317 aminokyselin, které zahrnují 16-zbytkový preproteinový sekreční signální peptid. Mezi savčími cDNA, které jsou v současné době charakterizovány, je přibližně 45% zachování sekvenční identity a dalších 10 až 23% konzervativní substituce. Protein je vysoce kyselý (pKa ~ 3,9)[10] a obsahuje velké množství Glu zbytků, které tvoří ~ 22% z celkové aminokyseliny.
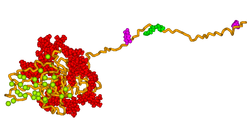
Analýzy predikce sekundární struktury a analýzy hydrofobicity naznačují, že primární sekvence BSP má otevřenou, flexibilní strukturu s potenciálem tvořit oblasti α-šroubovice a nějaký β-list.[11] Většina studií však prokázala, že BSP nemá pomocí 1D NMR žádnou a-helikální nebo β-listovou strukturu[10][12] a cirkulární dichroismus.[13] Analýza nativního proteinu elektronovou mikroskopií potvrzuje, že protein má rozšířenou strukturu o délce přibližně 40 nm.[14] Tato flexibilní konformace naznačuje, že protein má několik strukturálních domén, nicméně se předpokládá, že může existovat několik prostorově segmentovaných funkčních domén včetně hydrofobních kolagen -vázací doména (rattus norvegicus zbytky 36-57),[15] A hydroxyapatit - nukleační oblast sousedících zbytků kyseliny glutamové (rattus norvegicus zbytky 78-85, 155-164)[13] a klasický integrin -vázací motiv (RGD) poblíž C-terminálu (rattus norvegicus zbytky 288-291).
Ukázalo se, že BSP je značně posttranslačně modifikován, přičemž sacharidy a další modifikace obsahují přibližně 50% molekulové hmotnosti nativního proteinu.[16][17] Tyto modifikace, které zahrnují N- a O-vazbu glykosylace, tyrosin sulfatace a serin a threonin fosforylace, aby byl protein vysoce heterogenní.
3D model lidského kostního sialoproteinu byl vyvinut pomocí technik molekulárního modelování, jak je znázorněno na obrázku výše. Model naznačuje, že protein poskytuje flexibilní templát pro rychlé samo-sestavení iontů vápníku a fosforečnanu, takže nukleuje růst krystalů hydroxyapatitu.[18]
Funkce
Množství BSP v kostech a dentinu je zhruba stejné,[19] funkce BSP v těchto mineralizovaných tkáních však není známa. Jednou z možností je, že BSP působí jako jádro pro tvorbu prvního apatit krystaly.[20] Protože se apatit tvoří podél kolagenových vláken v extracelulární matrici, BSP by pak mohl pomoci nasměrovat, přesměrovat nebo inhibovat růst krystalů.
Mezi další role BSP patří angiogeneze a ochrana před buněčnou lýzou zprostředkovanou komplementem. Regulace genu BSP je důležitá pro mineralizaci kostní matrice a růst tumoru v kosti.[21]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000029559 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000029306 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Fisher LW, McBride OW, Termine JD, Young MF (únor 1990). "Lidský kostní sialoprotein. Snížená sekvence proteinu a chromozomální lokalizace". J. Biol. Chem. 265 (4): 2347–51. PMID 2404984.
- ^ Williams PA, Peacocke AR (listopad 1965). "Fyzikální vlastnosti glykoproteinu z bovinní kortikální kosti (kostní sialoprotein)". Biochim. Biophys. Acta. 101 (3): 327–35. doi:10.1016/0926-6534(65)90011-4. PMID 5862222.
- ^ Sleď GM (únor 1964). "Srovnání sialoproteinu z hovězí kosti a orosomucoidu v séru". Příroda. 201 (4920): 709. doi:10.1038 / 201709a0. PMID 14139700. S2CID 4210187.
- ^ Kerr JM, Fisher LW, Termine JD, Wang MG, McBride OW, Young MF (srpen 1993). „Gen pro lidský kostní sialoprotein (IBSP): genomová lokalizace a charakterizace“. Genomika. 17 (2): 408–15. doi:10.1006 / geno.1993.1340. PMID 8406493.
- ^ Fisher LW, Whitson SW, Avioli LV, Termine JD (říjen 1983). "Matrix sialoprotein vyvíjející se kosti". J. Biol. Chem. 258 (20): 12723–7. PMID 6355090.
- ^ A b Stubbs JT, Mintz KP, Eanes ED, Torchia DA, Fisher LW (srpen 1997). „Charakterizace nativního a rekombinantního kostního sialoproteinu: vymezení minerálních vazebných a buněčných adhezních domén a strukturní analýza RGD domény“. J. Bone Miner. Res. 12 (8): 1210–22. doi:10.1359 / jbmr.1997.12.8.1210. PMID 9258751. S2CID 26407786.
- ^ Shapiro HS, Chen J, Wrana JL, Zhang Q, Blum M, Sodek J (listopad 1993). "Charakterizace sialoproteinu prasečích kostí: primární struktura a buněčná exprese". Matice. 13 (6): 431–40. doi:10.1016 / s0934-8832 (11) 80109-5. PMID 8309422.
- ^ Fisher LW, Torchia DA, Fohr B, Young MF, Fedarko NS (leden 2001). „Flexibilní struktury proteinů SIBLING, kostního sialoproteinu a osteopontinu“. Biochem. Biophys. Res. Commun. 280 (2): 460–5. doi:10,1006 / bbrc.2000.4146. PMID 11162539.
- ^ A b Tye CE, Rattray KR, Warner KJ, Gordon JA, Sodek J, Hunter GK, Goldberg HA (březen 2003). "Vymezení hydroxyapatitových nukleačních domén kostního sialoproteinu". J. Biol. Chem. 278 (10): 7949–55. doi:10,1074 / jbc.M211915200. PMID 12493752.
- ^ Oldberg A, Franzén A, Heinegård D (prosinec 1988). "Primární struktura kostního sialoproteinu vázajícího se na buňky". J. Biol. Chem. 263 (36): 19430–2. PMID 3198635.
- ^ Tye CE, Hunter GK, Goldberg HA (duben 2005). "Identifikace kolagenové vazebné domény typu I sialoproteinu a charakterizace mechanismu interakce". J. Biol. Chem. 280 (14): 13487–92. doi:10,1074 / jbc.M408923200. PMID 15703183.
- ^ Kinne RW, Fisher LW (červenec 1987). „Keratan sulfát proteoglykan v králičí kompaktní kosti je kostní sialoprotein II“. J. Biol. Chem. 262 (21): 10206–11. PMID 2956253.
- ^ Ganss B, Kim RH, Sodek J (1999). „Kostní sialoprotein“. Krit. Rev. Oral Biol. Med. 10 (1): 79–98. doi:10.1177/10454411990100010401. PMID 10759428.
- ^ Vincent K, Durrant MC (2013). „Strukturální a funkční model pro lidský kostní sialoprotein“ (PDF). J. Mol. Graf. Modelka. 39: 108–117. doi:10.1016 / j.jmgm.2012.10.007. PMID 23261880.
- ^ Qin C, Brunn JC, Jones J, George A, Ramachandran A, Gorski JP, Butler WT (duben 2001). "Srovnávací studie proteinů bohatých na kyselinu sialovou v krysí kosti a dentinu". Eur. J. Oral Sci. 109 (2): 133–41. doi:10.1034 / j.1600-0722.2001.00001.x. PMID 11347657.
- ^ Hunter GK, Goldberg HA (srpen 1994). „Modulace tvorby krystalů kostními fosfoproteiny: role sekvencí bohatých na kyselinu glutamovou v nukleaci hydroxyapatitu kostním sialoproteinem“. Biochem. J. 302 (Pt 1) (Pt 1): 175–9. doi:10.1042 / bj3020175. PMC 1137206. PMID 7915111.
- ^ Ogata Y (duben 2008). "Kostní sialoprotein a jeho transkripční regulační mechanismus". J. Periodont. Res. 43 (2): 127–35. doi:10.1111 / j.1600-0765.2007.01014.x. PMID 18302613.
externí odkazy
- Člověk IBSP umístění genomu a IBSP stránka s podrobnostmi o genu v UCSC Genome Browser.
Další čtení
- Karadag A, Fisher LW (2006). „Kostní sialoprotein zvyšuje migraci stromálních buněk kostní dřeně přes matice přemostěním MMP-2 na alfa (v) beta3-integrin“. J. Bone Miner. Res. 21 (10): 1627–36. doi:10.1359 / jbmr.060710. PMID 16995818. S2CID 84886034.
- Barnes GL, Javed A, Waller SM a kol. (2003). „Transkripční faktory související s osteoblasty Runx2 (Cbfa1 / AML3) a MSX2 zprostředkovávají expresi kostního sialoproteinu v lidských metastatických buňkách rakoviny prsu“. Cancer Res. 63 (10): 2631–7. PMID 12750290.
- Carlinfante G, Vassiliou D, Svensson O a kol. (2003). „Diferenciální exprese osteopontinu a kostního sialoproteinu v kostních metastázách karcinomu prsu a prostaty“. Clin. Exp. Metastáza. 20 (5): 437–44. doi:10.1023 / A: 1025419708343. PMID 14524533. S2CID 341938.
- Hwang Q, Cheifetz S, Celkově CM a kol. (2009). „Kostní sialoprotein neinteraguje s pro-želatinázou A (MMP-2) nebo zprostředkovává aktivaci MMP-2“. Rakovina BMC. 9: 121. doi:10.1186/1471-2407-9-121. PMC 2679042. PMID 19386107.
- Styrkarsdottir U, Halldorsson BV, Gretarsdottir S a kol. (2009). "Nové varianty sekvencí spojené s kostní minerální hustotou". Nat. Genet. 41 (1): 15–7. doi:10,1038 / ng.284. PMID 19079262. S2CID 9876454.
- Zhang L, Hou X, Lu S a kol. (2010). „Prediktivní význam kostního sialoproteinu a osteopontinu pro kostní metastázy u resekovaných čínských nemalobuněčných pacientů s karcinomem plic: velká kohortní retrospektivní studie“. Rakovina plic. 67 (1): 114–9. doi:10.1016 / j.lungcan.2009.03.017. PMID 19376608.
- Roca H, Phimphilai M, Gopalakrishnan R a kol. (2005). „Kooperativní interakce mezi RUNX2 a místy vázajícími proteiny homeodomény jsou rozhodující pro expresi kostního sialoproteinového genu specifického pro osteoblasty“. J. Biol. Chem. 280 (35): 30845–55. doi:10,1074 / jbc.M503942200. PMID 16000302.
- Lamour V, Detry C, Sanchez C a kol. (2007). „Represe zprostředkovaná runx2- a histon-deacetylázou 3 je uvolněna při diferenciaci lidských buněk osteoblastů, což umožňuje vysokou expresi sialoproteinu v kostech“. J. Biol. Chem. 282 (50): 36240–9. doi:10,1074 / jbc.M705833200. PMID 17956871.
- Ogata Y (2008). "Kostní sialoprotein a jeho transkripční regulační mechanismus". J. Periodont. Res. 43 (2): 127–35. doi:10.1111 / j.1600-0765.2007.01014.x. PMID 18302613.
- Papotti M, Kalebic T, Volante M a kol. (2006). „Kostní sialoprotein předpovídá kostní metastázy u resekovatelného nemalobuněčného karcinomu plic: retrospektivní studie případové kontroly“. J. Clin. Oncol. 24 (30): 4818–24. doi:10.1200 / JCO.2006.06.1952. PMID 17050866.
- Frank O, Heim M, Jakob M a kol. (2002). "Kvantitativní RT-PCR analýza stromálních buněk lidské kostní dřeně v reálném čase během osteogenní diferenciace in vitro". J. Cell. Biochem. 85 (4): 737–46. doi:10.1002 / jcb.10174. PMID 11968014. S2CID 23595289.
- Yerges LM, Klei L, Cauley JA a kol. (2009). „High-Density Association Study of 383 Candidate Genes for Volumetric BMD at the femoral Neck and Lumbar Spine Between Older Men“. J. Bone Miner. Res. 24 (12): 2039–49. doi:10,1359 / jbmr.090524. PMC 2791518. PMID 19453261.
- Gordon JA, Sodek J, Hunter GK, Goldberg HA (2009). „Kostní sialoprotein stimuluje signální dráhy související s fokální adhezí: role v migraci a přežití buněk rakoviny prsu a prostaty“. J. Cell. Biochem. 107 (6): 1118–28. doi:10.1002 / jcb.22211. PMID 19492334. S2CID 36937586.
- Araki S, Mezawa M, Sasaki Y a kol. (2009). „Regulace parathormonu transkripce genu lidské kostní sialoproteinu je zprostředkována dvěma prvky reakce cAMP“. J. Cell. Biochem. 106 (4): 618–25. doi:10.1002 / jcb.22039. PMID 19127545. S2CID 5586385.
- Wuttke M, Müller S, Nitsche DP, Paulsson M, Hanisch FG, Maurer P (září 2001). „Strukturální charakterizace lidského rekombinantního a kostního sialoproteinu odvozeného od kosti. Funkční důsledky pro připojení buněk a vazbu hydroxyapatitu“. J. Biol. Chem. 276 (39): 36839–48. doi:10,1074 / jbc.M105689200. PMID 11459848.
- Hilbig H, Wiener T, Armbruster FP a kol. (2005). "Účinky povrchů zubních implantátů na expresi kostního sialoproteinu v buňkách odvozených z lidské mandibulární kosti". Med. Sci. Monit. 11 (4): BR111–5. PMID 15795688.
- Koller DL, Ichikawa S, Lai D a kol. (2010). „Studie asociace genomu v celé kostní hustotě minerálů u předmenopauzálních evropských a amerických žen a replikace u afroamerických žen“. J. Clin. Endokrinol. Metab. 95 (4): 1802–9. doi:10.1210 / jc.2009-1903. PMC 2853986. PMID 20164292.
- Strausberg RL, Feingold EA, Grouse LH a kol. (2002). „Generování a počáteční analýza více než 15 000 lidských a myších cDNA sekvencí plné délky“. Proc. Natl. Acad. Sci. USA. 99 (26): 16899–903. doi:10.1073 / pnas.242603899. PMC 139241. PMID 12477932.
- Fujisawa R (2002). "[Nedávný pokrok ve výzkumu proteinů kostní matrice]". Nippon Rinsho. 60 Suppl 3: 72–8. PMID 11979972.
- Loibl S, Königs A, Kaufmann M, Costa SD, Bischoff J (prosinec 2006). „[PTHrP a kostní sialoprotein jako prognostické markery pro rozvoj kostních metastáz u pacientů s rakovinou prsu]“. Zentralbl Gynakol (v němčině). 128 (6): 330–5. doi:10.1055 / s-2006-942314. PMID 17213971.
- Uccello M, Malaguarnera G, Vacante M a kol. (2011). "Hladiny sialoproteinu v kostní séru a kostní metastázy". J. Cancer Res. Ther. 7 (2): 115–9. doi:10.4103/0973-1482.82912. PMID 21768695.




